不同宫颈转化区类型对HSIL患者LEEP术后切缘阳性的影响
李庆梅,王兴红,李 耀,庞 飞
(玉林市妇幼保健院,广西 玉林 537000)
宫颈鳞癌(squamous cell carcinoma,SCC)属于宫颈癌的一种类型,其致死率较高,据不完全统计,全世界新发病例已超过13万/年[1]。SCC是由30多种高危型人乳头瘤病毒(human papilloma virus,HPV)持续感染生殖道黏膜上皮所引起的不同程度病变,在感染HPV的两年内大部分病毒可被自身免疫系统清除,少部分进展为癌前病变,患者出现白带增多、轻微接触性出血等症状[2]。宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN)是一种可逆性癌前病变,可分为CINⅠ~Ⅲ三个等级,包括低度鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)和高度鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)[3]。女性到青春期后在雌激素的作用下,宫颈外口的柱状上皮发生移位,受阴道酸性环境及病原体的作用逐渐呈现出红色粗糙状“糜烂”进而转化为CIN,在移位前后之间的区域即为宫颈转化区(transformation zone,TZ),分为TZⅠ~Ⅲ三种类型[4]。随着我国对女性健康宣教力度的不断加大,越来越多的妇科恶性肿瘤患者能做到早发现、早治疗。近年来,我国HSIL发病趋势逐渐年轻化,且有关TZ在HSIL中作用的报道相对较少。因此,本研究以HSIL患者为研究对象,探讨不同TZ类型对HSIL患者宫颈环形电刀切除术(loop electrosurgical excision procedure,LEEP)术后切缘阳性的影响及原因,为TZⅠ~Ⅲ的HSIL患者个性化治疗提供新的思路。
1资料与方法
1.1研究对象
选取2019年1月至2021年12月在玉林市妇幼保健院行LEEP治疗的1 084例宫颈HSIL患者为研究对象。纳入标准:①患者的病历资料记录完整并能按要求定期随访;②经阴道镜检查联合镜下宫颈活检结果确诊为HSIL患者;③患者无其他内外科合并症;④患者检查前24h避免冲洗阴道和性生活。排除标准:①行子宫颈冷刀锥形切除术等其他类型手术治疗的患者;②CIN I、LSIL患者;③阴道毛滴虫、念珠菌、淋菌等炎症感染患者;④曾接受过宫颈疾病治疗的患者。以HSIL患者LEEP术切除标本的病理诊断结果为最终标准,将研究对象分为切缘阳性组(n=159)和切缘阴性组(n=925)。通过定期门诊复查的方式对出院患者进行为期1年的随访,时间分别为患者术后1、3、6、9、12个月。随访内容以患者术后恢复、病灶有无残留为主,包括高危HPV检查、薄层液基细胞学检查等,复查结果均记录在患者电子病历中。
1.2诊断标准
1.2.1宫颈HSIL的检测
对患者进行阴道镜检查联合镜下宫颈活检术,采用电子阴道镜数字成像系统辅以醋酸和碘试验,观察宫颈上皮病变情况,对病变可疑区域做多点定位活检,将收集的组织用10%中性缓冲甲醛水溶液固定后通过我院病理科检查诊断宫颈HSIL。
1.2.2宫颈转化区分类标准
根据2019年国际宫颈病理与阴道镜联盟发布的子宫颈癌筛查和管理指南中关于宫颈转化区分类的声明,观察阴道镜检查时转化区是否可以充分暴露,将转化区分为Ⅰ~Ⅲ共3种类型。其中,Ⅰ型、Ⅱ型转化区可以在阴道镜下直接或借助器械辅助观察到完整的转化区,Ⅲ型转化区在阴道镜下无论借助何种常规手段都不能使转化区完全暴露,见表1。

表1 宫颈转化区分类标准
1.2.3切缘阳性诊断标准
根据世界卫生组织对LEEP术后切缘阳性的诊断标准[5],由两位有经验的病理科医师观察384例HSIL患者的切缘情况,对术后病理结果进行诊断及复核。如果在切缘表面或近切缘1mm以内有病变存在,则判为切缘阳性,其中根据病灶可见的宫颈部位分为内切缘阳性和外切缘阳性;反之,若切除物边缘无病变则为切缘阴性。
1.3资料收集
通过电子病历收集患者的一般资料,包括姓名、年龄、病程、绝经情况、妊娠史、家族遗传史等。待主刀医生与患者商定手术时间后行LEEP手术治疗,切除后将新鲜的离体标本立即浸入10%中性缓冲甲醛水溶液中固定,在软木板或泡沫板上用墨汁标记肿瘤的内切缘,核对临床送检标本信息和患者信息后送至我院病理科出具完整的病理学报告,包括切缘情况、病变级别、病变范围、病灶是否残留等病理检查结果。
1.4治疗方法
依据《中国常见妇科恶性肿瘤诊治指南(2019版)》相关规定,CIN Ⅱ~Ⅲ的HSIL患者应行宫颈锥切术。患者LEEP术前1周禁止性生活,经术前常规检查和医师评估手术耐受度达标,患者及家属均签署手术知情同意书后方可实施。术中根据患者情况采用腰硬联合麻醉或静脉全麻并取患者膀胱截石位,进行外阴及阴道部常规消毒后铺无菌洞巾,充分暴露宫颈后以复方碘液涂抹,根据病变范围选择合适的电切圈并调整电刀输出功率,于未着色区域外0.5cm处开始从左至右、从上至下锥形切除病变部位及其下方宫颈间质,切除后观察创面,如有明显出血可采取电凝止血,至无活动性出血即手术完毕。术后24h内阴道填塞碘纱压迫宫颈创面止血,给予适量抗生素预防感染。
1.5统计学方法
采用SPSS 26.0软件进行统计学分析,计数资料用例数(n)和百分比(%)表示,组间比较采用χ2检验;采用多因素Logistic回归分析HSIL患者LEEP术后切缘阳性的影响因素。采用R 3.3.2软件和“rms”软件包拟合独立影响因素,构建列线图模型;采用受试者工作特征(receiver operating characteristics,ROC)曲线下面积(area under curve,AUC)评价模型的区分度;以校准曲线评价模型的准确性;以临床决策曲线评价模型的有效性。检验水准α=0.05,P<0.05为差异有统计学意义。
2结果
2.1宫颈HSIL患者的基本情况
本研究纳入宫颈HSIL患者1 084例,年龄在19~59岁之间,平均(38.64±7.62)岁,其中19~29岁、30~39岁、40~49岁和50~59岁分别为268例(24.72%)、336例(31.00%)、302例(27.86%)和178例(16.42%);病程为3~17个月,其中已绝经者171例,未经妊娠者42例。1 084例HSIL患者中,无明显症状169例(15.59%),白带异常279例(25.74%),阴道排液245例(22.60%),阴道不规则出血231例(21.31%),接触性出血160例(14.76%)。
2.2不同TZ类型患者病理结果的比较
1 084例HSIL患者中,TZⅠ型者172例(15.87%),Ⅱ型者528例(48.71%),Ⅲ型者384例(35.42%)。患者术后病理总切缘阳性率为14.67%,其中TZⅠ型患者切缘阳性率为9.30%,TZⅡ型患者切缘阳性率为12.31%,TZ Ⅲ型患者切缘阳性率为20.31%。分析可知,随着转化区萎缩程度的加深,术后病理切缘阳性患者的比例呈上升趋势,差异有统计学意义(χ2=9.336,P<0.05)。
2.3不同切缘状况HSIL患者临床资料的比较
比较术后切缘阳性组和切缘阴性组HSIL患者的临床资料,结果如表2所示。两组患者的HPV感染情况、HPV分型、宫颈TZ分型、病变程度、是否累及腺体的差异均有统计学意义(χ2值分别为2.933、8.681、9.336、8.729和6.435,P<0.05),其余资料的差异无统计学意义(P>0.05)。
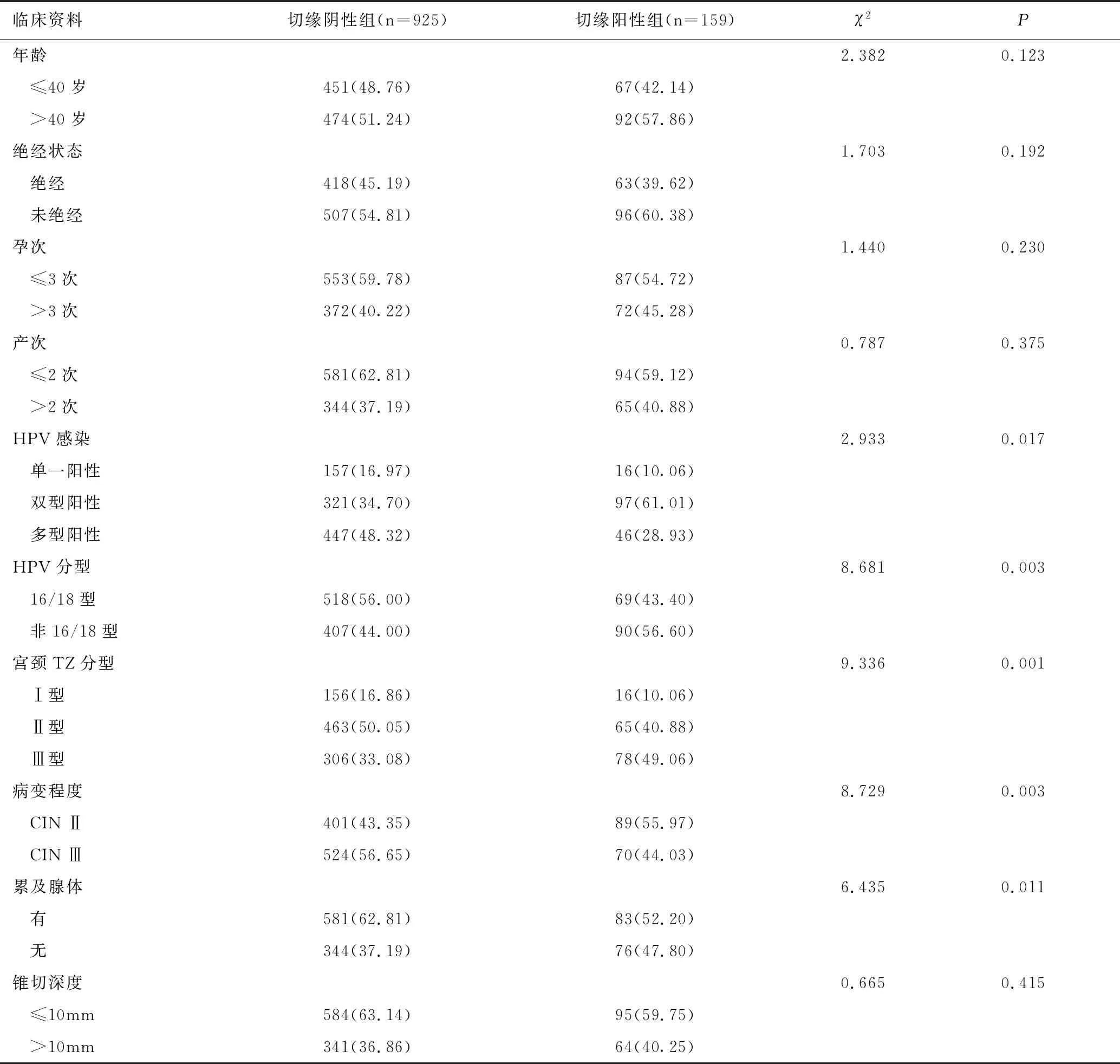
表2 两组患者临床资料的比较 [n(%)]
2.4影响HSIL患者LEEP术后切缘阳性的多因素分析
以上述差异有统计学意义的指标为自变量并进行赋值,以患者术后切缘病理检查结果(切缘阴性=0,切缘阳性=1)为因变量进行多因素Logistic分析。结果如图1所示,HPV感染呈多型阳性(OR=2.061,95%CI:1.246~2.875)、HPV16/18分型感染(OR=1.908,95%CI:1.032~2.784)、TZ Ⅲ型(OR=2.455,95%CI:1.252~3.658)、CIN Ⅲ度病变(OR=2.836,95%CI:1.135~4.537)、病灶累及腺体(OR=2.908,95%CI:1.112~4.879)是导致HSIL患者LEEP术后切缘病理结果阳性的独立危险因素(P<0.05)。

图1 影响HSIL患者LEEP术后切缘阳性的多因素分析
2.5 HSIL患者LEEP术后切缘阳性的列线图预测模型
根据多因素回归分析结果,采用R软件构建预测HSIL患者术后切缘阳性的列线图模型,结果如图2所示。HPV多型阳性积分为53分,HPV16/18分型感染为49分,TZ Ⅲ型为65分,CIN Ⅲ度病变为62分,病灶累及腺体为42分,所得总分(271分)对应的患者术后切缘阳性的发生率为94.25%。
2.6列线图模型的区分度与一致性评价
采用一致性指数(concordance index,C-index)进行模型分析,ROC曲线对模型预测值与真实值之间的区分度进行评估。经计算,该模型的C-index为0.896(95%CI:0.782~0.997),ROC曲线下面积为0.801(95%CI:0.641~0.903),提示该预测模型对HSIL患者术后切缘阳性的风险区分度较好,对患者发生切缘阳性的预测精度较高,见图3。
图3 列线图预测模型的ROC曲线
通过预测模型校准曲线分析可知,列线图模型预测概率可较好拟合实际概率;Hosmer-Lemeshow拟合优度检验显示差异无统计学意义(P>0.05),模型远离极端曲线,净获益率高,提示该列线图预测模型工作效果良好,与实际风险发生概率具有较高的一致性,校准度高,安全性强,见图4、图5。

图4 列线图预测模型的校准曲线
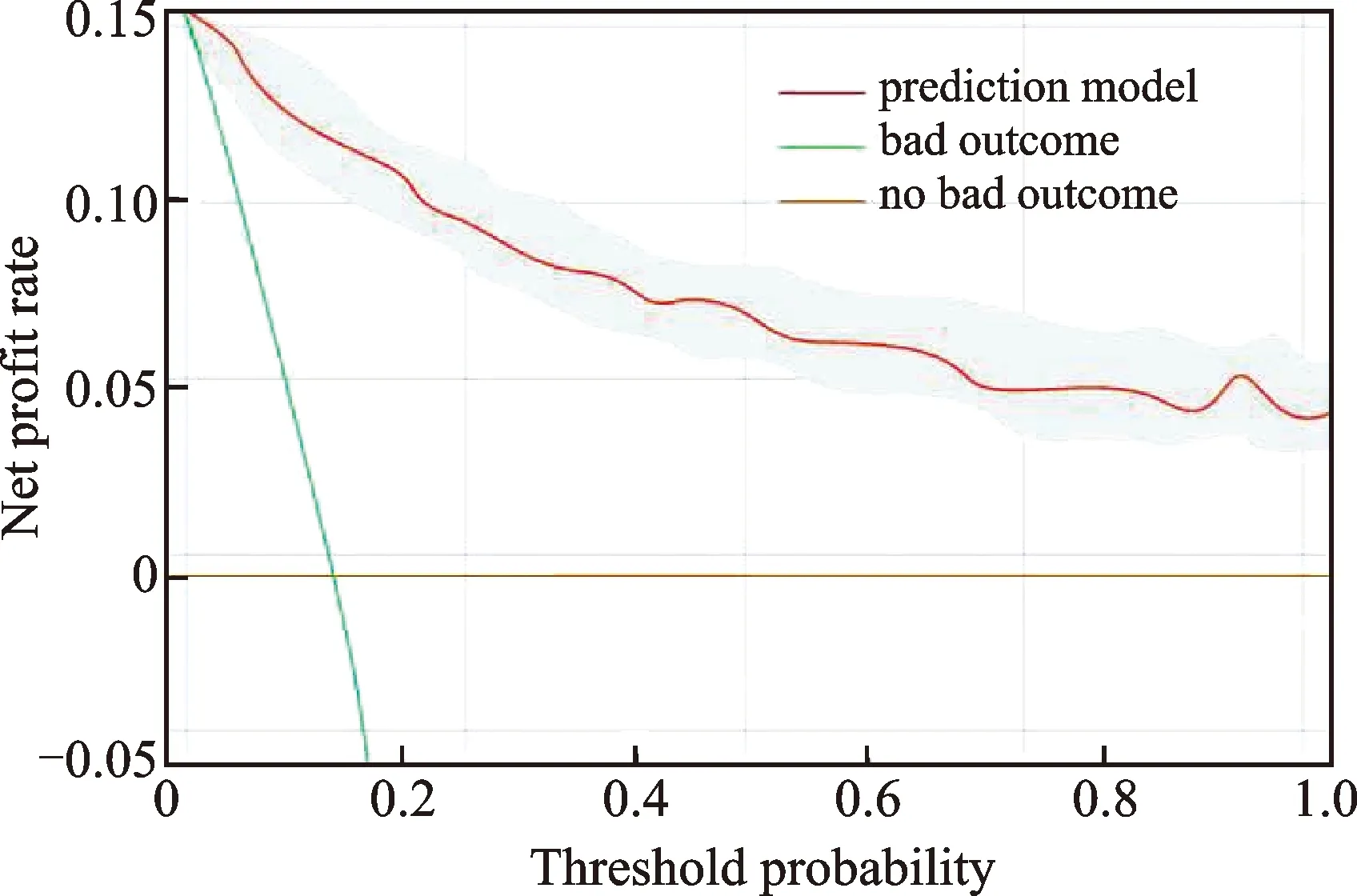
图5 列线图预测模型的决策曲线分析图
3讨论
3.1研究背景与意义
进入21世纪以来,宫颈癌成为全球第三大女性肿瘤。我国积极开展宫颈癌和癌前病变的全面筛查工作,有效减少了宫颈癌的发病率和死亡率,使大部分患者能得到及时干预和治疗,以控制病灶的发展[6]。目前,HPV病毒长期感染是癌前病变的致病因素这一观点得到国内外学者的一致认可,针对患者术后不良的研究多集中于HPV等方向,而有关TZ的研究报道相对较少[7]。因此,本研究旨在探讨不同TZ类型对HSIL患者术后切缘阳性的影响及原因,为临床提供参考价值。
3.2 TZ分型与HSIL患者术后切缘病理情况的关系
研究表明,HSIL是一种可以直观反映宫颈癌发展连续过程的癌前病变,需要对术后病灶残余或切缘阳性者进行及时干预与定期检查,才能有效降低病灶进一步恶变的风险[8]。本研究结果显示,不同TZ类型的HSIL患者LEEP术后切缘阳性率之间的差异显著,Ⅲ型转化区患者切缘阳性率高达20.31%,提示随着转化区萎缩程度的加深,术后病理切缘阳性率呈上升趋势。TZ是一个腺体和鳞状上皮之间的动态过渡区域,当女性体内雌激素水平过高时,往往会引起宫颈鳞柱交界部发生外移,在子宫颈局部会出现糜烂样改变,同时可能伴有同房后出血或者分泌物异常等现象[9]。Moshi等[10]探讨了TZ中SOX17和SOX2表达的动力学分布,发现TZ鳞状化生上皮内存在SOX17表达,正常鳞状上皮中出现SOX17未成熟残余物,而HPV可以在SOX2阳性的鳞状上皮内病变附近的SOX17未成熟化生区域中检测到,这表明HPV感染与 TZ之间存在一定相关性。鳞状区域是HPV感染的靶区,TZ上皮持续感染HPV后,可随着癌细胞的发展最终穿破上皮内膜累及其他组织,影响患者预后,威胁患者生命[11]。本研究多因素分析显示,HPV感染呈多型阳性、HPV16/18分型感染、CIN Ⅲ度病变、病灶累及腺体也是影响HSIL患者LEEP术后切缘阳性的独立危险因素,这与既往关于患者术后预后不良的研究结果一致[12-14]。
3.3本研究的局限性
本研究存在一定局限性。首先,纳入的样本量较少且来自单中心,可能增加了选择偏倚的风险;其次,对于我国以外的其他种族人群,尚未进行本研究成果合理性和有效性探讨,未来还需要扩大样本量进行多中心、前瞻性研究。
综上所述,HSIL患者的TZ分型与术后切缘病理情况存在一定相关性,当TZ可见完整度越高时术后切缘阳性率越低,越有利于患者预后。针对TZ分型的研究可为患者制定个体化治疗方案提供更多的理论依据。

