光合有效辐射及其传感器研究进展
孙 刚,刘 慧,李 丽,高 帅,张全军,黄文江,刘良云,柳钦火
光合有效辐射及其传感器研究进展
孙 刚1,刘 慧2,李 丽1,高 帅1,张全军3,黄文江4,刘良云4,柳钦火1※
(1. 中国科学院空天信息创新研究院,遥感科学国家重点实验室,北京 100101;2. 中国计量科学研究院,北京 100029;3. 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室,北京 100101;4. 中国科学院空天信息创新研究院数字地球重点实验室,北京 100094)
植物利用约400~700 nm波段的光驱动光合作用,但不同波长的光驱动效率不相同,而且随着植物类型及生长阶段的不同而变化。因此,准确获取被植物捕获并用于驱动光合作用的光辐射成为困扰科学家的难题。当前,光量子传感器被普遍接受并用于评价光合作用潜力,可测量400~700 nm波段的光量子通量密度或光量子通量,其光谱响应函数为直线。该文回顾了经典光合有效辐射(photosynthetically active radiation,PAR)定义的形成过程,介绍了PAR传感器的演化路径,讨论了PAR及其传感器的应用现状。由于测量对象及应用环境的多样化,PAR的定义仍然没有完全统一,且早期研究对光谱响应函数的度量不充分。随着当前人工光照明与植物生长发育相关研究的深入,发现植物光合作用吸收的光波长范围比400~700 nm要宽,不同的光谱能量分布(波长配比,能量配比)、光周期等对光合作用影响显著,并且很难将光辐射对光合作用的影响和光形态效应区分开,因此PAR的定义及其传感器的研发仍处于不断发展中。理想的PAR应该从植物光合作用的角度来定义,未来PAR传感器的光谱响应函数应与植物光合作用的能力曲线相一致,并能依据测量对象及应用需求而调整。与此相适应,未来PAR传感器应向用户可对光谱响应函数编程的方向发展。
遥感;传感器;光合作用;光合有效辐射;光子通量密度;PAR
0 引 言
地球表面几乎所有的能量都直接或者间接地来自太阳。绿色植物是一个巨型的能量转换站,植物通过光合作用将一部分太阳光能转换为化学能,并存储在所生成的有机化合物中,除了供植物本身和全部异养生物之用外,还为人类生存和发展提供能源。当光照射到植物叶片上时会发生反射、透射及吸收。叶绿素吸收光能后,一部分用于光合作用,极少部分以热辐射和荧光发射的形式释放,其中被植被吸收并用于驱动光合作用的光称为光合有效辐射(photosynthetically active radiation,PAR)[1]。PAR是重要的气候资源,影响着地表与大气之间的物质和能量循环[2],是不同陆地生态系统模型的重要参数之一。自从MONTEITH以能量和物质平衡观点为理论基础建立了光能利用率模型,进而可以利用植被所吸收的太阳辐射及其他调控因子来估算植被总初级生产力(gross primary productivity,GPP)以来,利用光能利用率模型估算 GPP 已经成为主流的遥感估算方法之一[3],全球尺度PAR的准确估算可显著提升全球生态系统碳估算的精度。具体到单株植物,照射光源的光谱组成、光辐射照度、光周期等都会对植物的光合作用和生理特性产生显著影响。因此,PAR是揭示物质与能量交换过程的基本生理变量,是植物生长发育、光合潜力、长势、产量预测、碳源汇、气候系统等研究中必不可少的关键参数之一[4-6]。
本文回顾了经典PAR定义的形成过程,介绍了PAR传感器的演化路径,讨论了当前PAR及其传感器的研究进展,并结合当前光合作用、人工光照明与植物生长发育等相关研究,提出未来PAR研究及其测量传感器的发展趋势。
1 PAR相关概念及其早期基础研究
1.1 PAR相关概念
光合有效辐射是指被植被吸收且用于驱动光合作用的太阳辐射,一般指太阳辐射中波长位于400~700 nm的部分,下文称为经典PAR。
光谱响应函数(spectral response function)是指传感器对不同波长的光的相对敏感性曲线。
吸收率光谱(absorptance spectrum)也被称为吸收率曲线,是指根据波长绘制的目标吸收光的比例曲线。
光合速率(photosynthetic rate)是植物光合作用强弱的一种表示法,通常用单位面积叶片在单位时间内同化CO2的量表示。
作用谱(action spectrum)是依据波长绘制的相对光合速率,可以根据不同波长下的氧气释放速率[7]、CO2吸收速率[8]或者净光合速率[9]来构建,是光合作用对不同波长的光辐射响应的相对权重曲线[10]。
量子产率谱(quantum yield spectrum)是指不同波长处吸收单位光量子所产生的相对光合速率[11],是对光合作用的光谱效率的另外一种度量方式。
准确评价PAR,不是测量有多少光照射到植被上,而是要准确探测照射到植被上的光中有多少是真正驱动光合作用的。历史上,不同科学家提出了不同测量方法,并且研制了大量相关测量仪器。但是,由于长期未能在波长范围、光谱响应函数、测量单位等问题上达成一致,导致PAR的测量带有很强的主观性[12]。对这个问题形成共识的前提是确定PAR传感器的光谱响应函数。理想的PAR应该是从植物光合作用的角度进行定义,因此研究者们试图探索最能有效评估植被光合作用的光谱响应曲线或通用的植物光合响应曲线。
1.2 PAR的早期基础研究
对PAR的研究依赖于相关测量仪器的创新和发展。PAR的光谱响应曲线是基于大约50年前的早期研究得出的。在当时有限技术条件下,获取光谱响应曲线的难点包括如何准确测量光强、如何获取连续的窄波段光源、如何高精度地测量叶片的光合速率等[10]。在PAR定义达成统一之前就已经开展了大量的以评价光合作用为目的的仪器研发工作。为最终研制出实用PAR传感器奠定了基础,同时也积累了测量叶片作用谱所必需的测量工具和各种试验方案。这些设备主要分为3类,第一类为测光传感器,用于探索光合作用与光辐射间的相互关系;第二类是叶片光谱测量装置,特别是叶片的吸收率光谱测量装置;第三类为光合作用能力测量装置。
1.2.1 测光传感器
20世纪,随着对光合作用认识的加深,研究者们尝试利用各种真空管配合不同滤光片评估可用于光合作用的光辐射。例如,MCKEE在1963年研制的用于生态研究的光照积分器采用了未加滤光片的硅光电池作为光探测器,但由于这种探测器对红外光高度灵敏,总是高估可用于光合作用的光辐射[13]。1966年,MCCREE通过在球体上涂覆吸热玻璃的方式改进Eppley日射强度计,进而测量可用于光合作用的光辐射,但是,该仪器体积大,在400~700 nm波长范围内的能量响应均匀,未得到大范围应用[12]。研究发现光电管尺寸和功耗都太大,不适宜应用于植被光辐射测量,小型热电堆传感器很难构建,且其光谱响应也很难定制,也不适合用于植被光合作用研究[14]。后来,硅光电二极管作为核心器件成为测量可见光的更好选择[15-16]。
1.2.2窄带光源
只有在波长连续的窄波段光源照射下才能绘制出光谱曲线。初始光源如氙灯[8-9,17]、汞灯[18]或者太阳[18]等发出的光经过分光可产生一系列的窄带光。通常采用滤光片分光或者单色仪进行分光。如1966年BJÖRKMAN等[19]以及1969年BULLEY等[8]采用的分光方案就是滤光片分光法。随着技术的进步,分光方法逐渐发展到光栅分光,即单色仪分光,如1970年,BALEGH采用氙灯配合可旋转的衍射光栅组成单色仪系统,测量时使用的光谱分辨率为12.5 nm[20]。1972年MCCREE进行经典试验时所使用的单色仪也采用光栅单色仪分光技术[17],通过汞灯校准后的波长准确率达到3 nm,波段宽度可以通过改变出光狭缝宽度调节,试验设置的光谱步长为25 nm,光斑直径为22 mm,辐照度稳定度为±5%。窄带光源的主要指标包括中心波长、半波宽、光照强度和峰值波长等。早期光源所产生的窄带光谱的半波宽并不一致,并且光强度较低。采用滤光片滤光所产生的窄带光谱的半波宽受限于可以获取的滤光片特性,因此半波宽和中心波长的变化差异较大。例如1975年INADA在进行植被作用谱测量中采用21个窄带滤光片,随着滤光片中心波长从344 nm变化到758 nm,半波宽从8.5 nm变化到21 nm[9]。相比滤光片滤光法,单色仪可以控制光栅旋转产生较为精确的窄带光谱,但是单色仪产生的窄带光谱的半波宽和光强成反比,存在能量损失较大或者照射面积较小等缺陷。总体来说,早期研究中光源的光强较低(<150 μmol/(m2·s)),半波宽变化较大(10~34 nm),中心波长的变化不均匀。因此,受限于光源技术,早期研究对于较高光强或一致波长宽度的作用谱响应探索有限[10]。
1.2.3 光合速率测量方法和仪器
依测量方法不同,光合速率可表示为氧气释放速率[7]、CO2吸收/同化速率[8]和净光合速率[9]。在早期研究中,CO2浓度的测量方法为化学法,设备复杂且庞大[18,21]。随着技术发展,基于光在红外敏感波段的吸收比例与CO2浓度成正比原理的红外差分CO2分析方法成为主流,出现了商业化测量仪器。如MCCREE[17]及INADA[9]等试验中采用的光合测量系统,设置了专门的叶片测量腔室,利用差分红外气体分析仪(Beckman 315A)对进气口和出气口的CO2含量差值进行测量。类似系统还有1966年BJÖRKMAN改造BECKMAN 215红外分析仪所实现的CO2差分测量装置,以及BALEGH等1970年使用的包括红外CO2分析仪、叶片室、气泵和流量计等部件的封闭测量系统等[20]。
1.2.4 光谱测量方法和仪器
植被吸收光子并将其用于光合作用,准确获得叶片吸收率光谱、作用谱或者光量子产率谱是PAR研究的的必备条件,具体的测量方法和相关仪器如下:
1)吸收率光谱
利用Edwards型积分球可直接测量叶片的吸收率光谱,测量装置一般由分光系统和积分球光强测量系统组成[17]。分光系统用于产生一系列窄波段光,光强测量系统通常采用辐射计[8]或者热电堆[17,20]等传感器进行测量。这种积分球可以同时采集反射和透射光,因此可直接测量叶片的吸收率光谱[22]。另外一种间接方法通常利用独立的分光光度计如SHIMADZU公司的MPS-50L分别测量叶片的透过率和反射率,最后计算叶片的吸收率光谱[9]。
2)作用谱
作用谱是光合作用对不同波长的光辐射响应的相对权重曲线,作用谱可以通过测量不同波长处的光合速率与叶片接收到的辐射照度的比值得出。
光合速率与辐照度呈矩形双曲线关系,因此不论是作用谱还是光量子产率谱都不能简单地将光合速率除以辐照度来获得[9,23]。所以,作用谱通常有2种获取方法,第一种是保持光强恒定,即将每个窄波段的光强调整为一致,然后测量其光合速率[21],这种方法为试验中的光合作用提供了同样的基线,但是不同试验所使用的不同光强度基线可能导致光谱响应曲线产生差异[10]。第二种是保持光合速率恒定,然后测量其辐照度[9,17],即记录每个窄波段达到该固定光合速率时的辐照度,该测量基于恒定光合速率下不同波长的辐照度与相对光合速率呈线性关系的假设,MCCREE等通过试验对这个假设进行了验证[17]。
3)量子产率谱
量子产率谱是根据波长绘制的叶片吸收单位摩尔光子所驱动的光合速率曲线[17],然后对每个波段进行计算。其中叶片吸收的光子与叶片的吸收率光谱有关[17]。从本质上看,量子产率谱和作用谱的不同点在于是否考虑了叶片的吸收率[24]。更多的研究采用了简化定义,在每个波段计算照射到叶片上的单位摩尔光子所驱动的光合速率[14,16,25]。MCCREE指出,光合作用是量子光化学过程,每完成一个碳分子固定和一个氧分子释放大约需要10个光量子,因此基于光子摩尔量的计量相比基于辐射通量的计量更适合描述实际光合速率[11]。
2 经典的PAR定义
从20世纪40年代起,PAR的标准定义受到了广泛重视和研究[12],表1列举了历史上常用的PAR定义。该定义的确定过程是缓慢的、渐进的。被广泛接受的经典PAR定义是1972年由MCCREE提出的,该定义确定了PAR的波长范围、光谱响应函数和计量单位[10,26]。
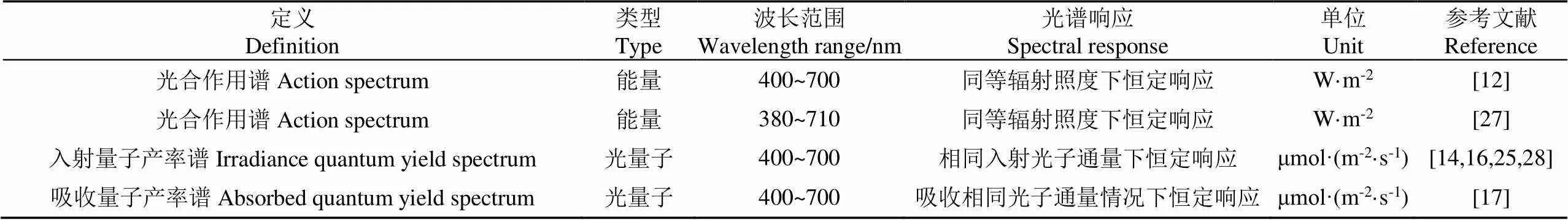
表1 历史上的PAR的定义所采用的光谱响应
2.1 波长范围
PAR定义的波长范围是随着人们对光合作用的研究的深入逐步确定的。一些从叶片对光吸收的角度对光合作用进行研究,如RABIDEAU等[29]和MOSS等[30]利用积分球装置研究了多种植被的叶片吸收光谱,发现在400~700 nm波段,叶片的吸收率为60%~90%,超过700 nm之后,叶片的吸收率急剧下降,据此推断大于700 nm的红外光可能不产生光合作用。一些从植被光合作用速率受光影响的角度对光合作用进行研究,如EMERSON等在1943年首先观察到小球藻在波长超过685 nm时光合量子产率急剧下降,即出现了红降现象,700 nm处光合量子产率较685 nm处下降50%多[31]。BJÖRKMAN在一系列针对高等植被叶片的研究中也发现了类似的现象[32]。由于光合作用光系统I的最长敏感波长为700 nm,因此该波长的光子能量被认为是激发光合作用的最小光子能量即红色限制[33]。此外,单色光下叶片水平的光合作用表明更长波长的远红光对光合作用是无效的[34]。随后,在探求上述红降问题的研究中,EMERSON等[35-36]发现,在波长大于680 nm的远红光和更短波长的光同时照射时,植被光合作用速率比两种光单独照射下光合作用速率的总和更高,这也被称为艾默生增强(emerson enhancement)效应。然而,这种多波段光的协同效应对光合效率的影响却很少受到关注[34]。MCCREE发现,在4种类型的白光中艾默生增强效应并不明显[37]。逐渐地,植被仅利用400~700 nm波段的光驱动光合作用成为共识,后续对光合反应的研究主要集中在精细获取光合作用量子产率光谱上,其中不同波长的影响通常被认为是相互独立并且符合相加性的[11,34,38]。最终以MCCREE在1972年提出MCCREE曲线为标志,正式确定了经典PAR的探测波段为400~700 nm。
PAR传感器研发是随着光合作用的研究同步开展的。1966年,FEDERER等根据叶片的吸收率曲线提出将被植被强烈吸收的400~700 nm波段作为光合传感器的测量波段[16]。1969年,NORMAN等[14]认为,根据BJÖRKMAN[32]测量的光合产率曲线,测量光合作用的传感器波段范围应为400~700 nm,与植被叶片的吸收波段保持一致。后续对PAR传感器的改进大都以此波段为标准[28]。
2.2 光谱响应函数
光谱响应函数是指传感器对不同波长光的相对敏感性。只有被叶片吸收的光才有可能被用来驱动光合作用,吸收光的比例取决于入射光的光谱和叶片的吸收特性。人们很早就发现不同波长的光对光合作用的驱动能力不同,随着试验技术的发展,对光谱响应函数的刻画也越来越精细,即从很宽的波段逐步进化为连续的窄波段[18]。在理论上,PAR传感器的光谱响应越接近植被叶片的作用谱响应,测量结果的可靠性越高。因此,在确定PAR的标准定义之前,最重要的是获知PAR光谱响应函数。当前得到广泛应用的PAR传感器的光谱响应函数是以1972年的MCCREE曲线作为基础简化而来的,其形状为400~700 nm波段对光量子通量响应平滑的直线[17]。该光谱响应函数被广泛接受并不是因为足够完美,而是因为这个光谱响应函数可以“足够准确地度量PAR”[24]。以下对历史上PAR光谱响应函数的研究进行梳理。
2.2.1 简化的吸收率光谱
基于前人对植被吸收光谱的研究结果,FEDERER等[16]发现典型叶片在400~500 nm波段的光谱吸收率大约为85%;500~600 nm大约为70%;600~700 nm大约为85%;大于700 nm后,光谱吸收率急剧降低。不同物种的吸收光谱大致相似,但由于叶片形态、个体叶片历史(胁迫、营养等)和其他因素(遗传等)的差异,吸收光谱的细节有所不同。以此为基础,FEDERER等[16]提出了一种简化的吸收率光谱,即假设植被在400~700 nm波段吸收率一致。此外,当时光合作用的量子理论指出,激发光合作用的光子能量必须大于一个阈值,超过该阈值之后,虽然不同波长的光子能量不同,但却可以激发相同数量的光合作用。据此,FEDERER提出一种假说,在400~700 nm波段,所有的光子都产生相同的光合作用。测量PAR就变成了测量入射的400~700 nm波段范围内所有的光子通量。这个测量值与植被吸收光的特性完全无关,是入射光本身的属性,因此,简化的吸收率光谱逐渐淡出后续光谱响应函数的研究。
2.2.2 作用谱和量子产率谱
随着试验技术手段的进步,逐步采用CO2差分技术取代化学法进行光合速率测量。当评估光合作用对光的响应时,光合速率可以根据入射的光强进行归一化,其中,光强的单位可以是单位波长处的入射光辐照度或者是吸收的光量子通量,两种度量方式分别对应光合作用的作用谱和量子产率谱[17]。
若以入射光辐照度为测量单位,PAR表示400~700 nm波段范围内所有的光辐射,可利用对所有波长响应一致的热电堆探测器测量[12],测量结果与植被吸收光的特性完全无关,是入射光本身的一个属性。若以吸收的光量子通量为单位,则PAR就与植被真正吸收的光量子有关,包含了叶片本身的吸收率特性。
早在1937年,HOOVER测量了440~650 nm的连续窄波段作用谱[18]。1968年,BJÖRKMAN用CO2的吸收率度量光合作用的速率[32],测量并计算了3种叶片光合作用量子产率随波长变化的曲线,结果非常相似,从450 nm到650 nm的量子产率是相对恒定的。尽管BJÖRKMAN等所开展的试验只覆盖了450~690 nm波段,但是所给出的光量子产率曲线的因变量是叶片在不同波段所吸收的光子通量,因此是“从叶片的角度”对光合作用的一种度量。1969年,BULLEY进行了不同CO2浓度下的叶片作用谱测量[8]。1970年,BALEGH测量了豆类作物的作用谱[20]。
在研制光合作用传感器的过程中,NORMAN等也根据BJÖRKMAN的光合量子产率曲线设计了400~700 nm波段光谱响应平坦的光谱响应函数曲线[14]。
2.2.3 光谱响应函数比较及经典PAR光谱响应函数确定
1972年,MCCREE[17]开展了一系列具有决定性的试验,测量并比较了几种光谱响应函数,最终确定了被广泛接受的PAR光谱响应函数。MCCREE共测量了22种不同环境下生长的植被叶片吸收率曲线、作用谱和量子产率谱。这3条谱线也被称为MCCREE曲线。量子产率谱形状大致相似,但在生物反应方面定义PAR是不切实际的[11,17]。在400~700 nm 波段,用光量子通量密度响应平坦的探测器比光谱辐射照度响应平坦的探测器评价植物光合有效辐射的准确度提高2/3。因此, 400~700 nm波段光量子通量密度(photosynthetic photon flux density,PPFD)响应一致的曲线是理想的PAR光谱响应函数[11]。利用这种定义,可以比较客观地比较各种植物在不同生长条件和光源条件下的光合作用速率、量子产率和光利用效率。以此为标志,经典PAR传感器的光谱响应函数确定为400~700 nm波段的一条平坦直线,即假定在此波段范围内光合作用对单位摩尔光子的响应保持恒定。
光量子的辐射能量与波长有关,波长越短,每个光量子具有的辐射能量越大[39]。如果用光量子单位来表示光谱响应曲线,则光谱响应曲线为水平线,如果用能量单位来表示则为斜线。此外,根据斯塔克-爱因斯坦定率(Stark-Einstein law),在400~700 nm波段,单个光子的能量随波长的不同而变化,但是每个被吸收的光子都将激发一个电子。这个定律也促使人们接受不同波长的光子具有相同的光合响应这个观点。与此同时,这也成为应用最为广泛的PAR测量方法[40]。
如果植被光合作用有效光谱的波长处于400~700 nm之间,并且不同波长的量子产率是固定的,那么光量子通量将是一个完美的度量方式。但是,正如MCCREE曲线展示的,不同波段光合作用能力不同,比如在蓝色波段叶片的吸收率达到90%以上,但是其中约20%的光子是以热量或者荧光的方式损失,并未驱动光合作用。因此,一些研究认为应该用类似MCCREE曲线的光量子产率曲线作为光谱响应函数[40]。
2.2.4 MCCREE曲线
虽然MCCREE测量了植被的作用谱和光量子产率谱,但是并未明确提出将其作为PAR光谱响应函数。大量研究表明,不同波长的光子所激发的光合作用数量不同[17,9,11],而广泛应用的PAR传感器都采用响应一致的光谱响应曲线。因此,更准确地测量PAR需要采用光量子产率曲线作为光谱响应函数,测量值是光合产率光子通量YPF(yield photon flux)[24,41]。SAGER等[24]比较了两种采用不同光谱响应函数的PAR传感器,他发现具有宽光谱输出的光源可以用光子通量密度或光合光子通量密度来评估,而对具有窄光谱发射的不均匀源,光子通量密度不是度量光合利用效率的有效指标,且PPF和YPF计算结果差异较大,因此认为采用MCCREE曲线为光谱响应函数的YPF要优于采用恒定响应的光谱响应函数的PPF。
MCCREE曲线是植物光辐射研究领域最重要的曲线之一,对人工光源光谱技术的发展起到了重要作用。需要特别注意的是,MCCREE曲线并不是植物对光辐射的需求指标,也不是理想植物生长灯需要模拟达到的光谱形态标准。
从最早得到公认的光量子产率曲线[17],到1976年INADA发布的33种高等植物叶片的光谱响应曲线[9],再到最新发布的光谱响应函数(德国工业标准 DIN5031-10-2013),光谱响应函数的研究一直跟探索光合作用机理的研究结合在一起。这些光谱响应函数曲线并不完全相同,是不同科学家研究得出的具有一定代表性的平均值曲线[42]。
2.3 度量单位
目前PAR存在2种量度系统,一种以辐射通量密度(W/m2)来度量,是当前卫星遥感辐射产品广泛应用的度量单位[5],主要应用于辐射、气象与气候等方面的研究;另一种以光量子通量密度(μmol/(m2·s))来度量,通过光量子传感器直接测量获得,主要应用于植物生理生态、农林等方面的研究[43]。在获取入射光谱辐照度光谱曲线的情况下,2种单位可以相互转化[44]。对于太阳光来说,在能量型和量子型2种度量系统之间的量子转换系数为4.57 μmol/J[6,45],该转换系数受多种天空因素影响,但主要影响因素是云量、云状和日光状况[46-47],一直是研究热点之一[48,2]。
3 经典PAR传感器的研制
经典PAR传感器的研制是采取包括带通滤光、透过率修正等技术手段对光电探测器原始光谱响应函数进行修正,使传感器的光谱响应函数接近于理想PAR光谱响应函数的过程。
3.1 方案探索阶段(1960年-1966年)
20世纪60年代初,TANNER为了探索植被与环境间的关系,率先研究了有关植被光合作用辐射的植被冠层叶片辐射吸收及其测量问题[16,49-50]。FEDERER发现尽管当时已经有一系列的传感器用于植被光合作用测量,但是人们对入射光的光谱分布与植物和传感器的光谱响应的相互关系关注甚少。于是FEDERER首先研制了一种用来测量林下光谱分布的分光光度计,该设备采用楔型干涉滤光片实现分光,探测器为硅光电池[15]。由于植被强烈吸收400~700 nm波段的光,因此假设植被在该波段范围内不同波长的光子对光合作用的驱动能力相同。于是,测量400~700 nm波段的光量子通量密度就是评估光合有效辐射的最佳方法。1966年,FEDERER测试了7种传感器与滤光片的组合在不同光源环境下的测量误差,发现当光源的光谱分布发生变化时,传感器光谱响应与光量子响应的偏差会导致测量误差,安装滤光片的硒光电池系统误差最小且结构简单[16]。受限于当时的技术条件,FEDERER等[16]并未研制出实用性的PAR传感器,但为后续PAR测量设备开发提供了思路。需要指出的是,TANNER[49]对传感器的光谱响应函数进行了大胆假设,即在400~700 nm波段对光量子响应一致,这与后来被广为接受的PAR传感器光谱响应函数一致。
3.2 重要进展阶段(1966年-1968年)
1967年,NORMAN等开展了植物冠层的光分布与冠层结构关系的研究,第一次尝试开发基于硅电池的PAR传感器[51]。由于BJÖRKMAN等已经证明了基于吸收率的光谱响应函数是相对一致的[32],因此,一种通用的PAR测量采用的光谱响应函数应基于植被的吸收光,即在400~700 nm波段范围内具有大概一致的光量子响应曲线,并且对大于700 nm的红外波段无响应。但在当时技术条件下,设计能够截止大于700 nm波段光的传感器的难度极大。1969年,NORMAN等[14]指出PAR传感器研制的几个重要原则:1)测量波段范围为400~700 nm;2)在上述波段范围内,传感器的光量子响应曲线为平滑直线;3)动态响应范围大,不易疲劳,且线性良好;4)响应速度快,适用于快速测量。
为实现设计目标,需要解决3个问题:第一,选择合适的光敏探测器,满足波段响应范围及响应速度要求;第二,滤除400~700 nm波段以外的光响应;第三,实现良好的余弦校正。对于第一个问题,NORMAN等[14]选择硅光电池为探测器,相比当时广泛应用的硒光电池,硅光电池具有体积小、动态范围宽、不易疲劳、响应速度快等优点。事实上,后续商业应用的PAR传感器所采用的光敏探测器件都是硅光电池。第二个问题相对较难,特别是硅探测器在近红外波段有最强的光谱响应,而且植被冠层中近红外波段的反射非常强烈,因此对大于700 nm波段的光实现根本的光谱修剪尤其困难。在当时,实现400~700 nm宽波段的带通滤光片非常昂贵,并且这种滤光片在红外波段的透过率偏高。NORMAN等[14]采用2个特殊配对的硅光电池,其中一个硅光电池可以探测全部光线,另外一个硅光电池上方安装一个滤光片,仅探测大于700 nm波段的红外光。2个硅光电池的输出信号相减即可滤掉大于700 nm红外光产生的信号。配合吸附过滤滤光片和吸热玻璃,实现了对小于400 nm光的光谱修剪。对于第三个问题,一方面不断改进外壳结构设计,另一方面,在滤光部件上方添加具有极低前向散射特性的漫散射体,两者配合实现了较好的余弦响应[14]。
NORMAN等[14]设计的PAR传感器在430~675 nm波段的光子响应误差小于12%,传感器之间的一致性较好。
3.3 改进与提高阶段(1968年-1971年)
1967年BIGGS等[28]针对NORMAN研制的PAR传感器进行改进[51]。BIGGS等认为NORMAN的传感器主要有2个缺陷:其一,为了滤除红外光,需要采用2个性能完全相同的硅光电池探测器,但是匹配和调整这2个探测器十分复杂,不利于量产;其二,在某些光环境下,传感器的余弦响应误差较大。于是,BIGGS对滤光系统进行改进,采用定制的400~700 nm带通滤光片实现光谱匹配。对波长小于400 nm的光线,利用漫散射体本身吸收紫外线的特点进行滤除,对于波长大于1 000 nm的红外线,利用一个1.5 mm厚的滤光片进行吸收滤除,其光谱响应函数更接近理想的光谱响应函数。1971年该传感器量产上市。
3.4 商业化产品持续改进阶段(1971年至今)
科学研究及农业生产的发展催生了大量的PAR传感器需求,一批提供PAR传感器的公司应运而生,表2列出了当前国际上广泛应用的部分PAR传感器及其参数。从表2中可以看出,不同型号的PAR传感器在探测波长和光谱响应函数方面并不总是严格一致,比如:APOGEE公司的SQ-110在光谱响应曲线和成本方面做了妥协;APOGEE公司的SQ-610-SS传感器在红外波段有更多的响应,因为研究发现红外波段能促进植被整体的光合作用[34]。值得指出是, SKP 210传感器的光谱响应函数接近MCCREE[17]在1972年所测量的植被光合作用响应曲线,因此在原理上更能反应植被真实的光合作用[40]。
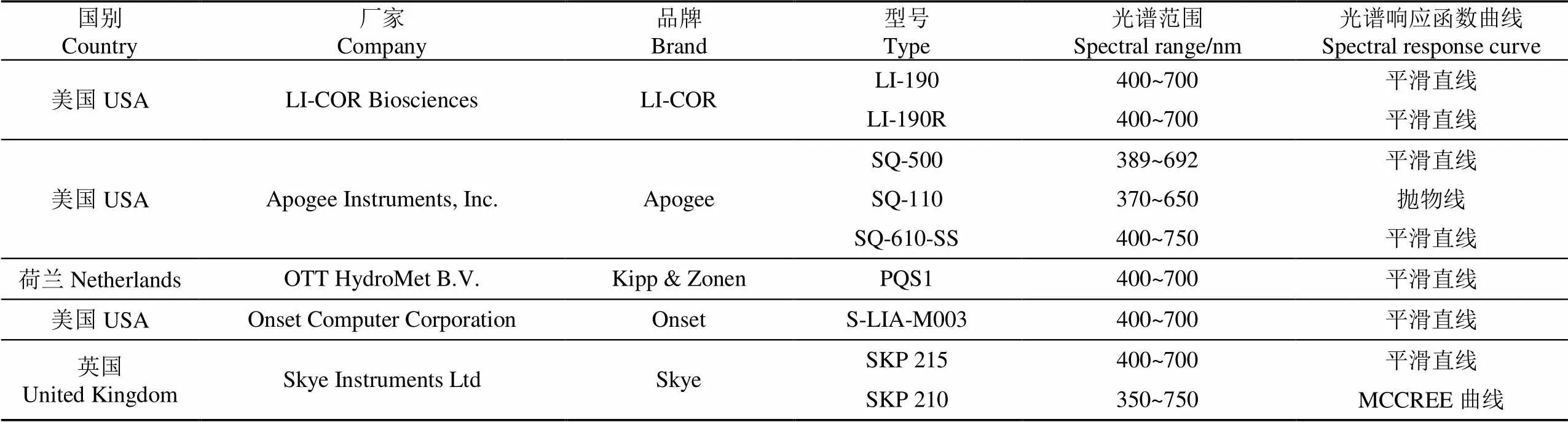
表2 PAR传感器及其参数
针对冠层下非均匀光场环境,不同厂家推出了采用单检测器(如LI-191R)或多检测器(如SunScan)的线性PAR传感器,用于测量、计算和分析植物冠层截获和穿透的光合有效辐射及叶面积指数。针对水下测量要求,出现了一系列能实现半球(如LI-192)或球形(如LI-193)观测的商业化水下专用PAR传感器。
为了追求更高的测量精度,各厂家对PAR传感器进行持续改进。以LI-COR公司最新的LI-190R型PAR传感器为例,改进主要体现在2个方面:第一,更优化的滤光设计,将整个400~700 nm波段的光谱响应函数调整的更为平坦。第二,更优异的余弦响应,传感器可在入射角高达82°的情况下产生适当的余弦响应。这种改进可以提高传感器在诸如日落或日出等弱光环境下测量的准确性。
4 PAR及其传感器的研究进展
4.1 PAR数据产品
PAR数据产品,特别是长期连续观测PAR数据产品可为生态系统中碳、氮循环研究、气候预测研究中辐射过程以及环境外交等相关领域提供数据支撑。目前PAR数据产品主要分为2类[2,5]:一是针对不同卫星传感器生产的遥感辐射产品,以辐射通量密度为单位(W/m2);二是地面站点直接观测的产品,以光量子通量密度度量,单位为μmol/(m2·s)。
国内外已经建设了一批PAR的地基观测网络并生产了相应的数据产品,如表3所示。中国生态系统研究网络(Chinese ecosystem research network,CERN)是监测中国生态环境变化、综合研究中国资源和生态环境重大问题的全国性网络[52]。该网络的气象辐射观测系统是国内第一个国家尺度的PAR地基观测网[53],由分布在国内 8种典型生态类型的40个野外观测站组成[5]。美国国家海洋气象局1993年建立了覆盖全美的辐射观测网络(surface radiation budget network,SURFRAD),该网络包括7个站点,可提供长期的覆盖地表的太阳辐射观测资料。美国国家生态观测网(National ecological observatory network,NEON)由美国国家科学基金会于2000年提出并建立,目前可提供79个站点的PAR观测数据,包括直射、散射和反射的PAR数据[54]。全球通量观测网络(FLUXNET)是全球范围的微气象塔观测网络,由一系列的区域网络组成,可提供1991年至今212个观测站的PAR数据集[55]。由于该网络包含多个国家和区域网络,各网络中采用的传感器并不相同,FLUXNET 没有对PAR观测手段及其精度评定制定统一标准。比如,日本通量观测网(JAPANFLUX)作为一个区域网络加入FLUXNET,该网络包括39个台站,各个站点使用的PAR的传感器并不相同,主要包括PAR01、ML-020P、LI-190S等,生产厂家或品牌分别为Prede、EKO和LI-COR等。地面观测网络所获得的真实数据可应用于辐射特性分析和长期变化趋势分析[56-57]。另外,实测数据作为PAR遥感估算产品的验证数据,关系到 PAR产品应用于生态系统研究的数据精度问题。
4.2 遥感估算PAR
过去几十年,遥感技术极大地促进了从宏观尺度上理解和认识地球生物圈及碳循环的能力。对GPP估算精度的追求也在不断促进PAR遥感反演的发展。从卫星遥感数据中反演高精度和时空连续的PAR可以填补地面测量的不足[58]。PAR的遥感估算,除了传统的统计方法[59],更多采用基于物理模型的方法[60-61],即首先通过反演晴空下影响PAR的大气可降水量、气溶胶等参数,再根据辐射传输方程从大气顶层PAR反演高分辨率陆表PAR[62]。但是,当前基于遥感数据的PAR估算采用的是能量单位,与基于植被生理定义的PAR并不相符。因此,对PAR的遥感反演订正有巨大潜力,进而提高LUE模型精度及GPP的反演精度。
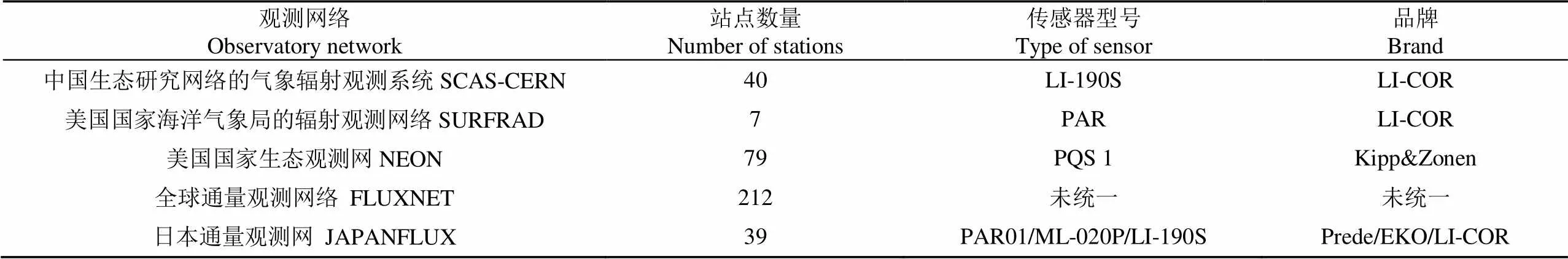
表3 PAR地面观测网络及传感器
以辐射估算为主的PAR估算,仅表征了植被“潜在光合作用”,而不能直接量化“实际光合作用”。而植被叶绿素荧光作为光合作用的探针,在光合作用探测上具有优势,是一种“实际光合作用”的直接探测方法[63-64]。其中,日光诱导叶绿素荧光(solar induced fluorescence, SIF)遥感是近年快速发展起来的新型遥感技术,在植被监测和碳循环应用等方面发展迅速[65]。现有研究也表明,PAR与叶绿素荧光具有较高的相关度[66-67],是影响SIF和GPP关系的关键因素[68]。因此,SIF可能在区域和全球尺度为PAR的准确评估提供有益的辅助信息,但是其相关关系受制于环境、冠层结构、植物功能型等,估算结果还存在很大的不确定性[69-70]。
4.3 PAR传感器的研究进展
随着PAR传感器的广泛应用,不少学者研制了低成本的PAR传感器[71-72],或尝试了其他探测器[73-74],或提供更多的传感器接口[75],或与微处理器[76]、数采[77-78]等集成为小型测量仪[79]。还有一些研究关注PAR传感器的灵敏度校准和量值溯源流程[80-82]。PAR传感器测量的光量子通量密度,实际上是辐射能量传感器测量后经公式计算得出[39],通常采用标准PAR表比对法或光谱辐射计方法[83]进行校准。其中,光谱辐射计法是利用符合计量标准的辐照度标准灯和光谱辐射计,对每个窄波段积分进而获得整体灵敏度系数[82]。仪器的余弦响应、非线性、温度依赖性及稳定性等决定了PAR传感器的数据质量,水下[84]或陆上[41,77,83]不同传感器的性能对比以及长期观测中的性能衰变和数据校正[85]也受到了重视。光质比例(红光/蓝光或者红光/红外光)对植物生长发育有重要影响[86],而经典PAR传感器不能区分光质,无法满足光生物学研究和植物工厂生产的实际需要[87]。于是,一些研究通过模拟植物窄带光谱响应同时测量红、蓝光的光量子通量密度[88]和全谱段的PAR[87-88],开发可同时测量光质的PAR传感器[89]。系统集成方面,无线通讯技术[90]及无线传感器网络技术[88]也应用于PAR传感器,用于构建远程或者大范围的PAR数据采集系统。
LED补光技术在作物栽培方面取得了长足的进步[91],但是,LED 作为替代光源所面临的最大挑战之一是光源组合方式的多样性,这常常使研究结果难以比较[92]。小型光谱仪(如SS-110)或光合作用光谱仪(如LI-180)可以在较宽的波段范围内(至少包含400~700 nm波段)以nm级分辨率测量光量子通量密度,为测量或者优化补光光质提出了新的解决方案[34]。
5 存在的问题
5.1 MCCREE曲线的局限性
当前得到广泛应用的PAR传感器的光谱响应函数是以MCCREE光量子产率曲线为基础进行简化的平滑直线。而重新审视MCCREE曲线可以发现,当时的试验存在一些局限。首先,MCCREE观察到单色红外光的光合作用量子产率极低[9,17,34],因此,认为700 nm以上的光量子不能驱动光合作用或者作用极其微弱。受限于当时的照明技术条件,MCCREE利用光栅和滤光片实现了单色光的输出,试验测量的光合量子产率是在离散单色光的条件下取得的,且假设离散单色光对光合作用的影响是独立和可叠加的。最近的研究重新审视了艾默生增强效应,并证明了近红光和较短波长之间的协同作用对叶片光合作用影响巨大[26],相同光量子通量情况下,不同波长的组合也会提高光合作用[93]。其次,获取MCCREE曲线的光量子通量低,是叶片在“光饥渴”状态下获取的曲线。根据波段的不同,MCCREE试验中PAR的量值通常小于150 μmol/(m2·s),远小于植物生长的最佳PAR值,更高的辐照度水平下,辐照度与光合作用量子产率之间的关系是否保持不变尚不清楚[10]。最后,MCCREE的原始试验仅使用一个叶片评估每个波长的CO2吸收率(光合作用速率),叶片与冠层尺度的光合作用响应是否一致对大多数植被来说仍然未知。当前的一些研究中引入了气体交换室,在冠层和植株水平上,以更长的曝光时间获取更全面的测量[94]。WU等[10]对早期PAR的测量进行了综述,分析了波段宽度、光源强度等因素对PAR光谱响应函数测量精度的影响,指出早期研究中试图在光度或辐射单位下量化光合作用的光谱响应的尝试是不够的,虽然一些研究将光量子效应与光合作用的光谱响应联系起来,但都是在极低光照水平下进行的,具有较大局限性。不同的半波宽度、中心波长和测量方法都会影响曲线形状,并可能由此产生对采集到的光谱数据的错误解读。
5.2 新的研究挑战经典PAR的定义及其测量
越来越多的研究表明,在宽光谱或组合光下,植物可以更有效地利用近红光进行光合作用[26,34,95]。这些研究表明在宽谱光下,远红光光子可能对光合作用有重要贡献。特别地,太阳光含有19%近红外光(701~750 nm),而当前PAR的定义中排除了近红外光子,很可能低估了能够驱动光合作用的真实光子通量密度。ZHEN等研究了近红外光对14种不同作物单叶和冠层光合作用的影响,发现在波长较短的光子背景中加入近红光子(最高达40%)可以增强冠层光合作用,相当于增加了400~700 nm波段的光子。并且,仅仅增加近红外光就可以增强光合作用[34]。当近红外光与传统定义的光合有效光量子协同作用时,近红外光在驱动冠层光合作用方面同样有效。不同物种间的一致反应表明这种机制在高等植物中是普遍存在的。这表明,近红外波段(701~750 nm)的光量子应该纳入PAR的定义和测量中[34]。此外,有些研究发现某些在阴暗环境下生存的蓝藻可以利用750 nm红外光驱动光合作用,从而撼动了普遍接受的光合作用及复杂生命存在小于700 nm的“红光限制”的观点[33]。综上所述,PAR定义中的波长范围有可能需要扩展到350~750 nm或更宽范围,正如ZHEN等建议用扩展波长的ePAR(extended range PAR)来代替经典PAR[94]。
传统上,植被只能被动地适应太阳光的照射,而现代农业则可通过人工补充照明实现光照射条件按需调节,营造适宜植物生长的光辐射环境。要实现光辐射环境的调控就必须准确测量照明光源的PAR。对PAR的评价又需从植物的光谱响应函数出发,这就同时涉及植物生理学和辐射度学等领域,形成新的交叉学科—植物光度学。目前这一领域存在的主要问题是PAR的评价方法、定标标准不完善;不同厂家仪器的测量结果相差较大;光合作用等植物生理特性与光辐射关系的基础研究不足等[42,96-98]。
6 结论与展望
PAR的定义包含了波段范围、光谱响应函数和度量单位3个关键指标。除了参与光合作用,光辐射对植物的生长发育、形态构建和生理代谢等都有调控作用,即光形态建成。照射在叶片上不同波长的光对植物的生理影响不同,不同波段的光参与光合作用的权重也不同,并且随植物种类及生长阶段的不同而变化。从最早得到公认的MCCREE在1972年提出的植物光谱响应函数到最新发布的德国工业标准,光谱响应函数是具有一定代表性的平均值曲线,会随着研究的不断深入而改进。
当前经典的PAR传感器测量的是400~700 nm波段的光量子通量密度,只是一种评价PAR的近似方法,用于评估测量环境下的光合作用潜力,评价结果存在系统偏差。在农林气象及生态学应用中,PAR只是测量的众多参数之一,并且PAR具有较大的时空变异性。因此,虽然当前经典光量子传感器仍然具有广泛的应用价值,但它并不能对光合有效辐射进行准确的度量,而只是提供了误差较小的比较基准。
光合作用是植物个体最重要的生理活动之一,光合有效辐射测量的是可供植物个体或者植物生态系统利用的光合作用潜力,因此,PAR是联系生理学与生态学的桥梁之一。
最近的研究试图用LED照明技术和滤光片重现MCCREE曲线,但是在波长选择和实现更高的光强度方面仍存在挑战。未来应考虑光特性以及光形态的相互影响。随着植物工厂的发展,在植物PAR的实时测量、人工植物照明光源研发、植物光生理特性研究等方面都对植物PAR计量设备提出了新要求。未来随着光谱辐射计技术的发展及人们对植物光生物机理认识的加深,可实现对辐射计光谱响应函数的快速调整来模拟植物光合作用的光谱响应,在一些应用中新型光谱辐射计可替代当前经典PAR传感器。未来PAR传感器也有可能实现光谱响应函数编程,从而适合相应植被的PAR测量。借助遥感技术,可实现区域和全球尺度的PAR估算,随着遥感估算精度的不断提高,大尺度PAR产品将显著促进全球碳循环及全球环境变化的遥感研究。
[1] STIRBET A, LAZÁR D, GUO Y, et al. Photosynthesis: Basics, history and modelling[J]. Annals of Botany, 2020, 126(4): 511-537.
[2] 董泰锋,蒙继华,吴炳方,等. 光合有效辐射(PAR)估算的研究进展[J]. 地理科学进展,2011,30(9):1125-1134.
DONG Taifeng, MENG Jihua, WU Bingfang, et al. Overview on the estimation of photosynthetically active radiation[J]. Progress in Geography, 2011, 30(9): 1125-1134. (in Chinese with English abstract)
[3] 孙睿,朱启疆. 陆地植被净第一性生产力的研究[J]. 应用生态学报,1999,10(6):757-760.
SUN Rui, ZHU Qijiang. Net primary productivity of terrestrial vegetation—A review on related researches[J]. Chinese Journal of Applied Ecology, 1999, 10(6): 757-760. (in Chinese with English abstract)
[4] 任小丽,何洪林,张黎,等. 1981-2010年中国散射光合有效辐射的估算及时空特征分析[J]. 地理学报,2014,69(3):323-333.
REN Xiaoli, HE Honglin, ZHANG Li, et al. Assessment of the spatiotemporal variations of diffuse photosynthetic active radiation in China from 1981 to 2010[J]. Journal of Geographical Sciences, 2014, 69(3): 323-333. (in Chinese with English abstract)
[5] 刘慧,唐利琴,胡波,等. 2005-2015年CERN光合有效辐射数据集[J]. 中国科学数据,2017,2(1):1-10.
LIU Hui, TANG Liqin, HU Bo, et al. Photosynthetically active radiation dataset in Chinese Ecosystem Research Network (2005–2015)[J]. China Scientific Data, 2017, 2(1): 1-10. (in Chinese with English abstract)
[6] 朱旭东,何洪林,刘敏,等. 近50 年中国光合有效辐射的时空变化特征[J]. 地理学报,2010,65(3):270-280.
ZHU Xudong, HE Honglin, LIU Min, et al. Spatio-temporal variation characteristics of photosynthetically active radiation in China in recent 50 yeas[J].Journal of Geographical Sciences, 2010, 65(3): 270-280. (in Chinese with English abstract)
[7] EVANS J R, ANDERSON J M. Absolute absorption and relative fluorescence excitation spectra of the five major chlorophyll-protein complexes from spinach thylakoid membranes[J]. Biochimica et Biophysica Acta (BBA)- Bioenergetics, 1987, 892(1): 75-82.
[8] BULLEY N R, NELSON C D, TREGUNNA E B. Photosynthesis: Action spectra for leaves in normal and low oxygen[J]. Plant Physiology, 1969, 44(5): 678-684.
[9] INADA K. Action spectra for photosynthesis in higher plants[J]. Plant and Cell Physiology, 1976, 17(2): 355-365.
[10] WU B S, RUFYIKIRI A S, ORSAT V, et al. Re-interpreting the photosynthetically action radiation (PAR) curve in plants[J]. Plant Science, 2019, 289: 110272.
[11] MCCREE K J. Test of current definitions of photosynthetic ally active radiation against leaf photosynthesis data[J]. Agricultural Meteorology, 1972, 10: 443-453.
[12] MCCREE K J. A solarimeter for measuring photosynthetic ally active radiation[J]. Agricultural Meteorology, 1966, 3(5): 353-366.
[13] MCKEE G B. A self-powered light integrator for ecological research1[J]. Agronomy Journal, 1963, 55(6): 580-583.
[14] NORMAN J M, TANNER C B, THURTELL G W. Photosynthetic light sensor for measurements in plant canopies[J]. Agronomy Journal, 1969, 61: 840-843.
[15] FEDERER C A, TANNER C B. Spectral distribution of light in the forest[J]. Ecology, 1966, 47(4): 555-560.
[16] FEDERER C A, TANNER C B. Sensors for measuring light available for photosynthesis[J]. Ecology, 1966, 47(4): 654-657.
[17] MCCREE K J. The action spectrum, absorptance and quantum yield of photosynthesis in crop plants[J]. Agricultural Meteorology, 1972, 9: 191-216.
[18] HOOVER W H. The dependence of carbon dioxide assimilation in a higher plant on wave length of radiation[J]. Smithsonian Miscellaneous Collections,1937, 95(21): 1-13.
[19] BJÖRKMAN O. The effect of oxygen concentration on photosynthesis in higher plants[J]. Physiologia Plantarum, 1966, 19(3): 618-633.
[20] BALEGH S E, BIDDULPH O. The photosynthetic action spectrum of the bean plant[J]. Plant Physiology, 1970, 46(1): 1-5.
[21] HOOVER W H. Carbon dioxide assimilation in a higher plant[J]. Smithsonian Miscellaneous Collections, 1933, 87(16): 1-19.
[22] EDWARDS D K, GIER J T, NELSON K E, et al. Integrating sphere for imperfectly diffuse samples[J]. Journal of the Optical Society of America, 1961, 51(11): 1279-1288.
[23] MOSS D N. Optimum lighting of leaves[J]. Crop Science, 1964, 4: 131-136
[24] SAGER J C, EDWARDS J L, KLEIN W H. Light energy utilization efficiency for photosynthesis[J]. Transactions of the ASAE, 1982, 25(6): 1737-1746.
[25] MCPHERSON H G. Photocell-filter combinations for measuring photosynthetically active radiation[J]. Agricultural Meteorology, 1969, 6(5): 347-356.
[26] ZHEN S, IERSEL M W van. Far-red light is needed for efficient photochemistry and photosynthesis[J]. Journal of Plant Physiology, 2017, 209: 115-122.
[27] MCCREE K J. Physiological plant ecology I: Responses to the physical environment[M]. Berlin, Heidelberg: Springer, 1981.
[28] BIGGS W W, EDISON A R, EASTIN J D, et al. Photosynthesis light sensor and meter[J]. Ecology, 1971, 52(1): 125-131.
[29] RABIDEAU G S, FRENCH C S, HOLT A S. The absorption and reflection spectra of leaves, chloroplast suspensions, and chloroplast fragments as measured in an ulbricht sphere[J]. American Journal of Botany, 1946, 33(10): 769-777.
[30] MOSS R A, LOOMIS W E. Absorption spectra of leaves. I. the visible spectrum[J]. Plant Physiology, 1952, 27(2): 370-391.
[31] EMERSON R, LEWIS C M. The dependence of the quantum yield of chlorella photosynthesis on wave length of light[J]. American Journal of Botany, 1943, 30(3): 165-178.
[32] BJÖRKMAN O. Further studies on differentiation of photosynthetic properties in sun and shade ecotypes of solidago virgaurea[J]. Physiologia Plantarum, 1968, 21(1): 84-99.
[33] NÜRNBERG D J, MORTON J, SANTABARBARA S, et al. Photochemistry beyond the red limit in chlorophyll f-containing photosystems[J]. Science, 2018, 360(6394): 1210-1213.
[34] ZHEN S, BUGBEE B. Far-red photons have equivalent efficiency to traditional photosynthetic photons: Implications for redefining photosynthetically active radiation[J]. Plant, Cell & Environment, 2020, 43(5): 1259-1272.
[35] EMERSON R, CHALMERS R, CEDERSTRAND C. Some factors influencing the long-wave limit of photosynthesis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1957, 43(1): 133-143.
[36] EMERSON R, RABINOWITCH E. Red drop and role of auxiliary pigments in photosynthesis[J]. Plant physiology, 1960, 35(4): 477-485.
[37] MCCREE K J. Significance of enhancement for calculations based on the action spectrum for photosynthesis[J]. Plant Physiology, 1972, 49(5): 704-706.
[38] EVANS J. The dependence of quantum yield on wavelength and growth irradiance[J]. Functional Plant Biology, 1987, 14(1): 69-79.
[39] 王炳忠,胡波,刘广仁. 光合光量子传感器校准的一些问题[J]. 太阳能学报,2008,29(1):1-5.
WANG Bingzhong, HU Bo, LIU Guangren. Questions for calibration of quantum sensor for photosynthetically active radiation[J]. Acta Energiae Solaris Sinica, 2008, 29(1): 1-5. (in Chinese with English abstract)
[40] BARNES C, TIBBITTS T, SAGER J, et al. Accuracy of quantum sensors measuring yield photon flux and photosynthetic photon flux[J]. HortScience, 1993, 28(12): 1197-1200.
[41] BARNES C, BUGBEE B. Morphological responses of wheat to blue light[J]. Journal of plant physiology, 1992, 139(3): 339-342.
[42] 刘慧,赵伟强,刘建,等. 植物光合有效光辐射测量技术的现状及需求[J]. 中国照明电器,2015(8):35-39.
LIU Hui, ZHAO Weiqiang, LIU Jian et al. The current situation and demanding of plant photosynthetically effective radiation measurement technology[J]. China Light & Lighting, 2015(8): 35-39. (in Chinese with English abstract)
[43] 中华人民共和国国家质量监督检验检疫总局. 光合有效辐射表:GB/T 35139-2017[S]. 北京:中国标准出版社,2017.
[44] 聂修和,聂宜茂,聂俊华,等. 光合有效辐射测量原理及其单位换算[J]. 山东农业大学学报,1992,23(3):48-54,59.
NIE Xiuhe, NIE Yimao, NIE Junhua, et al. The principle for measuring available photosynthetic radiation and related conversion of units[J]. Journal of Shandong Agricultural University, 1992, 23(3): 48-54, 59. (in Chinese with English abstract)
[45] DYE D G. Spectral composition and quanta-to-energy ratio of diffuse photosynthetically active radiation under diverse cloud conditions[J]. Journal of Geophysical Research: Atmospheres, 2004, 109:D10203.
[46] GARCÍA-RODRÍGUEZ A, GARCÍA-RODRÍGUEZ S, DÍEZ-MEDIAVILLA M, et al. Photosynthetic active radiation, solar irradiance and the CIE standard sky classification[J]. Applied Sciences, 2020, 10(22): 8007.
[47] ALADOS I, FOYO-MORENO I, ALADOS-ARBOLEDAS L. Photosynthetically active radiation: Measurements and modelling[J]. Agricultural and Forest Meteorology, 1996, 78(1): 121-131.
[48] 王炳忠,税亚欣. 关于光合有效辐射的气候学计算问题[J]. 太阳能学报,1988,9(1):61-67.
WANG Bingzhong, SHUI Yaxin. Study on the calculation of the photosynthetically active radiation[J]. Acta Energiae Solaris Sinica, 1988, 9(1): 61-67. (in Chinese with English abstract)
[49] TANNER C B, LEMON E R. Radiant energy utilized in evapotranspiration1[J]. Agronomy Journal, 1962, 54(3): 207-212.
[50] FUCHS M, TANNER C B. Infrared thermometry of vegetation1[J]. Agronomy Journal, 1966, 58(6): 597-601.
[51] WELLES J M, ANDERSON M C. Historical overview of John M. Norman’s involvement in the development of several key instruments for biophysical measurement[J]. Agricultural and Forest Meteorology, 2009, 149(12): 2064-2070.
[52] YU G R, WEN X F, SUN X M, et al. Overview of ChinaFLUX and evaluation of its eddy covariance measurement[J]. Agricultural and Forest Meteorology, 2006, 137(3): 125-137.
[53] 胡波. 中国紫外与光合有效辐射的联网观测及其时空分布特征研究[D]. 北京:中国科学院大学,2005.
HU Bo. Establishing a Solar Radiation Measurement Network in Chinese Ecosystem Research Network and Study on the Distribution Characteristics of Ultraviolet and Photosynthetically Radiation in China[D]. Beijing: University of Chinese Academy of Sciences, 2005. (in Chinese with English abstract)
[54] NEON (National Ecological Observatory Network). Photosynthetically active radiation (PAR) (DP1.00024.001) [EB/OL]. 2021-12-12 [2023-01-12]. https://data.neonscience.org.
[55] BALDOCCHI D, FALGE E, GU L, et al. FLUXNET: A new tool to study the temporal and spatial variability of ecosystem-scale carbon dioxide, water vapor, and energy flux densities[J]. Bulletin of the American Meteorological Society, 2001, 82(11): 2415-2434.
[56] 王文玲,胡波,安俊琳,等. 拉萨光合有效辐射的变化趋势及其估算方程的建立[J]. 高原气象,2013,32(3):682-688.
WANG Wenling, HU Bo, AN Junlin, et al. Trend and estimation of photo-synthetically active radiation at Lhasa station[J]. Plateau Meteorology, 2013, 32(3): 682-688. (in Chinese with English abstract)
[57] 白建辉. 华北地区光合有效辐射的计算方法研究[J]. 气象与环境学报,2009,25(2):1-8.
BAI Jianhui. Calculating photosynthetically active radiation in north Chian[J]. Journal of Meteorology and Environment, 2009, 25(2): 1-8. (in Chinese with English abstract)
[58] ZHANG H, DONG X, XI B, et al. Retrieving high-resolution surface photosynthetically active radiation from the MODIS and GOES-16 ABI data[J]. Remote Sensing of Environment, 2021, 260: 112436.
[59] WANG L, GONG W, FENG L, et al. Estimation of hourly and daily photosynthetically active radiation in Inner Mongolia, China, from 1990 to 2012[J]. International Journal of Climatology, 2015, 35(10): 3120-3131.
[60] 王利民,刘佳,杨玲波,等. MODIS数据辅助的GF-1影像晴空光合有效辐射反演[J]. 农业工程学报,2017,33(4):217-224.
WANG Limin, LIU Jia, YANG Lingbo, et al. GF-1 image clear sky PAR inversion assisted by MODIS data[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(4): 217-224. (in Chinese with English abstract)
[61] ZHANG X, LIANG S, ZHOU G, et al. Generating global land surface satellite incident shortwave radiation and photosynthetically active radiation products from multiple satellite data[J]. Remote Sensing of Environment, 2014, 152: 318-332.
[62] LI L, XIN X, ZHANG H, et al. A method for estimating hourly photosynthetically active radiation (PAR) in China by combining geostationary and polar-orbiting satellite data[J]. Remote Sensing of Environment, 2015, 165: 14-26.
[63] 章钊颖,王松寒,邱博,等. 日光诱导叶绿素荧光遥感反演及碳循环应用进展[J]. 遥感学报,2019,23(1):37-52.
ZHANG Zhaoying, WANG Songhan, QIU Bo, et al. Retrieval of sun-induced chlorophyll fluorescence and advancements in carbon cycle application[J]. Journal of Remote Sensing, 2019, 23(1): 37-52. (in Chinese with English abstract)
[64] 刘良云,张永江,王纪华,等. 利用夫琅和费暗线探测自然光条件下的植被光合作用荧光研究[J]. 遥感学报,2006,10(1):130-137. LIU Liangyun, ZHANG Yongjiang, WANG Jihua, et al. Detecting photosynthesis fluorescence under natural sunlight based on Fraunhofer line[J]. National Remote Sensing Bulletin, 2006, 10(1): 130-137. (in Chinese with English abstract)
[65] COGLIATI S, ROSSINI M, JULITTA T, et al. Continuous and long-term measurements of reflectance and sun-induced chlorophyll fluorescence by using novel automated field spectroscopy systems[J]. Remote Sensing of Environment, 2015, 164: 270-281.
[66] CHEN J, LIU X, DU S, et al. Integrating SIF and clearness index to improve maize GPP estimation using continuous tower-based observations[J]. Sensors (Basel, Switzerland), 2020, 20(9): 2493.
[67] 关琳琳. 基于叶绿素荧光的植被总初级生产力估算[D]. 北京:中国科学院大学,2017.
GUAN Linlin. Estimation of Gross Primary Production Using Sun-induced Chlorophyll Fluorescence[D]. Beijing: University of Chinese Academy of Sciences, 2017. (in Chinese with English abstract)
[68] LIU X, LIU Z, LIU L, et al. Modelling the influence of incident radiation on the SIF-based GPP estimation for maize[J]. Agricultural and Forest Meteorology, 2021, 307: 108522.
[69] MOHAMMED G H, COLOMBO R, MIDDLETON E M, et al. Remote sensing of solar-induced chlorophyll fluorescence (SIF) in vegetation: 50 years of progress[J]. Remote Sensing of Environment, 2019, 231: 111177.
[70] HAN S, LIU Z, CHEN Z, et al Using high-frequency par measurements to assess the quality of the SIF derived from continuous field observations[J]. Remote Sensing, 2022, 14(9): 2083.
[71] BÄUMKER E, ZIMMERMANN D, SCHIERLE S, et al. A novel approach to obtain PAR with a multi-channel spectral microsensor, suitable for sensor node integration[J]. Sensors, 2021, 21(10): 3390.
[72] RAJENDRAN J, LEON-SALAS W D, FAN X, et al. On the development of a low-cost photosynthetically active radiation (par) sensor[C]. 2020 IEEE International Symposium on Circuits and Systems (ISCAS). Seville, Spain, 2020: 1-5.
[73] MIMS III F M. A 5-year study of a new kind of photosynthetically active radiation sensor[J]. Photochemistry and Photobiology, 2003, 77(1): 30-33.
[74] PONTAILLER J Y. A cheap quantum sensor using a gallium arsenide photodiode[J]. Functional Ecology, 1990, 4(4): 591-596.
[75] 张杰,熊显名,张馨,等. 光合有效辐射传感器及其调理电路设计[J]. 自动化与仪表,2012,27(6):12-15.
ZHANG Jie, XIONG Xianming, ZHANG Xin, et al. Photosynthetically active radiation sensor and its conditioning circuit design[J]. Automation & Instrumentation, 2012, 27(6): 12-15. (in Chinese with English abstract)
[76] LEON-SALAS W D, RAJENDRAN J, VIZCARDO M A, et al. Measuring Photosynthetically Active Radiation with a Multi-Channel Integrated Spectral Sensor[C]. 2021 IEEE International Symposium on Circuits and Systems (ISCAS). Daegu, Korea, 2021: 1-5.
[77] LONG M H, RHEUBAN J E, BERG P, et al. A comparison and correction of light intensity loggers to photosynthetically active radiation sensors[J]. Limnology and Oceanography: Methods, 2012, 10(6): 416-424.
[78] GALLO K P, DAUGHTRY C S T. Techniques for measuring intercepted and absorbed photosynthetically active radiation in corn canopies[J]. Agronomy Journal, 1986, 78(4): 752-756.
[79] BARNARD H R, FINDLEY M C, CSAVINA J. PARduino: A simple and inexpensive device for logging photosynthetically active radiation[J]. Tree Physiology, 2014, 34(6): 640-645.
[80] 胡波,王跃思,刘广仁. 太阳紫外/光合有效辐射表标定方法探讨[J]. 气候与环境研究,2010,15(2):210-216.
HU Bo, WANG Yuesi, LIU Guangren. A study of ultraviolet and photosynthetically active radiation pyranometer calibration method[J]. Climatic and Environmental Research, 2010, 15(2): 210-216. (in Chinese with English abstract)
[81] 孔诗媛. 光合有效辐射表量值传递系统研究[D]. 长春:长春理工大学,2014.
KONG Shiyuan. Research on Value Delivery System of Photosynthetic-Active-Radiation Pyranometer[D]. Changchun: Changchun University of Science and Technology, 2014. (in Chinese with English abstract)
[82] 孔诗媛,沙奕卓,杨云,等. 光合有效辐射表灵敏度校准方法研究[J]. 气象水文海洋仪器,2013,30(4):4-7.
KONG Shiyuan, SHA Yizhuo, YANG Yun, et al. Sensitivity calibration method of photosynthetic activ radiation pyranometer[J]. Meteorological,Hydrological and Marine Instruments, 2013, 30(4): 4-7. (in Chinese with English abstract)
[83] 丁蕾,杨云,边泽强,等. 5种光合有效辐射表性能测试[J]. 应用气象学报,2013,24(5):617-624.
DING Lei, YANG Yun, BIAN Zeqiang, et al. Performance test of five-type photosynthetic active radimeters[J]. Journal of Applied Meteorological Science, 2013, 24(5): 617-624. (in Chinese with English abstract)
[84] JEWSON D H, TALLING J F, DRING M J, et al. Measurement of photosynthetically available radiation in freshwater: Comparative tests of some current instruments used in studies of primary production[J]. Journal of Plankton Research, 1984, 6(2): 259-273.
[85] 朱治林,孙晓敏,于贵瑞,等. 典型森林生态系统总辐射和光合有效辐射长期观测中的仪器性能衰变和数据校正[J]. 应用生态学报,2011,22(11):2954-2962.
ZHU Zhilin, SUN Xiaomin, YU Guirui, et al. Radiometers performance attenuation and data correction in long-term observation of total radiation and photosynthetically active radiation in typical forest ecosystems in China[J]. Chinese Journal of Applied Ecology, 2011, 22(11): 2954-2962. (in Chinese with English abstract)
[86] 周成波,张旭,崔青青,等. LED补光光质对小白菜生长及光合作用的影响[J]. 植物生理学报,2017,53(6):1030-1038.
ZHOU Chengbo, ZHANG Xu, CUI Qingqing, et al. Effects of supplementary light quality on growth and photosynthesis of pakchoi ()[J]. Plant Physiology Journal, 2017, 53(6): 1030-1038. (in Chinese with English abstract)
[87] 张昕昱,宁效龙,郑佳楠,等. 余弦修正片对光照传感器进光量的影响[J]. 照明工程学报,2019,30(6):174-179.
ZHANG Xinyu, NING Xiaolong, ZHENG Jianan, et al. Effect of cosine modifier on the amount of light entering the PAR sensor[J]. China Illuminating Engineering Journal, 2019, 30(6): 174-179. (in Chinese with English abstract)
[88] 钱大憨,刘文,刘路青,等. 多通道光合有效辐射传感器[J]. 照明工程学报,2016,27(2):29-33.
QIAN Dahan, LIU Wen, LIU Luqing, et al. Multi-channel photosynthetic active radiation sensor[J]. China Illuminating Engineering Journal, 2016, 27(2): 29-33. (in Chinese with English abstract)
[89] WOODWARD F I. Instruments for the measurement of photosynthetically active radiation and red, far-red and blue light[J]. Journal of Applied Ecology, 1983, 20(1): 103-115.
[90] 宋婷婷,罗瑞龙. 基于无线网桥的水下光合有效辐射远程测试系统[J]. 电子技术应用,2016,42(3):81-83.
SONG Tingting, LUO Ruilong. Remote data acquisition system for water photosynthetically available radiation based on wireless bridge[J]. Application of Electronic Technique, 2016, 42(3): 81-83. (in Chinese with English abstract)
[91] OLLE M, VIRŠILE A. The effects of light-emitting diode lighting on greenhouse plant growth and quality[J]. Agricultural and Food Science, 2013, 22(2): 223-234.
[92] OUZOUNIS T, ROSENQVIST E, OTTOSEN C O. Spectral effects of artificial light on plant physiology and secondary metabolism: A review[J]. HortScience, 2015, 50(8): 1128-1135.
[93] HOGEWONING S W, WIENTJES E, DOUWSTRA P, et al. Photosynthetic quantum yield dynamics: From photosystems to leaves[J]. The Plant Cell, 2012, 24(5): 1921-1935.
[94] ZHEN S, VAN IERSEL M, BUGBEE B. Why far-red photons should be included in the definition of photosynthetic photons and the measurement of horticultural fixture efficacy[J]. Frontiers in Plant Science, 2021, 12: 1158.
[95] MURAKAMI K, MATSUDA R, FUJIWARA K. A mathematical model of photosynthetic electron transport in response to the light spectrum based on excitation energy distributed to photosystems[J]. Plant & Cell Physiology, 2018, 59(8): 1643-1651.
[96] 童哲,赵玉锦,王台,等. 植物的光受体和光控发育研究[J]. 植物学报,2000,42(2):111-115.
TONG Zhe, ZHAO Yujin, WANG Tai, et al. Photoreceptors and light regulated development in plants[J]. Journal of Integrative Plant Biology, 2000, 42(2): 111-115. (in Chinese with English abstract)
[97] 王小菁. 我国光形态建成研究回顾[J]. 植物学通报,2003,20(4):407-415. WANG Xiaojing. A look backwards on the research of the photomorphogenesis in China[J]. Chinese Bulletin of Botany, 2003, 20(4): 407-415. (in Chinese with English abstract)
[98] 郑洁,胡美君,郭延平. 光质对植物光合作用的调控及其机理[J]. 应用生态学报,2008,19(7):1619-1624.
ZHENG Jie, HU Meijun, GUO Yanping. Regulation of photosynthesis by light quality and its mechanism in plants[J]. Chinese Journal of Applied Ecology, 2008, 19(7): 1619-1624. (in Chinese with English abstract)
Definition of photosynthetically active radiation (PAR) and its development progress
SUN Gang1, LIU Hui2, LI Li1, GAO Shuai1, ZHANG Quanjun3, HUANG Wenjiang4, LIU Liangyun4, LIU Qinhuo1※
(1.,,,100101,; 2.,100029,; 3.,,,100101,; 4.,,,100094)
Photosynthesis is one of the most important physiological activities of plant individuals. Green plants use light to drive photosynthesis in the wavelength range of 400 to 700 nm. Photosynthetically active radiation (PAR) can be used to measure the photosynthetic potential in plant individuals or ecosystems. Therefore, the PAR is one of the bridges to link physiology and ecology. However, there is the varying efficiency of different plants using light in this range, particularly with the different plant types and growth stages. As a result, it is a high demand to accurately measure the portion of light radiation for better photosynthesis. Much effort has been made in the fields of ecology, agronomy, meteorology, and remote sensing over the years, including the different definitions and experiments. A series of sensors have been developed, where the PAR sensors have been generally accepted to evaluate photosynthesis. These sensors can be used to measure some parameters, such as the photosynthetic photon flux or its density in the 400 to 700 nm wavelength range. There is a flat and straight line in the spectral response function of these sensors. In this review, the formation of the PAR definition was introduced for the evolution of the PAR sensor. Various technologies were used to correct the original spectral response function of photodetectors, including filtering, and transmittance correction. The spectral response function of the sensor was close to the ideal PAR one. The current optical quantum sensor still shared a wide range of applications for the comparison benchmark with a small error. But it was lacking to perfectly measure the photosynthetic effective radiation. Earlier studies cannot fully quantify the spectral response of photosynthesis under either photometric or radiant units nearly five decades ago. The definition of PAR also failed to completely unify into the spectral response function of PAR measurement sensors in recent years, due to the diversity of applications. Alternatively, the MCCREE curve was considered the standard for the spectral response of photosynthesis. Nevertheless, some challenges remained in the new experimental design and differences between individual photosynthetic and whole-plant growth responses. The MCCREE curve was also replicated with LED lighting and optical filters. However, challenges occurred with the wavelength selection and the higher light intensity levels. A comprehensive spectral response of photosynthesis analysis was required for the different green plants with better controllability over the wavelength, full width at half maximums (FWHM), and higher light intensity. In particular, the wavelength range absorbed by plants was wider than 400 to 700 nm for artificial light illumination and plant growth. There were significant effects of different spectral energy distributions (wavelength and energy ratio) and photoperiods on photosynthesis. It is a high demand to distinguish the effects of these factors on photosynthesis, in terms of plant morphology. As a result, the definition of PAR is still on the way for the development of measuring instruments. Ideally, the definition of PAR should be proposed from the perspective of plant photosynthesis. The spectral response function curve of the sensor should be consistent with the capacity curve of plant photosynthesis. The future trend of the PAR sensor is to program the spectral response function. PAR estimation can be realized at the regional and global scales using remote sensing. Large-scale PAR products can be developed to significantly promote the global carbon cycle and remote sensing.
remote sensing; sensor; photosynthesis; photosynthetically active radiation; photosynthetic photon flux density; PAR
2023-01-16
2023-03-06
国家自然科学基金资助项目(42171377)
孙刚,博士,工程师,研究方向为智能装备与农业遥感技术。Email:sungang@aircas.ac.cn
柳钦火,博士,研究员,研究方向为遥感辐射传输理论与应用。 Email:liuqh@aircas.ac.cn。
10.11975/j.issn.1002-6819.202301094
S24;S126
A
1002-6819(2023)-08-0020-12
孙刚,刘慧,李丽,等.光合有效辐射及其传感器研究进展[J]. 农业工程学报,2023,39(8):20-31. doi:10.11975/j.issn.1002-6819.202301094 http://www.tcsae.org
SUN Gang, LIU Hui, LI Li, et al. Definition of photosynthetically active radiation (PAR) and its development progress[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2023, 39(8): 20-31. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.202301094 http://www.tcsae.org

