过表达内源Trswo1基因提高里氏木霉纤维素酶对玉米秸秆水解效率的研究
莫易,冉小琴,王赞丞,陈雨点,彭念,李江洪,李勇昊*
1(重庆科技学院 化学化工学院,重庆,401331)2(工业发酵微生物重庆市重点实验室(重庆科技学院),重庆,401331)
由秸秆为代表的木质纤维素类生物质资源转化为生物燃料和生物基化学品是引领“烃经济”向“糖经济”转型的重要突破口[1]。然而,秸秆类生物质坚韧的超分子结构,需要高效的纤维素酶才能将纤维素水解为可发酵性糖。纤维素酶高产菌株主要来自里氏木霉(Trichodermareesei)[2],T.reesei纤维素酶主要包括内切纤维素酶、外切纤维素酶、β-葡萄糖苷酶和多种纤维素降解辅助蛋白[3],它们协同将纤维素水解为葡萄糖,但这些蛋白的合成均需诱导。
前期通过β-葡萄糖苷酶催化高浓度葡萄糖制备葡萄糖-槐糖混合物(mixture of glucose and sophorose, MGD)可以高效诱导T.reesei合成纤维素酶[4],然而蛋白质组学研究发现相比于木质纤维素固体诱导物,虽然可以合成更高水平的外切纤维素酶和内切纤维素酶,但是纤维素降解辅助蛋白表达量明显降低,尤其是膨胀素(swollenin,SWO1)[5]。已有研究表明SWO1虽然无糖苷水解酶活性,但可以破坏木质纤维素致密的高分子结构,从而协同纤维素酶提高催化速率[6-7]。目前已发现十多种SWO1作为纤维素降解辅助蛋白可提高纤维素酶水解效率[8-9]。其中T.reesei内源SWO1是最先被发现的,但尚无在T.reesei中过表达该基因并利用MGD作为诱导物刺激纤维素酶合成的研究。
因此本研究在T.reeseiRut C30中利用组成型强启动子丙酮酸脱羧酶1(pyruvate decarboxylase1, PDC1)高效表达内源Trswo1基因,重组菌株利用MGD为诱导物发酵生产纤维素酶,并被用于水解碱预处理玉米秸秆(alkali pretreated corn straw, APCS);最后通过X射线衍射(X-ray diffraction, XRD)和扫描电镜(scanning electron microscope, SEM)分析SWO1蛋白协同纤维素酶降解纤维素的分子机制。研究结果为T.reesei利用MGD为诱导物合成高水解效率的纤维素酶系具有一定意义。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
T.reeseiRut C30(NRRL 11460)惠赠于美国农业研究菌种保藏中心;大肠杆菌(Escherichiacoli)DH5α感受态购自北京擎科生物科技有限公司。根瘤农杆菌(Agrobacteriumtumefaciens)AGL-1惠赠于青岛农业大学咸洪泉教授。pPTPDC1由本实验室之前研究构建的表达载体,包括PDC1启动子和终止子以及潮霉素B抗性基因,在T.reesei中使用潮霉素B作为筛选标记[5]。
1.1.2 培养基
LB培养基(g/L):蛋白胨10,NaCl 10,酵母浸粉5,如配制固体培养基则添加20 g/L琼脂粉。
PDA培养基(g/L):马铃薯浸出液200,葡萄糖20,琼脂20。
固体生孢培养基(g/L):麦芽提取物30,琼脂20。
种子培养基(g/L):葡萄糖4,玉米浆粉10。
纤维素酶发酵培养基(g/L):MGD 10,蛋白胨1,尿素0.3,(NH4)2SO41.4,KH2PO42,MgSO4·7H2O 0.3,CaCl20.4,FeSO4·7H2O 5 mg/L,MnSO4·H2O 1.7 mg/L,ZnSO4·7H2O 1.4 mg/L,0.2 mol/L磷酸氢二钠-柠檬酸缓冲液(pH 5.0)500 mL/L。
1.1.3 试剂
植物总RNA提取试剂盒(离心柱型)、TSINGKE TSV-S1 Trelief®SoSoo Cloning Kit、2×TSINGKE®Master qPCR Mix(SYBR Green 1 with UDG),北京擎科生物科技有限公司;SanPrep柱式质粒DNA小量抽提试剂盒,生工生物工程(上海)股份有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time),TaKaRa公司;限制性内切酶BsiWⅠ,美国New England Biolabs公司;β-葡萄糖苷酶,夏盛(北京)生物科技开发有限公司。
MGD是由β-葡萄糖苷酶催化葡萄糖转糖苷反应合成[4]。具体以0.2 mol/L磷酸氢二钠-柠檬酸缓冲液(pH 4.8)配制600 g/L葡萄糖,加入20 CBU/g葡萄糖的β-葡萄糖苷酶。65 ℃孵育72 h后在105 ℃下处理5 min失活β-葡萄糖苷酶。离子色谱测定MGD含有410.20 g/L葡萄糖、60.56 g/L龙胆二糖、9.34 g/L纤维二糖和13.66 g/L槐糖,其中槐糖为已知T.reesei诱导合成纤维素酶最强诱导物。
APCS由2%(质量分数)NaOH于121 ℃条件下处理90 min,碱处理后的APCS用自来水洗至中性,置于烘箱烘干备用,得到的APCS室温保存[10]。
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂的配制方法如下。甲液:称取NaOH 104 g溶解于1 300 mL蒸馏水中,再加入30 g 3,5-二硝基水杨酸,加热溶解;乙液:称取910 g酒石酸钾钠溶于2 500 mL蒸馏水中,溶解后加入25 g结晶酚和25 g NaHSO3,混匀。将上述甲、乙两液混合,加入1 200 mL蒸馏水(总体积5 000 mL),贮于棕色瓶中备用,在室温下放置1周后可以使用。
1.1.4 仪器与设备
SW-CJ-1FD洁净工作台,苏州安泰空气技术有限公司;ZWY-240恒温培养振荡器,上海智城分析仪器制造有限公司;MJ-150F-I霉菌培养箱,上海一恒科学仪器有限公司;A300基因扩增仪,杭州朗基科学仪器有限公司;CFX Connect荧光定量PCR仪,美国Bio-rad公司;希尔曼S-10生物传感器分析仪,深圳市西尔曼科技有限公司;X射线衍射仪XRD-7000,日本岛津公司;JSM-7800F扫描电子显微镜,日本电子株式会社。
1.2 实验方法
1.2.1 过表达Trswo1基因质粒与T.reesei基因工程菌的构建
T.reeseiRut C30孢子接种于种子培养基于28 ℃培养24 h,再将菌丝体以10%(体积分数)接种到含有50 mL纤维素酶发酵培养基的250 mL锥形瓶中于28 ℃培养48 h。取样提取RNA后逆转录为cDNA;以cDNA为模板,swo1-F/R(含有20 bp pPTPDC1同源片段)为引物扩增Trswo1基因;利用BsiWⅠ线性化表达载体pPTPDC1,使用无缝克隆方法将线性化载体与Trswo1基因连接,通过热激法将连接产物转化E.coliDH5α感受态细胞,成功构建的过表达Trswo1基因表达载体命名pPTPDC1-swo1;pPTPDC1-swo1利用PCR验证成功后DNA测序验证保证基因无突变。表1为本研究使用到的引物。

表1 载体构建和实时荧光定量PCR所需引物Table 1 Primers used for vector construction and quantitative real-time PCR
通过A.tumefaciens介导遗传转化的方法将质粒pPTPDC1-swo1中包含Trswo1表达盒的T-DNA整合到T.reeseiRut C30基因组,利用含有300 μg/mL潮霉素B抗性的PDA平板筛选转化子,提取转化子基因组PCR验证后进行DNA测序保证基因无突变。
1.2.2 摇瓶发酵生产纤维素酶
T.reesei于固体生孢培养基28 ℃培养7 d收集孢子[11],将孢子接种到50 mL种子培养基,在28 ℃、150 r/min条件培养24 h后将菌丝体以10%(体积分数)接种到50 mL纤维素酶发酵培养基,在28 ℃、150 r/min条件下诱导纤维素酶合成。
1.2.3 碱预处理玉米秸秆的水解
质量分数为5%的APCS在pH 4.8的醋酸-醋酸钠缓冲液(0.2 mol/L)中进行酶解,加酶量为10 FPU/g APCS,由于T.reesei所产纤维素酶缺乏β-葡萄糖苷酶,进而导致水解过程中纤维二糖积累从而抑制外切和内切纤维素酶活性导致纤维素酶水解效率降低[12],因此本研究额外添加326 U/g APCS的β-葡萄糖苷酶;反应在30 mL样品瓶中进行,装液量为7.5 mL,反应温度50 ℃,转速150 r/min。
1.3 分析方法
纤维素酶活性测定:按国际理论和应用化学协会推荐的国际标准法测定[13]。向比色管中加入 0.5 mL 经稀释后的酶液、1.0 mL醋酸-醋酸钠缓冲液(0.2 mol/L,pH 4.8)和1 cm×6 cm的约50 mg的Whatman NO.1滤纸,于50 ℃水浴锅中反应60 min,反应结束后立即加入DNS试剂反应液终止酶反应,测定生成还原糖的量。酶活性单位的定义:在最适反应条件下,每分钟水解Whatman No.1滤纸产生1 μmol还原糖所需的酶量为1个酶活力单位。
外切纤维素酶活性测定:以1 g/L对硝基苯纤维二糖苷(4-nitrophenyl β-D-cellobioside,pNPC)为底物测定[14]。向1.5 mL离心管中加入100 μL经适当稀释的酶液以及50 μLpNPC溶液,于50 ℃水浴锅中反应30 min后,立即加入150 μL 10%(质量分数)Na2CO3终止反应,测定415 nm处的吸光值。酶活性单位的定义:在酶最适反应条件下,每分钟水解pNPC产生1 μmol对硝基苯酚(p-nitrophenol,pNP)所需的酶量定义为1个酶活力单位。
内切纤维素酶活性测定:以2%(质量分数)羧甲基纤维素(carboxymethyl cellulose,CMC)为底物测定[13]。向试管中加入0.5 mL经适当稀释的酶液及0.5 mL醋酸-醋酸钠缓冲液(0.2 mol/L,pH 4.8),于50 ℃水浴锅中反应30 min,反应结束后立即加入DNS试剂,测定反应液中生成的还原糖含量。酶活性单位的定义:在酶最适反应条件下,每分钟水解CMC产生1 μmol还原糖所需的酶量定义为1个酶活力单位。
葡萄糖浓度测定:使用希尔曼S-10生物传感器分析仪测定葡萄糖的浓度。
菌株平板生长分析:将T.reesei孢子接种于去除蛋白胨的纤维素酶发酵固体培养基平板(直径35 mm),在28 ℃条件下培养观察T.reesei菌丝生长直径。
实时荧光定量PCR(quantitative real-time PCR,qPCR)分析:T.reesei孢子接种于50 mL种子培养基于28 ℃培养24 h,菌丝体以10%(体积分数)的比例接种到50 mL纤维素酶发酵培养基,28 ℃培养36 h后收集菌丝,提取RNA并逆转录为cDNA。按照2×TSINGKE®Master qPCR Mix的说明书进行qPCR测定基因相对表达量,所有基因的qPCR引物如表1所示。采用2-ΔCt法计算基因相对表达量,sar1基因作为管家基因。
XRD分析:酶解后的固体残留物过滤后用蒸馏水洗涤3次并干燥后研磨,使用X射线衍射仪在40 kV 和30 mA的Cu辐照条件下分析样品,扫描范围为2θ=8°~80°。用峰高法计算了样品的结晶度指数(crystallinity index,CrI)[15],CrI的计算如公式(1)所示:

(1)
式中:I002为002衍射面的结晶度;IAM为非结晶区的衍射强度,2θ=18°。
SEM分析:通过扫描电镜观察酶解72 h后APCS表面的微观变化。样品用双面胶黏附于金属圆盘上,表面喷镀铂金后在5 kV下观察。
2 结果与分析
2.1 表达载体构建及里氏木霉转化子鉴定
本研究想提高MGD诱导T.reesei合成纤维素酶系的水解效率,而MGD中除诱导物槐糖外,还有大量葡萄糖存在,因此本研究选用葡萄糖为碳源条件下PDC1启动内源Trswo1基因表达,有效避免使用cbh1或者xyn3启动子导致本底纤维素酶基因转录水平降低问题[16]。
实验室前期已构建了包含PDC1启动子和终止子的T.reesei基因表达载体pPTPDC1,启动子和终止子之间含有BsiWⅠ限制性内切酶位点,该载体已经成功在T.reeseiRut C30中表达了外源aabgl1基因,使得T.reesei的β-葡萄糖苷酶活性提高了70多倍[5]。所以本研究利用BsiWⅠ线性化pPTPDC1后,通过无缝克隆技术将Trswo1基因连接到PDC1启动子和终止子之间,成功构建过表达Trswo1基因的载体并命名为pPTPDC1-swo1(图1-a)。利用A.tumefaciens介导的T.reesei遗传转化将Trswo1基因表达盒整合到T.reeseiRut C30基因组,挑取2个潜在的转化子,并提取转化子基因组后以Bsiw1yz-F/R为引物通过PCR证明转化成功(图1-b),进而通过DNA测序验证了Trswo1基因表达盒没有发生碱基突变(图1-c),将2株阳性转化子分别命名为T.reeseiOEswo1-1和OEswo1-2。

a-表达载体pPTPDC1-swo1;b-PCR验证Trswo1基因表达盒(M-marker);c-DNA测序验证Trswo1基因表达盒图1 表达载体的构建及Trswo1基因的验证Fig.1 Construction of the expression vector and verification of the Trswo1 gene
2.2 过表达Trswo1基因对T.reesei Rut C30生长和纤维素酶合成的影响
T.reeseiRut C30和2株阳性转化子(T.reeseiOEswo1-1和OEswo1-2)以10 g/L MGD为诱导物在纤维素酶发酵培养基中培养36 h后取样提取RNA并反转为cDNA,通过qPCR检测T.reeseiOEswo1-1和OEswo1-2的Trswo1基因相对表达量分别是野生型菌株的4.65倍和3.91倍(P<0.001)。表明Trswo1基因在2株阳性转化子中均实现了过表达。
进一步对野生型和两株阳性转化子发酵生产纤维素酶,对纤维素酶活性、外切纤维素酶活性和内切纤维素酶活性进行测定,发现过量生产SWO1后并不会提高以上3种糖苷水解酶活性(P>0.05)(图2-b~图2-d)。这与SWO1蛋白无糖苷水解酶活性的研究结果相一致[17]。
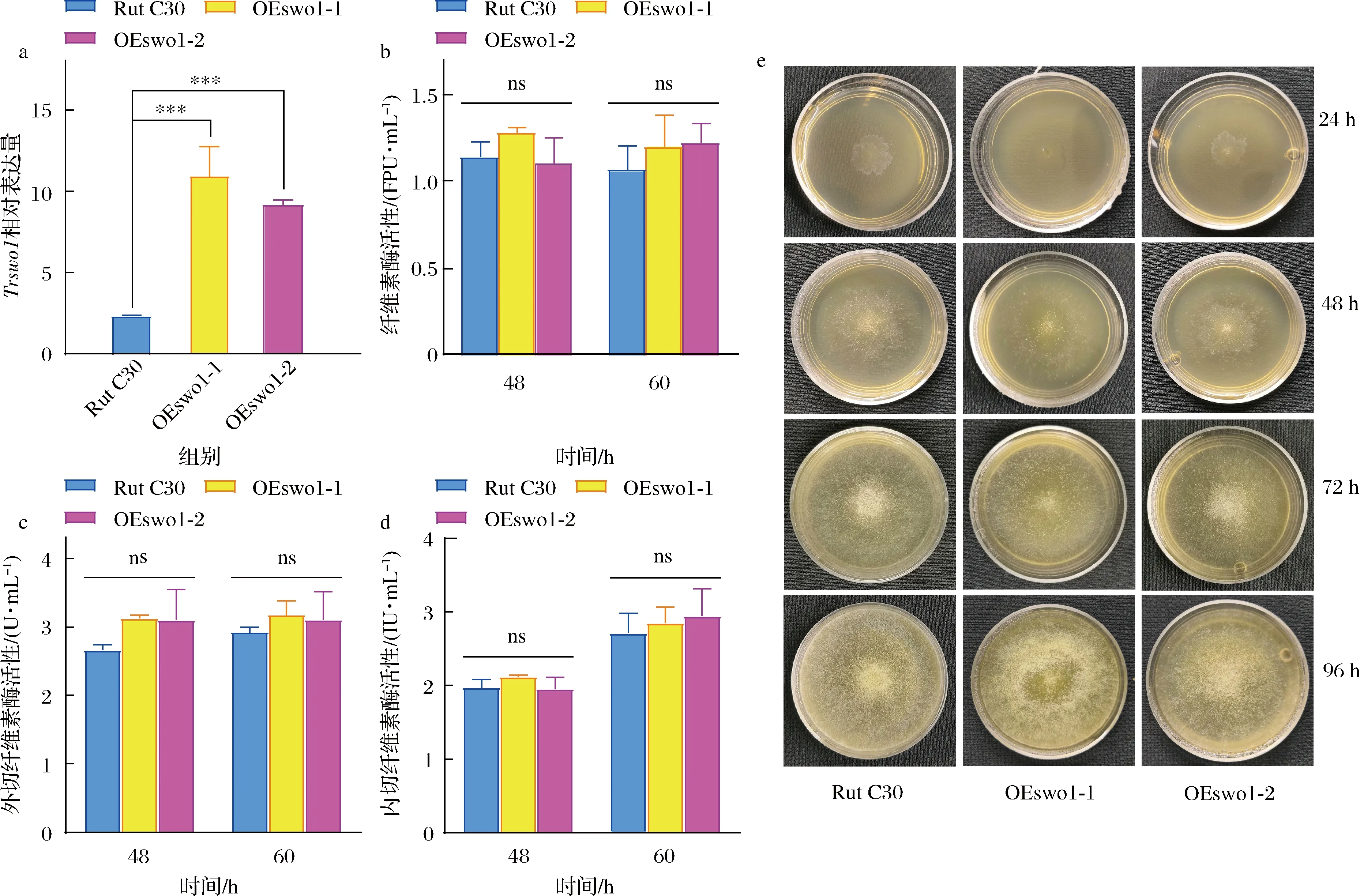
a-Trswo1相对表达量;b-纤维素酶活性;c-外切纤维素酶活性;d-内切纤维素酶活性;e-T.reesei Rut C30和转化子的形态图2 T.reesei Rut C30与转化子Trswo1基因转录分析和酶活性分析Fig.2 Transcription analysis of Trswo1 and activities of cellulase, exoglucanase, and endoglucanase from T.reesei Rut C30 and transformants with MGD as inducer注:*表示P<0.05,**表示P<0.01,***表示P<0.001,ns表示P>0.05(下同)
将等量的T.reeseiRut C30和2株阳性转化子的孢子接种到固体纤维素酶发酵培养基平板,在28 ℃下培养4 d。如图2-e所示,T.reeseiOEswo1-1在24 h孢子产生量小于另外2株菌的孢子产生量,而在其他时间点孢子产生量均无显著性差异,同时3个菌株菌丝的直径在任何时间点都没有显著性差异;上述结果表明,在T.reeseiRut C30中过表达Trswo1基因不影响菌株的生长。
2.3 碱预处理玉米秸秆的水解
虽然用MGD作为诱导物可以获得较高的纤维素酶活性,但普遍认为T.reesei的β-葡萄糖苷酶不足导致水解过程中纤维二糖积累抑制外切和内切纤维素酶活性,从而降低木质纤维素的水解效率,所以普遍额外添加β-葡萄糖苷酶保证纤维素酶的水解效率[4]。基于此本研究在水解体系中额外添加326 U/g APCS商业β-葡萄糖苷酶。
利用T.reeseiRut C30、OEswo1-1和OEswo1-2生产的纤维素酶(Cellulase-C30、Cellulase-OEswo1和Cellulase-OEswo2)分别被用于水解APCS,结果如图3所示,1 h后释放葡萄糖分别为4.58、4.86、5.72 g/L;水解12 h后Cellulase-OEswo1和Cellulase-OEswo2水解APCS后释放的葡萄糖相比于Cellulase-C30释放的葡萄糖分别提高了6.98%和13.93%(P<0.001)。这表明在MGD作为诱导物情况下,过量生产SWO1会显著性提高纤维素酶水解效率,而72 h的水解结果显示各种纤维素酶催化效率无显著性差异(P>0.05)。这是由于酶具有饱和动力学现象,因此含有更多SWO1的纤维素酶更适合同步糖化发酵水解木质纤维素。

图3 T.reesei Rut C30和OEswo1转化子酶解APCS的葡萄糖产量Fig.3 Glucose yield in the hydrolysis of APCS by enzyme from T.reesei Rut C30 and transformants
此外Trswo1基因表达水平与纤维素水解效率不成正比,虽然纤维素酶Cellulase-OEswo1相比于Cellulase-OEswo2含有更多的SWO1(P<0.05),但是Cellulase-OEswo1水解APCS的葡萄糖产量却低于Cellulase-OEswo2水解APCS的葡萄糖产量。表明SWO1必不可少,但是足量后继续提高其含量无法持续提高纤维素酶水解效率。这与已有研究保持一致,即SWO1和纤维素酶竞争纤维素中有限的结合位点,过量的SWO1反而会抑制纤维素酶的活性[8]。
2.4 酶解后固体残渣结构特征分析
为探究SWO1提高纤维素酶水解APCS效率的分子机制,利用SEM分析预处理前后玉米秸秆的结构特征,结果如图4所示,未经水解的APCS整个纤维表面光滑均匀且纤维没有分散,而经过纤维素酶Cellulase-C30水解会导致纤维分散,形成粗糙且无定形的表面;而经过纤维素酶Cellulase-OEswo1和Cellulase-OEswo2水解的APCS表面结构破坏更严重,并且由图4-c和图4-d可以看出纤维素酶Cellulase-OEswo1相比于Cellulase-OEswo2对纤维结构破坏的能力更强,这是由于Cellulase-OEswo1含有更多的SWO1。

a-APCS;b-Cellulase-C30处理的APCS;c-Cellulase-OEswo1处理APCS;d-Cellulase-OEswo2处理的APCS图4 酶解后固体残渣的扫描电镜图(2 000×)Fig.4 Scanning electron microscopy photo of hydrolysed APCS (2 000×)
玉米秸秆中的纤维素由结晶和非结晶2种结构组成,结晶结构是由葡聚糖链之间的大量氢键形成的,这种结晶结构会减缓纤维素酶的水解速率[18-19]。纤维素的结晶度通常由XRD测量的CrI来表示[20]。因此本文通过XRD测量分析了酶解前后APCS的CrI。结果如图5所示,所有样品均观察到2θ=16°和2θ=22°附近存在衍射峰,衍射峰的位置无明显变化,但衍射强度差异较大。样品的CrI值如表2所示,经过纤维素酶Cellulase-C30水解后的APCS与未经过水解相比,CrI降低(从74.34%降至60.95%);同时β-葡萄糖苷酶也可以将APCS的CrI由74.34%降至70.88%。而含有更多SWO1的纤维素酶Cellulase-OEswo1和Cellulase-OEswo2水解APCS后的残渣在2θ=22.5°处的CrI明显降低,与用纤维素酶Cellulase-C30处理后APCS的CrI相比(60.95%),经过纤维素酶Cellulase-OEswo1和Cellulase-OEswo2水解后APCS的CrI更低(53.27%和57.94%)。以上结果表明SWO1协同提高纤维素酶水解效率主要是由于破坏纤维素的结晶度。此外,纤维素酶Cellulase-OEswo1相比于Cellulase-OEswo2含有更多SWO1,可以更大程度上破坏纤维素的结晶度,这与SEM分析结果一致。
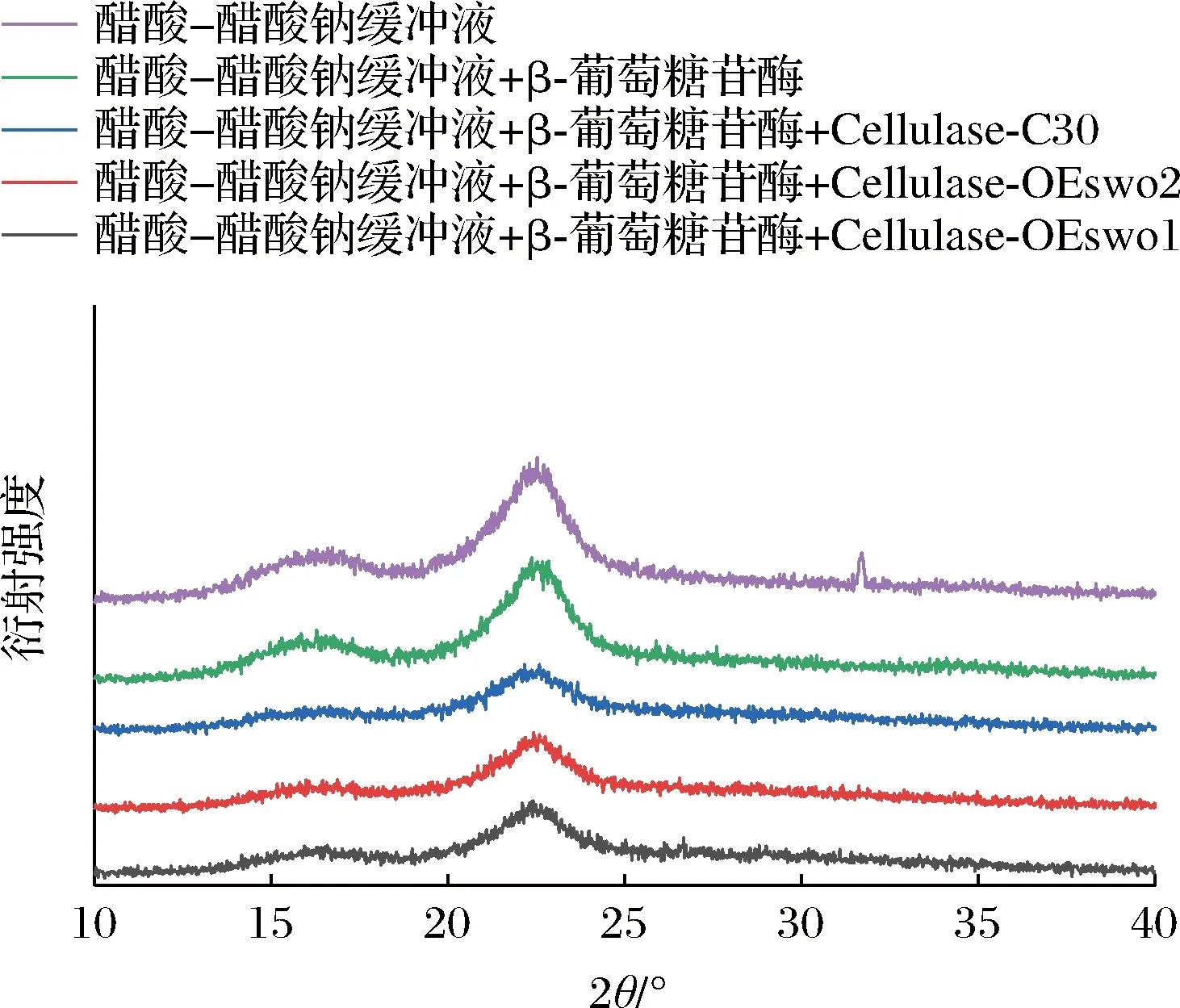
图5 酶解的固体残渣XRD谱图Fig.5 XRD spectra of the solid residues from enzymatic hydrolysis

表2 酶解的固体残渣的结晶度指数Table 2 Crystallization index of the solid from residues enzymatic hydrolysis
3 结论
本研究在TrichodermareeseiRut C30中过表达同源SWO1基因得到2株阳性转化子,Trswo1基因表达量分别提高了4.65倍和3.91倍。使用葡萄糖-槐糖混合物作为诱导物,发现过量生产SWO1对纤维素酶活性和菌株生长无显著性影响,但是可以提高对碱预处理玉米秸秆的水解效率。进一步分析过量生产的SWO1可破坏纤维素表面结构同时降低结晶度来协同纤维素酶提高玉米秸秆水解效率。该研究对T.reesei利用可溶性诱导物合成纤维素酶系中纤维素降解辅助蛋白含量低的问题具有一定意义。

