血液净化技术在多发性骨髓瘤治疗中的研究进展
王新宇,周芙玲
多发性骨髓瘤(multiple myeloma,MM)是一种以骨髓浆细胞克隆性增生为特点的血液系统恶性肿瘤,常有大量游离蛋白轻链(free light chain,FLC)的产生而导致各种终末器官损害。 肾损伤(renal impairment,RI) 是MM 的常见并发症,MM 患者的肾功能和临床预后密切相关,因此早期降低血清中FLC浓度,对于逆转肾脏病变、提高患者的生存率非常重要。 血液净化技术可以快速清除血清中的FLC,是药物化学治疗(简称“化疗”)的重要辅助手段。 笔者就当前应用于MM 治疗中的血液净化技术展开分析,以期为临床实践提供参考。
1 多发性骨髓瘤肾病
1.1 多发性骨髓瘤肾病的主要致病物质
MM 患者体内存在多种引起肾脏损害的致病物质,其中最重要的是由大量单克隆免疫球蛋白(M 蛋白)解离出的FLC。 单个M 蛋白分子由两条相同的重链和两条相同的轻链通过二硫键连接而成,轻链可以按照结构的差异分为κ 和λ 两种亚型。 正常人血清和尿液中均会含有一定量的轻链, 但是在MM 患者中,恶性增生的浆细胞产生了大量异常的M 蛋白,并导致过多FLC的产生。研究表明,随着血清FLC浓度的升高, 患者出现骨髓瘤管型肾病 (myeloma cast nephropathy, MCN)的风险也会升高,当血清FLC水平高于500 mg/L 时,可能会出现继发于MCN 的严重RI[1]。 MM 患者肾功能不全和其不良预后有较高的相关性,研究显示28%的早期死亡由肾功能损伤导致,出现肾功能损伤的患者总生存期明显短于肾功能正常的患者, 而肾功能的改善有利于总生存期的延长。因此早期的诊断和干预, 针对性地采用降低FLC的疗法对于改善MM 患者的预后非常重要。
1.2 多发性骨髓瘤肾损伤的主要治疗手段
临床上对MM 患者多采用化疗, 随着硼替佐米等新型药物的出现和使用,患者的肾功能预后得到了一定的改善。 但是化疗的起效往往需要一段时间,而且即使药物有效抑制了FLC的生成, 高浓度的FLC依旧会在体内保持相当长的一段时间[2]。 因此单靠化疗无法达到早期降低FLC的预期目标, 不利于改善患者的预后。 血液净化技术可以迅速降低MM 患者血液中异常免疫球蛋白和FLC 的浓度, 降低血液的黏度,改善微循环,进而促进化疗药物的渗透,提高患者对化疗药物的敏感性。
使用血液净化技术可以有效清除异常免疫球蛋白和FLC, 但是因其无法抑制这些致病物质的生成,所以在应用于MM 的治疗时必须联合化疗。 有研究指出, 通过体外途径清除致病物质后会解除反馈抑制,刺激机体产生更多的异常免疫球蛋白,从而加重病情[3]。 因此联合使用血液净化技术和常规化疗可能对改善MM 患者的预后更有利。
2 血液净化技术在多发性骨髓瘤肾病中的应用
目前应用于MM 治疗的血液净化技术主要有高截留量血液透析 (high-cutoff hemodialysis, HCOHD)、血浆置换(plasma exchange,PE)、双重滤过血浆置换(double filtration plasmapheresis, DFPP)和超滤再生血液透析滤过(supra-hemodiafiltrationwithendagenous reinfusion,Supra-HFR)。 笔者将就以上4 种血液净化技术在MM 肾病的治疗效果和安全性等方面进行综述,希望能为临床实践提供参考。
2.1 高截留量血液透析
HCO-HD 是一种使用高截留量血液透析膜(HCO 膜)进行透析的血液净化方式,其对FLC 的清除率明显高于普通透析器。 国际骨髓瘤工作组(International Myeloma Working Group) 建议使用HCOHD 联合抗骨髓瘤化疗药物治疗MCN 并发急性肾损伤(acute kidney injury,AKI)的患者,推荐等级为B 级[4]。国内的专家共识也推荐对MCN 所致AKI 的患者应用HCO-HD 治疗,因其在清除血清中FLC 的效果方面更有优势[5]。
有学者设计化疗联合常规透析治疗作为对照组的回顾性研究, 研究结果均显示HCO-HD 比常规透析治疗更有利于改善患者的功能预后[6,7]。近期两项在欧洲开展的多中心大样本的随机对照试验公布的结果显示, 与常规的高通量血液透析 (high-flux hemodialysis,HF-HD) 相比,HCO-HD 在早期改善患者的肾功能和总生存率方面并无明显优势(表1)[8,9]。其中一项共纳入了94 例MCN 患者的研究显示,虽然在第3 个月时, 两组患者脱离透析的比例差异无统计学意义,但是在第6 个月和第12 个月时,HCOHD 组患者脱离透析的比例(56.5 %、60.9 %)明显高于HF-HD 组(35.4%、37.5%),差异有统计学意义(P=0.04、0.02),且两组的并发症发生率差异无统计学意义[8]。
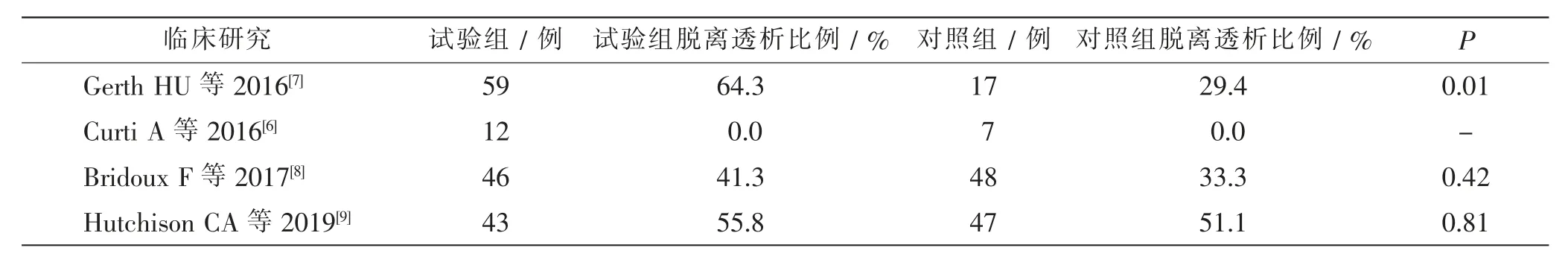
表1 HCO-HD 与HF-HD 治疗MCN 合并AKI 患者3 个月时的肾脏反应情况Tab.1 Renal response in MCN combined AKI patients treated with HCO-HD and HF-HD for 3 months
截至目前已有多项研究讨论了HCO-HD 在MM中的治疗效果, 虽然在促进患者肾功能早期恢复与改善远期生存率方面HCO-HD 并没有展现出明显的优势,但是HCO-HD 在清除FLC 方面明显优于传统透析方式, 且患者可以从治疗中获益, 所以HCO-HD 仍然是治疗MM 的重要辅助手段。 另外,因HCO 膜有较高的超滤系数,使用HCO-HD 的疗法难免会出现白蛋白丢失的问题,与之相关的不良反应需要引起重视。
2.2 超滤再生血液透析滤过
SUPRA-HFR 是一种集对流、吸附和扩散于一身的血液净化技术,利用两级血液透析达到既能清除致病物质,又能避免白蛋白大量丢失的目的。 一项病例报道显示,4 例MCN 患者在接受SUPRA-HFR 治疗的1 周内,FLC 水平均下降了50%, 有3 例患者在6周内脱离了透析治疗[10]。 一项回顾性研究显示,7 例MM并发AKI 的患者在接受SUPRA-HFR 治疗后, 患者的肾功能均得到改善, 并有6 例患者在12 个月内脱离血液透析[11]。 最新的一项观察性研究纳入了9 例MM 并发AKI 的患者, 在接受SURPRA-HFR 治疗后, 患者的血清白蛋白浓度没有明显变化,3 个月内有3 例患者肾功能恢复,1年随访期结束时共有4 例患者肾功能恢复[12]。
尽管在目前的研究中SUPRA-HFR 在清除FLC方面展示了良好的效果,但其会造成患者血清白蛋白和钙磷等电解质的大量丢失, 引发多种不良反应,所以并没有得到广泛开展。另外高昂的治疗费用也是限制该治疗推广的重要原因。
2.3 血浆置换
PE 是一种血浆分离技术(plasma separation),其基本原理是选择不同孔径的滤过膜进行血细胞和血浆的分离,并以此清除血浆中的致病物质。 在美国血浆置换学会(American Society for Apheresis,ASFA)的指南中,MCN 是PE 的Ⅱ类适应证, 推荐等级为2B级[13]。 在中国的MM 诊疗指南中,PE 被推荐为症状性高黏滞血症的辅助治疗方法[14]。
PE 对血液中FLC 的清除效果已在多项研究中得到证实,但是在改善患者的肾功能预后和远期生存方面,PE 的疗效仍存在争议。 有研究建立了二室模型,探讨了其原因,因为FLC 在体内有较大的分布容积,血液中的FLC 仅占总量的20%左右,在PE 治疗结束后FLC 的浓度会迅速恢复,所以治疗效果有限[15]。目前样本量最大的一项临床研究显示, 不支持PE 能够改善MM 并发急性肾衰竭患者的远期生存[16]。 随后的一项回顾性分析指出,PE 对确诊MCN 的患者有效[17]。最新的一项随机对照试验将29 例MM 并发AKI 的患者分入试验组和对照组,对照组只接受常规化疗,而试验组还需要联合PE 进行治疗。 试验结果显示两组患者的生存期差异无统计学意义,但是接受3 个及以上疗程PE 治疗的患者的生存期显著优于接受2 个及以下的患者(P=0.022)[18]。 表2 这项结果也支持了上述二室模型的观点,提示增加治疗频率或延长治疗时间对提高FLC 清除效果有利。另一项Meta 分析指出,对于MM导致的AKI 患者使用化疗联合PE 优于单独使用化疗。 该研究结果显示,尽管接受联合治疗的患者在第6 个月时的生存率指标无明显优势,但该组患者脱离透析的比例明显高于单独使用化疗组(P=0.04)[19]。
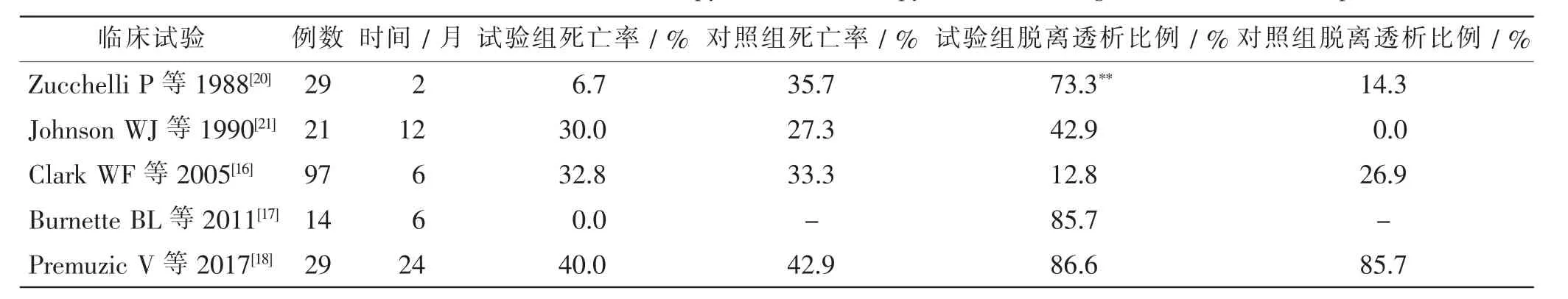
表2 PE 联合化疗与单用化疗治疗MCN 并发AKI 患者的主要观察指标Tab.2 Main outcomes of PE combined chemotherapy and chemotherapy alone in treating MCN combined AKI patients
上述研究的结果说明,PE 能够有效快速降低血液中FLC 的浓度, 延长治疗的时长或增加治疗的次数可能有更好的疗效, 但在改善肾功能预后的方面PE 并无明显优势。 而且PE 也会导致患者白蛋白大量丢失,所以在治疗过程中需要注意补充白蛋白。 目前在MM 的治疗中,PE 的明确适应证只有MM 并发高黏滞血症,其他的适应证仍待研究人员继续探索。
2.4 双重滤过血浆置换
DFPP 是一种源自PE 的半选择性PE 疗法,其核心装置为两个不同滤过孔径的过滤器。 DFPP 通过组合两种不同孔径的过滤器, 既可以有效清除FLC,又可以显著减少替代液的使用量,降低与替代液使用相关的不良反应发生率[22]。 目前日本国民健康保险覆盖的DFPP 使用范围已包括MM[22]。
病例报道显示,DFPP 联合化疗可以有效降低MM 患者血清中的FLC,促进肾功能的改善[23]。一项随机对照试验显示, 与单用化疗相比,DFPP 联合化疗可以显著降低MM 患者血清中的异常免疫球蛋白水平,改善患者的身体健康状况。 但是该项研究未进行随访,所以无法评估DFPP 对患者预后的改善情况[24]。也有学者讨论了DFPP 应用于MM 伴发高球蛋白血症的应用效果。 该项研究共纳入了22 例患者,经DFPP 治疗后, 患者体内免疫球蛋白水平明显降低(P < 0.05),而白蛋白、纤维蛋白原和血红蛋白等均无明显变化[25]。 另有研究显示DFPP 和PE 在治疗效果上无明显差异,而DFPP 组不良事件发生率(3.33%)显著低于PE 组(14.29%,P=0.03)[26]。
与PE 相比,DFPP 有着更低的不良反应发生率,同时可以明显降低血浆使用量,缓解血液资源紧张的现状,所以DFPP 有更广阔的临床应用前景。 但是截至目前尚无研究证明DFPP 可以改变MM 患者的预后,且昂贵的治疗费用也限制了该技术的临床开展。
3 小结
RI 是MM 常见的并发症, 治疗的关键是及时降低血液中FLC 和异常免疫球蛋白的浓度, 减少肾脏的暴露。新型化疗药物联合血液净化可以快速降低血清中的FLC, 有望进一步改善MM 患者的预后。HCO-HD 在清除FLC 方面有明显优势, 在诊疗指南中也有更高的推荐等级[4],但在改善MM 患者肾功能预后和远期生存方面优势不显著。MM 并发高黏滞血症是PE 的明确适应证。 SUPRA-HFR 和DFPP 是两种改进后血液净化方式,可以显著减少治疗过程中患者白蛋白的丢失,应用前景广阔。 但这两项血液净化方式应用于治疗MM 的研究尚不充分, 需要更多试验探索。

