右美托咪定介导GDNF表达对脑损伤大鼠神经元突触损伤及肺功能保护机制
段彩萍 白江华 郝彬洁 韩云志 都义日
(鄂尔多斯市中心医院,内蒙古 鄂尔多斯 017000)
创伤性脑损伤(TBI)的发病率、死亡率均较高,该病患者常出现恶心、呕吐等症状,严重者会产生运动障碍〔1〕。胶质细胞源性神经营养因子(GDNF)由M2型小胶质细胞(MG)分泌,可促进神经元再生,具有神经保护作用〔2〕。研究表明,GDNF在帕金森病〔3〕、神经病理性疼痛〔4〕等多种神经性疾病中均具有重要作用。在脑缺血再灌注中,通过促进GDNF的表达发挥神经保护作用〔5〕。在脑损伤中,肺损伤是其常见的并发症。目前认为〔6〕,脑损伤继发肺损伤与肺内过度炎症反应导致肺血管及上皮细胞凋亡有关。中性粒细胞弹性蛋白酶(NE)的破坏性较大,是引起肺损伤的重要介质之一。目前对于治疗TBI的神经保护类药物较少,寻找促进神经元存活的药物对治疗TBI至关重要。右美托咪定(Dex)除具有抗炎作用外,还可改善神经元损伤。多项研究证实,其在脑出血〔7〕、脑卒中〔8〕等脑神经疾病中具有神经保护作用,另外,Dex还可减少由炎症反应及氧化应激导致的细胞凋亡。但Dex对脑损伤神经功能等的具体作用机制尚未完全掌握,因此,本研究Dex介导GDNF表达对脑损伤大鼠神经元突触损伤及肺功能保护机制。
1 材料和方法
1.1实验动物 75只雄性SPF级SD大鼠购自常州卡文斯实验动物有限公司〔许可证号:SCXK(苏)2021-0102〕,鼠龄6~8 w,体质量200~300 g,适应饲养1 w后进行实验。本实验已通过医院动物伦理委员会审批(批号:20190327)。
1.2实验试剂 TUNEL工作液(武汉普健生物科技有限公司,货号:ATK00001),NE、白细胞介素(IL)-8试剂盒(上海经科化学科技有限公司,货号分别为SND-R812、CHM-009),苏木素-伊红(HE)染色液(金华力升实验器材有限公司,货号:002),突触蛋白(SYN)1、脑源性神经营养因子(BDNF)一抗(上海沪震实业有限公司,货号:hz883Ra21),辣根过氧化物酶二抗(北京博尔西科技有限公司,货号:BHR112)。
1.3模型建立及干预 75只大鼠中随机抽取15只作为健康组进行对照,剩余大鼠根据文献〔9〕建立TBI模型:运用撞针撞击左侧脑皮层顶叶(3.5 mm/s,深2 mm),留针0.4 s,止血,封闭颅骨,缝合皮肤。以神经功能缺损评分为1~3分为建模成功。将模型大鼠随机分为模型组、Dex组、GDNF组及联合组,各组15只。健康组与模型组常规饲养,无任何处理;Dex 组于腹腔注射Dex 100 μg/kg;GDNF组于髓鞘注射2 μg GDNF ,1次/2 d,共2 w;联合组在Dex组治疗的基础上给予GDNF组治疗。
1.4检测指标
1.4.1检测Dex对各组神经功能缺损的影响 各组干预24 h、48 h、72 h后根据文献〔10〕检测神经功能缺损(mNSS) 状况,主要由运动、感觉、反射测试构成,共18分,分值越高神经功能损伤越严重。
1.4.2Morris 水迷宫试验评估Dex对各组认知功能的影响 空间学习能力:干预完毕后4次/d进行定位航行,将大鼠随机放入水迷宫中,在大鼠找到平台或航行120 s未找到平台时结束,计算到达平台的平均航行时间(逃避潜伏期),时间越长认知越差。空间探索:将水迷宫中平台去除,水池中随机位置放入大鼠,航行1 min,记录穿越平台次数,共2次,取均值。
1.4.3酶联免疫吸附试验(ELISA)检测Dex对各组肺损伤相关因子NE、白细胞介素(IL)-8水平表达的影响 支气管肺泡灌洗液中NE、IL-8含量测定参照文献〔11〕进行,从各组大鼠体内取支气管肺泡灌洗液5~6 ml,采用ELISA检测NE、IL-8水平,实验按照说明书进行。
1.4.4HE染色观察Dex对各组肺组织及脑组织病理形态的影响 取各组麻醉后处死,去除脑、肺组织,甲醛固定,自来水冲洗,脱蜡、包埋、切片。将各组肺、脑组织切片放入37 ℃复温15 min,脱蜡、脱水后苏木素染色10 min,盐酸(1%)处理,伊红复染,脱水,封片,观察组织形态。
1.4.5TUNEL检测Dex对各组脑组织神经细胞凋亡情的影响 取各组脑组织,石蜡切片脱蜡,磷酸盐缓冲液(PBS)冲洗,加入TUNEL检测液45 μl孵育1 h,PBS清洗,每张切片随机选5个视野,计算凋亡率。细胞凋亡率(%)=凋亡细胞总数/(凋亡细胞总数+正常细胞总数)×100%。
1.4.6免疫印迹检测Dex对各组SYN1、BDNF蛋白表达的影响 取各组脑组织,剪碎、裂解,离心后取上清,二喹啉甲酸(BCA)法测定蛋白浓度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转于PVDF膜上,脱脂奶粉封闭2 h后分别加入脱脂牛奶配制SYN1、BDNF一抗(1∶1 000)孵育过夜,加入辣根过氧化物酶二抗(1∶2 000)孵育1 h,PBS清洗,用化学发光液孵育 3 min 后曝光。应用 Image Pro Plus6.0(Media Cybernetics)软件分析结果。
1.5统计学分析 采用GraphPad Prism8.0软件进行方差分析、t检验,多组内两两对比采用SNK-q法。
2 结 果
2.1Dex对各组神经功能缺损的影响 模型组不同时间mNSS评分明显高于Dex组、GDNF组、联合组(P<0.05),Dex组与GDNF组上述指标差异无统计学意义(P>0.05),联合组不同时间mNSS评分明显低于Dex组、GDNF组(P<0.05),见表1。
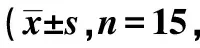
表1 各组mNSS评分对比分)
2.2Dex对各组认知功能的影响 与健康组相比,模型组逃避潜伏期明显增加,穿越平台次数明显减少(P<0.05);与模型组相比,Dex组、GDNF组、联合组逃避潜伏期明显缩短,穿越平台次数明显增加(P<0.05),Dex组、GDNF组各指标对比差异无统计学意义(P>0.05),与Dex组、GDNF组相比,联合组逃避潜伏期明显缩短,穿越平台次数明显增加(P<0.05),见表2。
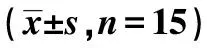
表2 各组水迷宫实验指标水平对比
2.3Dex对各组肺损伤相关因子NE、IL-8水平表达的影响 健康组NE、IL-8水平明显低于模型组(P<0.05),模型组NE、IL-8水平明显高于Dex组、GDNF组、联合组(P<0.05),Dex组、GDNF组各指标水平对比差异无统计学意义(P>0.05),Dex组、GDNF组NE、IL-8水平明显高于联合组(P<0.05),见表3。
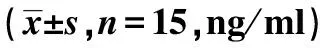
表3 各组肺损伤相关因子NE、IL-8水平对比
2.4Dex对各组肺组织及脑组织病理形态的影响 肺组织:健康组肺组织正常;模型组可见肺泡腔及细支气管内中性粒细胞和纤维蛋白渗出,肺泡隔增宽,肺泡萎陷,肺泡壁破裂,肺泡腔融合;与模型组肺组织相比,Dex组、GDNF组及联合组肺组织均有所改善,且以联合组效果最为显著。脑组织:健康组脑组织正常;模型组脑组织发生水肿,神经元细胞核固缩;与模型组肺组织相比,Dex组、GDNF组及联合组脑组织均有所改善,且以联合组效果最为显著,见图1。
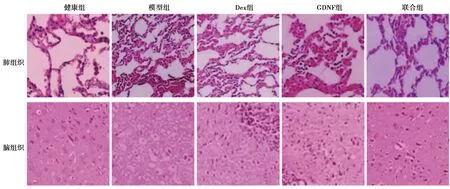
图1 各组肺组织及脑组织病理形态(HE染色,×200)
2.5Dex对各组脑组织神经细胞凋亡的影响 健康组脑组织细神经细胞凋亡率〔(6.56±1.25)%〕明显低于模型组〔(63.28±12.05)%,P<0.05〕,模型组细胞凋亡率明显高于Dex组、GDNF组及联合组〔(39.52±8.29)%、(39.56±8.32)%、(20.11±3.59)%,P<0.05〕,Dex组、GDNF组细胞凋亡率对比差异无统计学意义(P>0.05),联合组细胞凋亡率明显低于Dex组、GDNF组(P<0.05),见图2。

图2 各组神经细胞凋亡对比(TUNEL染色,×200)
2.6Dex对各组SYN1、BDNF蛋白表达的影响 健康组SYN1、BDNF表达明显高于模型组(P<0.05),模型组SYN1、BDNF表达明显低于Dex组、GDNF组及联合组(均P<0.05),Dex组、GDNF组各指标对比差异无统计学意义(P>0.05),联合组SYN1、BDNF表达明显高于Dex组、GDNF组(P<0.05),见图3、表4。
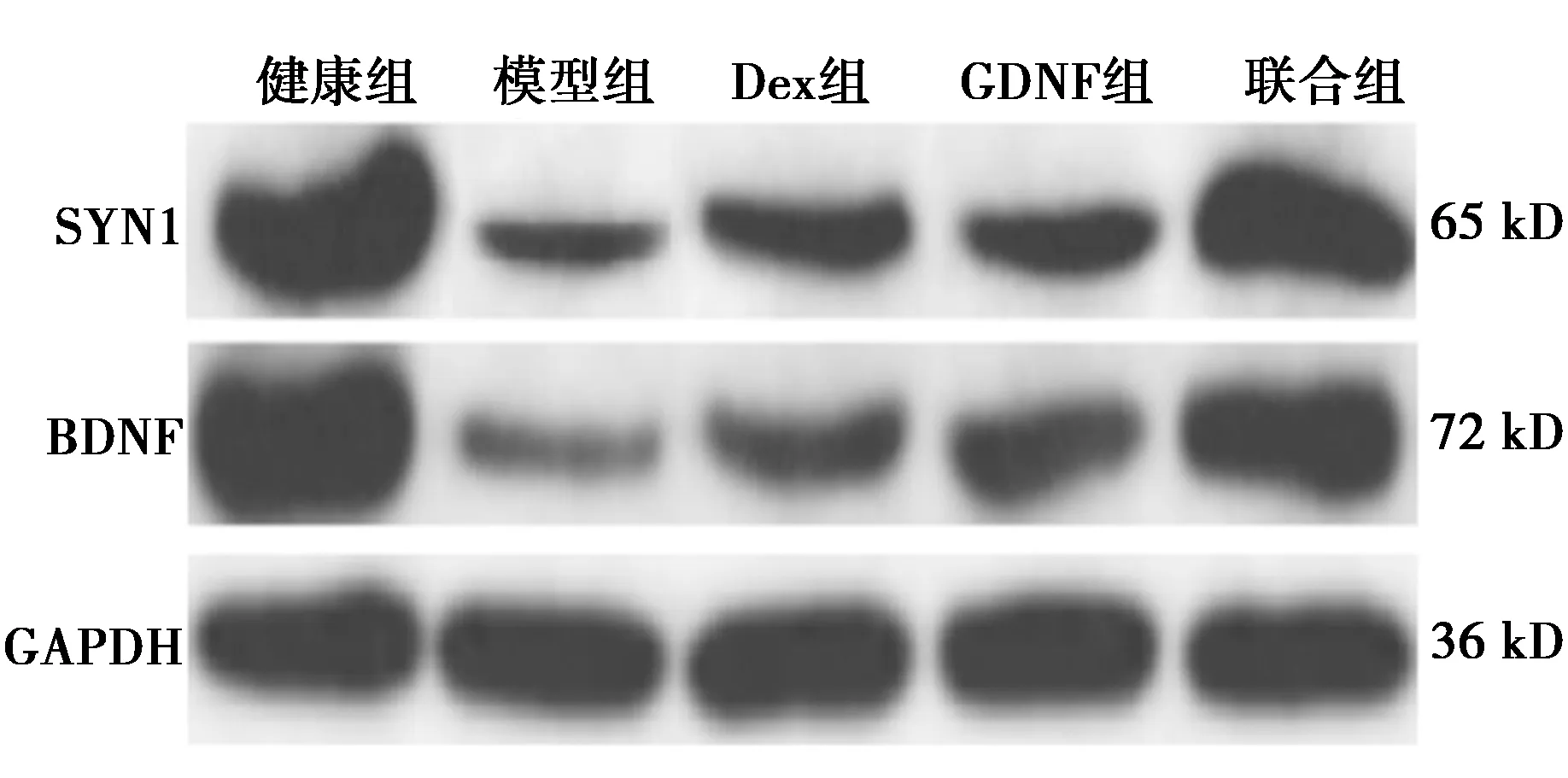
图3 Dex对各组SYN1、BDNF蛋白表达的影响
表4 Dex 对各组SYN1、BDNF蛋白表达的影响
3 讨 论
MG在中枢神经系统免疫防御中发挥着主要的免疫识别作用,对脑内微环境的维持和调节具有掌控作用。MG主要通过分泌BDNF、GDNF 发挥神经保护作用。研究发现〔12〕,GDNF成熟后在中枢神经系统的神经元、胼胝体、丘脑、小脑、海马等中存在表达。GDNF可特异促进神经元生存,并对感觉/交感神经元具有保护作用。体外研究中〔13〕,在神经细胞混合培养中发现,若神经元在受到伤害性刺激后未死亡,接触MG 后,通过促进GDNF的表达可促进神经元恢复。Yuan等〔14〕在运用电针干预缺血再灌注脑损伤大鼠的实验中提出,通过调控TLR2/NF-κB通路,从而持续升高GDNF水平,改善神经功能缺损,发挥脑保护作用。以上研究提示GNDF水平与神经保护联系密切。多项研究已经证实〔15,16〕,Dex对脑损伤的治疗及神经保护的作用。陈金权等〔17〕提示,Dex可通过调控micoRNA-329-3p/CREB/IL-1RA通路恢复神经功能损伤及认知功能障碍,从而发挥脑保护的作用。另外,其还具有抑制全麻药诱导的海马神经元细胞凋亡,促进神经元存活的作用。曹艳等〔18〕在对创伤性脑损伤大鼠的实验研究中提出,Dex可通过调控SIRT1通路抑制神经细胞的凋亡,从而减轻脑创伤后的继发性损害。本研究提示,Dex可通过调控GDNF水平,发挥脑保护作用。
BDNF主要存在于脑皮质、海马区等,可促进神经系统生长发育,促进神经元突触形成、重塑,通过多种途径减少神经元凋亡,是一种神经营养因子,还可促进神经元的生长。SYN1水平增加可镀金突触传到、连接等,可恢复神经功能,其还参与神经递质的传递释放过程〔19〕。此外,SYN1是BDNF的下游因子,BDNF能够促进SYN1含量增加,促进突触重塑,恢复神经功能。在王冬慧等〔20〕对放射性脑损伤大鼠的实验研究中运用电针进行干预后发现,通过调控Notch通路,促进SYN1、BDNF及突触后致密蛋白95表达增加,修复了神经突触损伤,提高了小鼠的学习记忆能力,从而改善脑损伤。在本研究结果提示,Dex通过促进BDNF、SYN1表达,修复损伤的神经突触,保护神经功能,此外,本文神经功能缺损评分及认知功能结果也可证实上述结论。
颅脑损伤后由于昏迷、呕吐等易发生口咽分泌物等误吸入呼吸道,使得肺部受到感染,产生急性肺损伤,严重者会演变为呼吸窘迫综合征。NE可降解多种蛋白(胶原蛋白、肺泡表面蛋白等),诱导炎性介质产生,上调细胞因子、黏附分子的表达,促进黏液分泌等功能,因此,被称为急性肺损伤的终极效应因子。IL-8是氧自由基等产生的重要介质,是炎性因子之一,可趋化粒细胞进入炎症区域。因此,肺内IL-8的增加在一定程度上反映了肺内炎症反应和炎性损伤的程度。NE可促进IL-8的表达增加炎症反应,IL-8可激活中性粒细胞从而增加NE含量,形成炎症反应恶性循环,加重肺损伤。Dex具有抑制炎症反应的作用。本研究结果提示,Dex干预后可通过降低IL-8、NE水平,减少肺部感染,预防呼吸窘迫综合征的产生。
综上,Dex通过促进GDNF表达,从而修复神经元突触损伤,抑制神经元细胞凋亡,改善肺功能及认知功能,发挥脑保护及肺保护的作用。

