宫腔镜下清宫术对剖宫产术后子宫瘢痕妊娠患者手术相关指标及并发症的影响
雷维利,李爱玲
洛阳市交通医院妇产科,河南 洛阳 471000
子宫瘢痕妊娠(cesarean scar pregnancy, CSP)是指既往有剖宫产史的女性,再次妊娠时孕囊着床于剖宫产切口瘢痕处,常伴有阴道流血、晚期子宫破裂等症状,属特殊类型的异位妊娠。近年来,随着剖宫产率的上升,CSP发生率亦随之升高[1]。由于瘢痕处纤维组织较多、肌壁薄弱,妊娠后发生并发症风险极高,严重威胁患者生命安全[2]。一旦确诊为CSP应及时终止妊娠,以保障患者身心健康及生命安全。若CSP处理不当,可导致患者大出血或子宫破裂而切除子宫,使患者永久性丧失生育能力[3]。目前,国内外尚无规范CSP的诊断及治疗指标或指南,本研究通过对比分析宫腔镜下清宫术与传统清宫术治疗CSP之间的优劣,探讨宫腔镜手术在CSP治疗中的作用。现将结果报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2020年9月洛阳市交通医院收治的92例CSP患者临床资料,按手术方式不同分为传统组(46 例)和宫腔镜组(46 例)。传统组年龄23~42 岁,平均年龄(31.46±2.82)岁;距上次剖宫产时间10个月~6 年,平均(2.63±0.51)年;停经时间36~78 d,平均停经时间(49.26±5.65)d;孕次:2 次14 例,3~4 次23例,5 次及以上9 例;血清人绒毛膜促性腺激素β亚单位(human chorionic gonadotrophin-β,β-HCG)值≤10 000 U/L 25 例,10 001~30 000 U/L 12 例,>30 000 U/L 9 例。宫腔镜组年龄22~41 岁,平均年龄(31.75±3.04)岁;距上次剖宫产时间9 个月~7 年,平均(2.74±0.49)年;停经时间35~76 d,平均停经时间(49.88±5.29)d;孕次:2 次12 例,3~4 次24 例,5 次及以上10 例;血清β-HCG值≤10 000 U/L 27 例,10 001~30 000 U/L 11 例,>30 000 U/L 8 例。两组患者一般资料具有可比性(P>0.05)。本研究经医院伦理委员会审批。
1.2 入选标准
(1)纳入标准:符合《剖宫产术后子宫瘢痕妊娠诊治专家共识》[4]中Ⅱ型CSP 诊断标准,并经术前三维彩超、术后切除病灶送病理检查确诊为CSP;血流动力学稳定;妊娠时间≤12周;签署知情同意书。(2)排除标准:阴道大量出血;宫颈、宫角或其他部位异位妊娠,以及复合妊娠;严重内科疾病;凝血功能障碍;精神异常者。
1.3 方法
两组患者术前均口服米非司酮25 mg,12 h/次,共3 d,单次肌注甲氨蝶呤150 mg,3 d后行清宫术,均行静脉麻醉。传统组行传统清宫术:患者取膀胱截石位,常规消毒铺巾,在腹部B超引导下清除残留妊娠组织病灶,术中预计出血量≥400 mL 时,采用Foley 氏尿管压迫止血;术中预计出血量≥800 mL时,及时改为腹腔镜或开放手术止血。宫腔镜组行宫腔镜下清宫术:患者取膀胱截石位,常规消毒铺巾外阴、阴道、宫颈部位,宫颈扩张至7~12号,阴道消毒后将宫腔镜直视下推进宫腔内,观察宫腔内肌壁、宫底、宫角、宫颈内口及妊娠残留组织位置、大小、瘢痕厚度等,宫腔镜下完整切除残留妊娠组织病灶,最后用电切环充分电凝止血。切除病灶时动作轻柔、仔细,为避免穿孔造成附带损伤,有时不能完全切净病灶。术中出血量过多,预计≥400 mL时及时转腹腔镜或开腹手术。术后给予缩宫素、抗感染治疗。
1.4 观察指标
比较两组患者手术成功率、手术情况、术后临床指标、满意度及并发症情况。(1)手术成功率。手术成功:宫腔内残留妊娠组织完全切除,术后未出现阴道异常流血;手术失败:不能完全切除宫腔内残留妊娠组织,改变原定手术方式。(2)手术情况:记录两组患者术中出血量、手术时间。(3)术后临床指标:统计两组患者血清β-HCG 恢复至正常水平(复查2 个月,每周复查血清β-HCG)、月经恢复至正常及住院时间。(4)满意度:对比两组患者治疗满意度,采用我院自制满意度调查表进行评价,其Cronbach’sα系数为0.852,重测效度为0.862,包括操作技能、疾病预后等方面,不满意:≤60 分;满意:61~89 分;非常满意:≥90 分。满意度=(非常满意+满意)/总例数×100%。(5)并发症:密切观察两组患者术后阴道流血、血清β-HCG及感染情况。
1.5 统计学方法
采用SPSS 20.0软件进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验。计数资料以例数和百分比(%)表示,组间比较采用χ2检验,等级资料采用Z检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者手术成功及手术情况
宫腔镜组手术成功率高于传统组,术中出血量少于传统组,手术时间短于传统组,差异有统计学意义(P<0.05),见表1。

表1 两组患者手术成功及手术情况例(%)
2.2 两组患者术后临床指标情况
宫腔镜组血清β-HCG 恢复至正常水平、月经恢复至正常及住院时间均短于传统组,差异有统计学意义(P<0.05),见表2。
表2 两组患者术后临床指标情况(±s)d

表2 两组患者术后临床指标情况(±s)d
组别传统组(n=46)宫腔镜组(n=46)t值P值血清β-HCG恢复至正常水平时间30.42±6.89 18.45±4.52 9.852<0.05月经恢复至正常时间39.26±5.85 30.94±3.21 8.457<0.05住院时间5.24±1.65 3.35±0.73 7.105<0.05
2.3 两组患者满意度情况
宫腔镜组满意度高于传统组,差异有统计学意义(P<0.05),见表3。
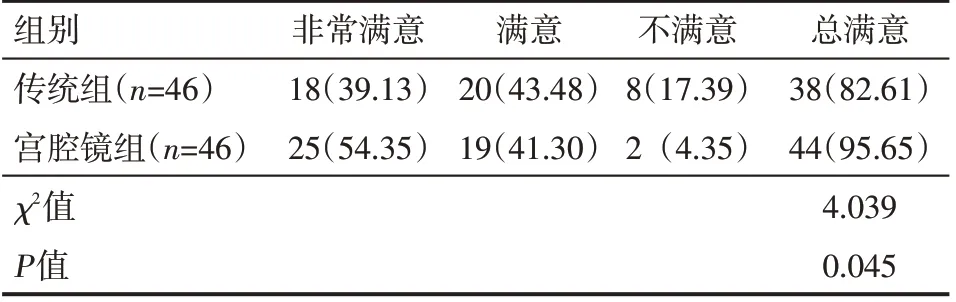
表3 两组患者满意度情况例(%)
2.4 两组患者并发症发生情况
传统组有2 例阴道流血时间超过1 个月,经再次治疗恢复正常,两组患者均未发生大出血、感染等并发症。
3 讨论
CSP通常发生于剖宫产术后较长时间内,属于相隔时间较长的术后并发症,临床常表现为瘢痕处纤维组织增多,具体表现为瘢痕处子宫壁薄弱,妊娠后极易出现大出血、子宫破裂等不良后果。相关调查显示,剖宫产术后CSP的发病率低于0.5%,在有剖宫产经历的异位妊娠患者中的发生率在6%以上。目前,CSP发病机制尚不清楚,多数研究认为其可能与子宫瘢痕处内膜、肌层破坏及瘢痕愈合不良有关,会导致子宫破裂、大出血等严重并发症,危害患者生命健康[5-6]。及时开展有效的终止妊娠治疗是当前临床治疗关键。清宫术是早期人工流产最为常见的方法,但传统清宫术难以准确定位病灶区域,损伤宫腔面积较大,同时不能彻底清除残留绒毛组织,术后并发症风险较高[7]。
宫腔镜手术优势在于更精准且安全,将其应用于人工流产中,能够在明确病灶位置、形态的情况下,安全、彻底地清除妊娠组织,减少并发症。但宫腔镜也存在一定局限,若术中出血过多,宫腔镜操作视野受到影响将阻碍手术操作,且宫腔镜无法修补瘢痕,对于CSP患者,应根据其实际情况决定治疗方案。CSP临床分型主要为Ⅰ型、Ⅱ型、Ⅲ型,其中Ⅰ型为内生型,孕囊部分着床于瘢痕处,瘢痕厚度>3 cm,可采用B超或宫腔镜下清宫术;Ⅲ型为外生型,出血风险高,术前需预防性使用子宫动脉栓塞术;而Ⅱ型治疗方案较多,包括阴式、开腹、宫腔镜手术及清宫术等[8]。洪菱等[9]研究显示,腹腔镜下子宫瘢痕妊娠切除术+宫腔镜下探查术治疗Ⅱ型和Ⅲ型CSP 相较于子宫动脉栓塞术后行宫腔镜下清宫术、阴式手术局部切除术安全性更高。本研究结果说明,宫腔镜下清宫术治疗CSP较传统清宫术治疗成功率更高,术中出血量少,手术时间短,术后恢复效果佳,与上述研究结果存在一致性。相较于传统清宫术,宫腔镜下清宫术可在直视下扫刮病灶部位,反复镜检妊娠组织情况,彻底清除病灶包块,对周围组织及血管损伤小,避免发生子宫穿孔,从而提高1次手术成功率,使患者术后血清β-HCG 水平及月经尽快恢复正常。与Foley 氏尿管压迫止血相比,电凝止血可大大减少术中出血量,减少术后阴道出血,降低手术对患者的损伤,患者病情恢复更快。对于局部妊娠组织包块过大,同时向宫腔及腹腔突出,以及子宫肌层较薄者,不能1次将病灶切除,可追加1 次药物治疗,再行宫腔镜切除治疗。传统组中有2例患者因术中预计出血量>800 mL而转为开腹手术,分析发现该2例患者术前血清β-HCG>30 000 U/L。既往研究表明,患者血清β-HCG 水平越高,则出血风险越高[10]。本研究术中证实该2例患者妊娠残留组织周围血运更为丰富,因此对于β-HCG 高、妊娠组织周围血运丰富的CSP 患者应慎重选择传统清宫术。本研究结果显示,宫腔镜组满意度高于传统组,说明宫腔镜下清宫术治疗CSP 的效果显著,有利于促进术后恢复,患者满意度较高。相较于传统清宫,宫腔镜下清宫术具有更佳的安全性与微创性,利于减轻清宫术对患者造成的损伤,且获得理想的治疗效果,患者满意度较高。但本研究中研究样本总量较少,且观察时间较短,可能对研究结果的可信度及准确性造成一定的影响,后续研究中应增加纳入样本量,延长观察时间,以深入分析宫腔镜下清宫术对CGP患者远期预后的影响,以为临床提供更为客观、可靠的指导。
综上所述,宫腔镜下清宫术治疗CSP创伤小、手术时间短、术后恢复快,并发症少,患者满意度较高。

