儿童支气管肺炎并发继发性血小板增多症的临床分析
侯俏珍 何丽雅 曹晓均 韦晓燕 曾华松
广州市妇女儿童医疗中心,广州 510000
外周血血小板计数(BPC)>450×109∕L称为血小板增多,根据BPC 的多少,血小板增多分为以下4 类:轻度增多,BPC >500~700×109∕L;中度增多,BPC >700~900×109∕L;重度增多,BPC >900×109∕L;极重度增多,BPC >1 000×109∕L[1]。
临床资料
1.一般资料
探讨2020 年1 月至2021 年12 月广州市妇女儿童医疗中心收治的支气管肺炎并发继发性血小板增多症77 例,其中男48例,女性29例;年龄1个月~6岁,年龄小于1岁的有52例,1~3岁的8例,大于3岁的17例。
2.方法
对所选病例资料进行回顾性分析,内容包括性别、年龄、病原体、白细胞、血红蛋白、C 反应蛋白、血小板、并发症、住院时间等。
血小板参数分析采用希森美康XE-2100和XE-5000全自动血细胞分析仪进行相关参数分析。C 反应蛋白采用日立7600全自动分析仪检测。
结果
1.血小板相关参数与肺炎病情发展的分析
本资料显示男48例,女性29例。经门诊治疗痊愈的有20 例,留院观察治疗的有3 例,住院治疗的有54 例。16 例诊断为重症肺炎,其中10 例住院时间大于2 周,3 例合并化脓性脑膜炎。77 例肺炎并发继发性血小板增多症患儿中,轻度增多9 例,中度增多12 例,重度增多13 例,极重度增多43例。
所有患儿预后好,全部治愈,无死亡病例。
重症肺炎患儿16 例,其中12 例BPC >900×109∕L,提示血小板增多和重症肺炎的发生相关。
支气管肺炎并发继发性血小板增多症77 例,54 例合并白细胞增高,25 例出现C 反应蛋白增高,病毒感染29 例,支原体感染7 例,提示细菌、病毒、支原体感染均可引起继发性血小板增多。
支气管肺炎并发继发性血小板增多症患儿中,有35 例血红蛋白低于100 g∕L,提示该次样本中患儿血红蛋白量明显低于正常儿童。
2.病原检测结果
本资料显示,腺病毒、呼吸道合胞病毒、支原体为支气管肺炎合并血小板增多的前三位病原,见表1。
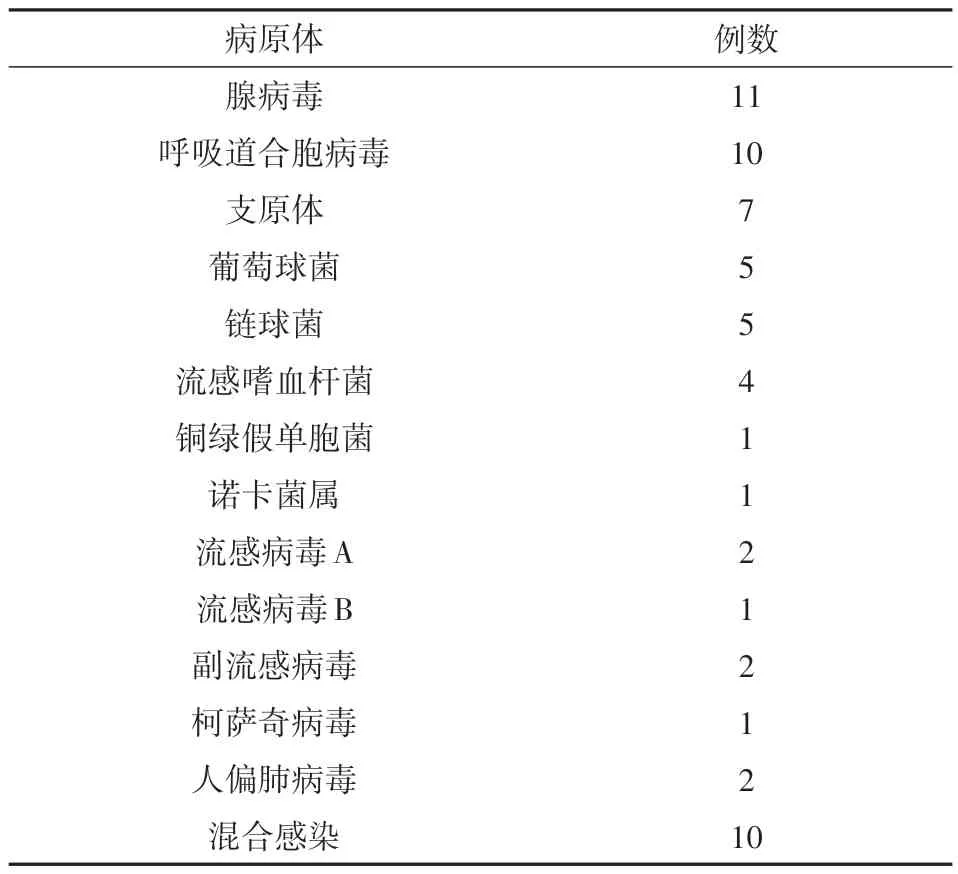
表1 77例肺炎并发继发性血小板增多症患儿的病原检测结果
77 例患儿中,诊断重症肺炎有16 例,重症肺炎患儿前两位病原为腺病毒、支原体,此外,呼吸道合胞病毒和流感嗜血杆菌并列第3。诊断重症肺炎的标准参考《儿童社区获得性肺炎管理指南》[2]。
3.预后
患儿继发性血小板增多症都随着肺炎的痊愈而逐渐好转并恢复到正常水平,无一例患儿出现血栓形成症状。
讨论
继发性血小板增多症常见原因为出血、感染、组织损伤、脾脏切除术后、恶性肿瘤、缺铁等[3],常见于3 岁以下的小儿。继发性血小板增多症绝大部分具有良好的预后,文献报道继发性血小板增多症具有自限性、血栓形成风险低的特点,血小板增多通常是潜在疾病的延续,不会导致血栓并发症[4]。只需针对原发病治疗,一般不需常规抗血小板治疗。本资料结果与之相似,继发性血小板增多症可随原发病的好转而恢复正常。77 例肺炎全部治愈,无一例患儿出现血栓形成症状。
血小板在凝血和先天性免疫中都起着重要作用[5]。众所周知,血小板与止血和凝血功能有关,Varon 和Shai[6]提出,血小板除了在止血中发挥关键作用外,还涉及免疫反应、炎症、血管生成、组织再生和癌症转移等多种病理生理反应。血小板越来越被认为是免疫细胞,能够与病原体相互作用,并杀死病原体。血小板在针对细菌和病毒感染的炎症和先天免疫反应中起着关键作用,包括与病原体和其他免疫细胞的直接和间接相互作用[7]。
Thomas 和Storey[8]报道P-选择素介导血小板与白细胞形成聚合,与单核细胞、中性粒细胞、淋巴细胞和内皮细胞相互作用,参与炎症的起始并维持炎症状态。Rondina 和Garraud[9]报道血小板的功能,包括免疫调节剂的分泌、内皮细胞的相互作用、单核细胞和中性粒细胞、Toll 样受体(TLR)介导反应、嗜中性粒细胞细胞外陷形成、桥血栓和炎症途径的诱导,为宿主抵御病原体的防御机制提供了帮助。所以血小板是炎症和先天免疫反应和适应性免疫反应中的重要调节因子。
本次研究发现,细菌、病毒、支原体感染均可引起继发性血小板增多症,腺病毒、呼吸道合胞病毒、支原体为支气管肺炎合并血小板增多的前三位病原。
腺病毒感染致宿主免疫损伤,首先引起肺部血管内皮炎症性损伤,一是P-选择素表达增加,二是肺泡微血管内皮糖萼层被破坏,硫酸肝素被释放,导致系列凝血因子活化[10]。
呼吸道合胞病毒感染可引起气道纤毛和气道上皮细胞脱落,不只引起气道阻塞,还会让感觉神经末梢暴露,激活肥大细胞释放组胺、白三烯、白细胞介素(IL)-6、干扰素γ和前列腺素D2等活性物质,导致支气管平滑肌痉挛和气道高反应性[11]。
支原体黏附于宿主细胞后,合成过氧化氢,产生氧化应激反应;分泌毒素损伤呼吸道上皮;固有免疫和适应性免疫反应均在支原体感染的致病中发挥重要的作用[12]。
腺病毒感染、呼吸道合胞病毒感染、支原体感染致病机制有共同之处:(1)直接侵袭。细胞氧化损伤,呼吸道上皮细胞变性、线粒体肿胀,甚至细胞溶解坏死,细胞凋亡导致血小板增多。(2)细胞毒性损伤。血管内皮细胞是合成和释放血小板活化因子的主要细胞,肺毛细血管内皮损伤,会导致血小板活化因子释放增多,促使已增高的血小板聚集[13]。(3)免疫损害。血管内皮炎症性损伤,释放多种细胞因子和炎症介质,血小板活化增多,促进血小板生成;而且感染时,机体通过单核巨噬细胞系统激活生化免疫途径,血小板释放增加。(4)贫血。感染所介导的免疫紊乱导致红细胞破坏增多。
本研究资料显示,肺炎继发血小板增多患儿血红蛋白量明显低于正常儿童,患儿血红蛋白均值为101.7 g∕L,其中血红蛋白<100 g∕L 有35 例,考虑感染所介导的免疫紊乱导致红细胞破坏增多,活化的巨噬细胞介导靶细胞的凋亡,引起贫血。
支气管肺炎合并血小板增多是多种因素所致。肺部毛细血管是除骨髓外,巨核细胞∕血小板生成的一个重要场所[14],当肺部感染时,血管内皮炎症性损伤,细胞凋亡增多,血小板释放增加、分布改变。血小板生成素(TPO)及其受体C-MPL 是巨核细胞增殖分化和血小板生成的基本调节因子。血小板受到TPO、细胞因子及炎症介质等影响,造成血小板活化的失常[15]。TPO 除了作为造血生长因子,也可作为一种急性期反应蛋白,在炎症或应激状态时对机体产生保护作用[16]。血管内皮损伤、免疫细胞、炎症介质和缺氧以各种方式参与血小板的高反应性和聚集中去[17]。
血小板在宿主炎症和免疫反应的起始和调制过程中起核心作用。血小板和中性细胞的相互作用可以诱导释放嗜中性细胞(网),以应对细菌或病毒感染。血小板通过细胞外核苷酸代谢和信号转导调节、血小板-中性粒细胞复合物的形成,对缺血性炎性反应进行控制调节[18]。血小板衍生微泡,携带血小板的免疫调节分子、生长因子、凝血分子和可以调节受体细胞功能的miRNAs。血小板衍生微泡与血小板相互作用,通过NADPH 氧化酶NOX,诱导钙介导的细胞内活性氧产生,导致血小板活化[19]。多种细胞因子和炎症介质释放,血小板活化增多,最终导致血小板过度生成和分布改变。所以说,支气管肺炎患儿继发血小板增多,是多种因素刺激下,血小板增生及重新分布,参与炎性反应,清除病毒,控制感染。
本研究中发现,支气管肺炎并发血小板增多的患儿77例,年龄最大的6岁,年龄最小的1个月,年龄小的患儿居多,小于1岁有52例。考虑儿童体液免疫功能不完善,人类浆细胞样树突细胞在生命早期较弱,可能导致婴幼儿对严重病毒感染性疾病的易感性增加[20]。机体产生的免疫应答的程度随年龄不同而有所差异。
本研究重症肺炎患儿16 例,其中12 例重症肺炎患儿BPC >900×109∕L,表明血小板增多和重症肺炎相关,严重性肺炎发病及发展和炎性因子、机体免疫有很大关系。血小板增多一般见于肺炎急性期,后随着炎症恢复BPC 逐渐下降。因本次资料样本量不大,BPC 是否可用来预测疾病的严重程度,有待更进一步的研究观察。
利益冲突所有作者均声明不存在利益冲突

