稳定表达猪δ 冠状病毒S1 蛋白CHO 细胞系的构建与鉴定
孙雪珂,丁培阳,王思桥,刘思源,李明慧,常泽杰,陈艺兰,李瑞琪,张改平,4
(1.河南农业大学 生命科学学院,河南 郑州 450002;2.河南省农业科学院 动物免疫学重点实验室,河南 郑州450002;3.郑州大学 生命科学学院,河南 郑州 450001;4.江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009)
猪 δ 冠 状 病 毒(Procine deltacoronavirus,PDCoV)是近年来新发现的可引起猪肠道疾病的冠状病毒。2012 年在中国香港首次检测到PDCoV[1],之后于2014年在美国俄亥俄州大范围传播开来,继而在加拿大、日本、韩国等多个国家发现该病毒的存在[2],给全球养猪业带来了巨大经济影响。PDCoV 可感染不同年龄段的猪,仔猪更易感染,临床症状主要表现为急性腹泻、呕吐和脱水,严重时出现死亡,常与传染性胃肠炎病毒(TGEV)、流行性腹泻病毒(PEDV)共感染,新生仔猪致死率可达30%~40%[3]。除 猪 外,在 鸡[4]、牛[5]中 也 发 现 了PDCoV。LEDNICKY 等[6]在海地发现3 名儿童感染了PDCoV,且研究发现人肠上皮细胞(HIECs)感染PDCoV 反应比猪肠上皮细胞(IPEC-J2)更明显。JI等[7]研究发现,与猪源氨基肽酶N 受体相比,PDCoV S 蛋白与人源氨基肽酶N 受体的结合亲和力更高。以上研究结果提示,PDCoV 存在跨物种传播的可能。PDCoV 对人类和动物健康构成的威胁,引发人们对这一新兴病毒的关注,同时也表明研发PDCoV疫苗的迫切性。
PDCoV 是冠状病毒科δ 冠状病毒属成员,是一种具有囊膜、不分节段的单股正链RNA 病毒[8-9]。基因组大小约为25.4 kb,编码4 种结构蛋白、15 种非结构蛋白和3 种辅助蛋白[10-11]。编码4 种结构蛋白的基因位于基因组的3′端,依次为刺突蛋白(Spike protein,S)、包膜蛋白(Envelope protein,E)、膜蛋白(Membrane protein,M)和核衣壳蛋白(Nucleocapsid protein,N)[12]。其中S 蛋白以三聚体的形式分布于病毒表面,具有识别适当受体并促进病毒有效进入宿主细胞的能力,前人对冠状病毒的研究发现人畜共患病毒跨物种传播的关键在于S 蛋白[13]。此外,S蛋白还含有中和抗原表位,是诱导机体产生中和抗体的主要靶标[14]。S 蛋白由N 末端的S1 亚基和C末端的S2 亚基构成,前者负责识别并结合受体,后者介导病毒与宿主细胞的膜融合[15]。CHEN 等[16]研究发现,PDCoV S 蛋白中的免疫优势中和区位于S1亚基的C 末端结构域,受体结合域也位于S1 亚基上,表明S1 亚基具有良好的免疫原性,是疫苗研发的关键区域。
PDCoV 的S 蛋白是Ⅰ型跨膜糖蛋白,天然构象中拥有124 个磷酸化位点、18 个糖基化位点[17]。无论是对其生物学功能的研究还是获得具有良好活性的S1蛋白,尽可能还原糖蛋白结构十分必要。哺乳动物细胞系由于具有正确折叠、组装和翻译后修饰功能,是药物蛋白工业生产中重要的宿主细胞,中国仓鼠卵巢(CHO)细胞是目前广泛应用的哺乳动物细胞表达系统,CHO 细胞具有较高的培养密度并可以稳定表达外源蛋白[18],有利于进行大规模生产,且能够进行蛋白质翻译后的加工修饰,拥有完整的蛋白质糖基化修饰系统[19],表达的重组蛋白在结构、特性和生物学功能上都更接近其天然形态[20]。为此,利用CHO 细胞表达体系的优势,构建稳定高量表达PDCoV S1 蛋白的CHO 细胞系,并对重组S1蛋白进行纯化和生物活性鉴定,旨在为PDCoV 诊断试剂和疫苗的研发奠定基础。
1 材料和方法
1.1 质粒、细胞、血清及供试动物
经优化的PDCoVS1基因质粒由上海生工生物工程有限公司合成;CHO细胞、猪肾传代细胞PK-15由河南省农业科学院动物免疫学重点实验室保存;PDCoV 阳性血清由河南农业大学魏战勇教授馈赠;6~8 周龄BALB/c 小鼠购自郑州大学动物实验中心。
1.2 主要试剂
无内毒素质粒提取试剂盒购自康为世纪公司;CHO Fusion Medium、CHO Cloning Medium、CHO Fed Batch Medium 购自Sigma-Aldrich 公司;阴离子交换层析填料和凝胶过滤层析柱购自GE Healthcare 公司;蛋白质Marker 购自赛文创新生物科技有限公司;PAGE 凝胶快速制备试剂盒(10%)购自北京利德曼生化股份有限公司;5×SDS Loading Buffer、BCA 蛋白质浓度测定试剂盒购自碧云天生物技术有限公司;Alexa Fluor488标记山羊抗小鼠IgG购自ThermoFisher Scientific 公司;HRP 标记羊抗猪IgG、HRP 标记羊抗鼠IgG、ECL Plus 超敏发光液购自北京索莱宝公司。
1.3 重组表达载体pCGS3-S1的构建
根据NCBI GenBank 公布的PDCoV 流行株HNZK-02S基 因 序 列(GenBank 登 录 号:MH708123.1),结合CHO 密码子偏好性优化合成PDCoVS1基因序列,再连接到pCGS3 载体上,由上海生工生物工程有限公司测序验证。
1.4 稳定表达重组S1蛋白的CHO细胞系的建立
1.4.1 质粒的提取 将构建好的质粒转化至感受态细胞并进行测序验证,随后将阳性菌保种,存放于-80 ℃冰箱。阳性菌液按1∶1 000 比例接种至含1 mg/L 氨苄青霉素的LB 液体培养基中,于37 ℃、220 r/min 条件下培养过夜,按无内毒素质粒提取试剂盒说明提取质粒,并测定质粒质量浓度,保存于-80 ℃冰箱。
1.4.2 细胞系的构建 取处于对数生长期的CHO细 胞6.25×106个,离 心 后 用1 mL CHO Fusion Medium 重悬,取0.8 mL 细胞悬液与50 μg 质粒(经0.22 μm 滤器过滤)在EP 管中混匀,转移至提前预冷的电转杯中进行电转染。电转染后吸取电转杯中0.6 mL 液体至含5 mL CHO Fusion Medium 的T-25 cm2培养瓶中静置培养24 h。
1.4.3 细胞系的初筛 24 h后取适量T-25 cm2培养瓶中的细胞,按0.5×104个/孔的密度、200 μL/孔的培养基(80% CHO Cloning Medium+20% CHO Fusion Medium)铺至96 孔板中静置培养,待观察到细胞融合度达到80%时,按1∶4比例进行传代,同时取上清通过Dot blot 方法进行初步检测。将筛选出来较好的阳性孔转入24孔板,待细胞融合度达到80%时再转入T-25 cm2培养瓶,当活细胞密度(Viable cell density,VCD)高 于0.5×106个/mL 时 再 扩 大 至T-75 cm2培养瓶培养,同样VCD 高于0.5×106个/mL时再转至125 mL 的摇瓶培养,3 d后收集上清,进行Dot blot分析。
1.4.4 表达重组S1 蛋白的多克隆细胞系的筛选
取1 μL 待检测的细胞上清滴加于硝酸纤维素膜(NC 膜)上,用含5%脱脂奶粉的封闭液过夜封闭,将PDCoV 阳性血清1∶1 000 稀释后作为一抗,37 ℃孵 育1 h,PBST 洗4 次;将HRP 标 记 羊 抗 猪IgG 1∶2 000 稀释后作为二抗,37 ℃孵育1 h,PBST 洗4次,用凝胶成像系统进行显色,筛选与PDCoV 阳性血清反应良好的多克隆孔。
1.4.5 表达重组S1 蛋白的单克隆细胞系的筛选
根据125 mL摇瓶的筛选结果挑选多克隆细胞系,并进行亚克隆铺板,分别在7、14 d 观察细胞密度,当细胞为单克隆且融合度达到70%~100%时,进行Dot blot检测,挑选反应性强的单克隆细胞系继续按照1.4.3 的方法扩大培养,转入125 mL 摇瓶24 h 后,以0.3×106个/mL 的 密 度 扩 大 培 养30 mL,通 过Western blot 试验筛选表达重组S1 蛋白的单克隆细胞系。
1.4.6 重组S1 蛋白的表达及鉴定 待扩大培养的单克隆细胞系活率低于70%时,以12 000 r/min 离心10 min 收取上清,进行SDS-PAGE 和Western blot鉴定。取40 μL 的细胞上清,加入10 μL 5×SDS Loading Buffer,沸水煮10 min 后进行SDS-PAGE 电泳;采用湿转的方法转至聚偏二氟乙烯膜(PVDF膜),用含5%脱脂奶粉的封闭液过夜封闭,将PDCoV 猪阳性血清1∶1 000 稀释后作为一抗,37 ℃孵 育1 h,PBST 洗4 次;以HRP 标 记 羊 抗 猪IgG 1∶2 000 稀释后作为二抗,37 ℃孵育1 h,PBST 洗4次,用凝胶成像系统进行显色,观察重组S1蛋白表达情况。
1.4.7 1F4细胞系稳定性鉴定 将筛选出来的高量表达重组S1蛋白的1F4细胞系连续传代,选取第5、10、15、20 代的细胞上清,通过SDS-PAGE 试验对其稳定性进行鉴定。
1.5 重组S1蛋白的表达与纯化
将筛选出来的稳定表达PDCoV S1 蛋白的CHO细胞系扩大培养,并以0.3×106个/mL 的初始密度表达,分别在表达后3、5、7、9、11 d 补加葡萄糖(4 g/L)和CHO Fed Batch Medium(体积的5%),待细胞活率低于70%时,离心收取细胞上清,用0.22 μm 的滤器过滤。
用阴离子交换层析和凝胶过滤层析方法纯化目的蛋白。将上清用30 ku 的超滤膜包换液至缓冲液(20 mmol/L Tris-HCl,pH 值6.8)中,以1 mL/min的流速上样阴离子交换层析柱,分别用含有150 mmol/L NaCl、300 mmol/L NaCl、500 mmol/L NaCl、1 mol/L NaCl 的缓冲液进行洗脱。洗脱液用SDSPAGE 进行检测。将含目的蛋白的洗脱液用30 ku的浓缩超滤管浓缩至5 mL,再以1 mL/min 的流速上样凝胶过滤层析柱,待UV280值上升的时候收集流出液,收集的流出液进行SDS-PAGE 和Western blot鉴定。将纯化的重组S1 蛋白按照BCA 蛋白质浓度测定试剂盒说明书进行浓度测定,分装保存于-40 ℃冰箱。
1.6 重组S1蛋白的活性测定
采用间接ELISA 检测方法对重组S1 蛋白的活性进行鉴定。将纯化的重组S1 蛋白以100 ng/孔包被于酶标板,4 ℃过夜包被,PBST洗3次;用含5%脱脂奶粉的封闭液37 ℃封闭2 h;将PDCoV 猪阳性血清从1∶1 000 开始倍比稀释作为一抗,37 ℃孵育1 h,同时设置阴性对照(20 mmol/L Tris-HCl,pH 值6.8),PBST 洗3 次;以HRP 标记羊抗猪IgG 1∶2 000稀释后作为二抗,37 ℃孵育1 h,PBST 洗3 次;加入TMB 避光显色10 min,酶标仪测定OD450值,P(样品OD450值)/N(阴性对照OD450值)≥2.1 时的稀释倍数为有效稀释倍数。
1.7 重组S1蛋白的免疫原性测定
1.7.1 免疫程序 将纯化的重组S1 蛋白与等体积的弗氏完全佐剂乳化后以皮下多点注射方法进行第1 次免疫(20 μg/只)。首次免疫后14 d,将重组S1 蛋白与等体积弗氏不完全佐剂充分乳化进行第2次免疫(20 μg/只)。
1.7.2 小鼠血清效价测定 第2次免疫后7 d采血,按照1.6 中的步骤,利用间接ELISA 方法测定,分离的血清以1∶10 000开始连续2倍倍比稀释后作为一抗,进行测定。
1.7.3 免疫荧光(IFA)鉴定 PDCoV 感染PK-15 细胞36 h后,进行IFA检测,以未感染的PK-15细胞作为空白对照。用预冷甲醇固定30 min;1% BSA 于37 ℃封闭1 h;第2 次免疫后7 d 分离的血清作为一抗(1∶300 稀释),37 ℃孵育1 h;加入1∶500 稀释的Alexa Fluor488标记山羊抗小鼠IgG作为二抗,37 ℃孵育1 h;加入DAPI进行细胞核染色,通过荧光显微镜观察结果。
1.7.4 病毒中和试验 将第2 次免疫后7 d 的小鼠血清加热灭活,以50 μL/孔、1∶4开始在96孔板上作连续2 倍倍比稀释,随后与200 TCID50PDCoV 病毒液1∶1混合,37 ℃孵育1 h;将血清-病毒混合液加入提前接种PK-15细胞的96孔板中,37 ℃孵育1 h;弃掉病毒液,DMEM 培养液洗3 次;以100 μL/孔加入维持液,培养3~5 d,于显微镜下观察并记录细胞病变孔数,中和抗体效价以完全抑制病毒感染的血清稀释倍数的倒数表示。
2 结果与分析
2.1 稳定表达重组S1蛋白的CHO细胞系的建立
2.1.1 表达重组S1 蛋白的多克隆细胞系的筛选
当96 孔板中的细胞达到80%融合时取上清进行Dot blot 检测,结果(图1)显示,有21 个多克隆细胞系与PDCoV 阳性血清发生反应。选取较好的5 个株系扩大培养至125 mL 的摇瓶,培养3 d 后再次进行检测,结果(图2)显示,第1 株系反应最强。因此,选择第1株系进行单克隆细胞系的筛选。

图1 Dot blot筛选表达重组S1蛋白的阳性细胞系Fig.1 Dot blot screening of positive cell lines expressing recombinant S1 protein

图2 Dot blot筛选表达重组S1蛋白的多克隆细胞系Fig.2 Dot blot screening of polyclonal cell lines expressing recombinant S1 protein
2.1.2 表达重组S1 蛋白的单克隆细胞系的筛选
待亚克隆后的96 孔板细胞融合度达到80%时再次进行Dot blot检测,结果(图3)显示,有4株反应性良好的单克隆细胞系,将其扩大培养并表达。

图3 Dot blot筛选表达重组S1蛋白的单克隆细胞系Fig.3 Dot blot screening of monoclonal cell lines expressing recombinant S1 protein
2.1.3 重组S1 蛋白的表达及鉴定 将4 株单克隆细胞系的上清收集后进行检测,SDS-PAGE(图4A)和Western blot(图4B)结果显示,重组S1 蛋白在CHO 细胞中实现了分泌表达,条带大小约为75 ku,选择1F4 单克隆细胞系作为稳定表达重组S1 蛋白 的细胞系。
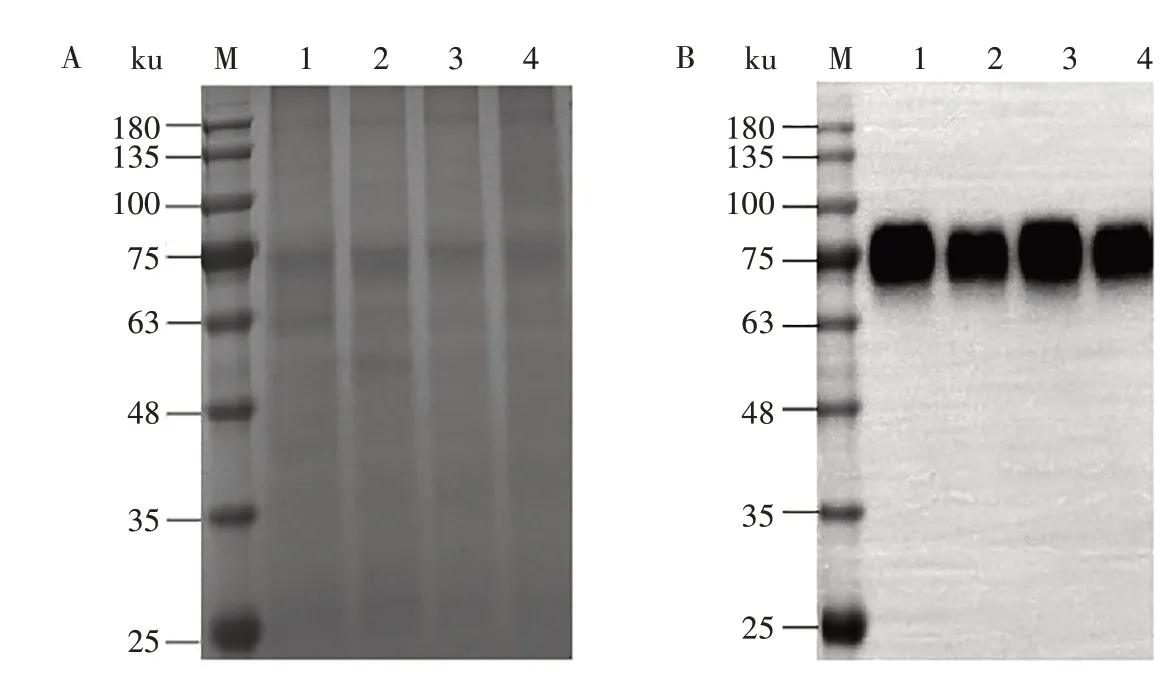
图4 重组S1蛋白的SDS-PAGE(A)和Western blot(B)分析Fig.4 SDS-PAGE(A)and Western blot(B)analysis of recombinant S1 protein
2.1.4 1F4细胞系稳定性鉴定 连续传代后将收集的 第5、10、15、20 代1F4 细 胞 系 上 清 进 行SDSPAGE 检测,结果(图5)显示,重组S1 蛋白在1F4 细胞系中稳定表达。
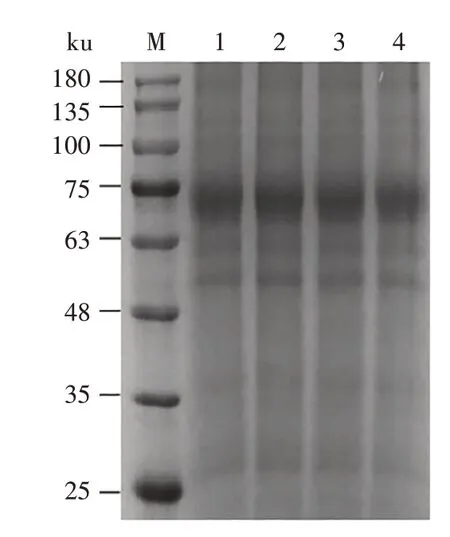
图5 表达重组S1蛋白的1F4细胞系稳定性分析Fig.5 Stability analysis of 1F4 cell line expressing recombinant S1 protein
2.2 重组S1蛋白的表达与纯化
收集1F4 细胞系表达后的细胞上清,先用阴离子交换层析柱进行纯化,经含不同盐离子浓度的溶液洗脱后,SDS-PAGE(图6)显示,S1 蛋白主要存在于含300 mmol/L NaCl的洗脱液中,表明阴离子交换层析方法起到了初步分离和富集的作用。再经凝胶过滤层析纯化后成功分离出目的蛋白(图7),SDS-PAGE(图8A)和Western blot(图8B)显示,成功得到纯度及浓度较高的重组S1蛋白。
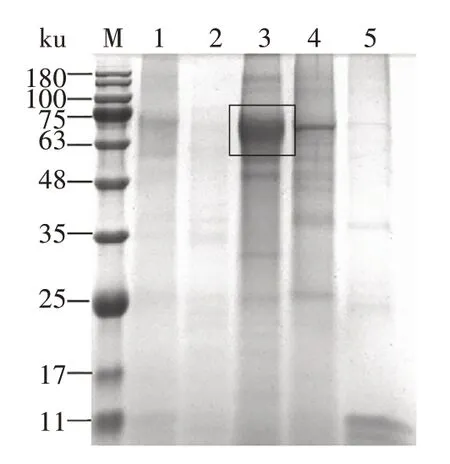
图6 阴离子交换层析纯化重组S1蛋白的SDS-PAGE分析Fig.6 SDS-PAGE analysis of recombinant S1 protein purified by anion exchange chromatography

图7 凝胶过滤层析纯化重组S1蛋白的洗脱图谱Fig.7 A representative elution chromatograph of recombinant S1 protein purified by gel filtration chromatography
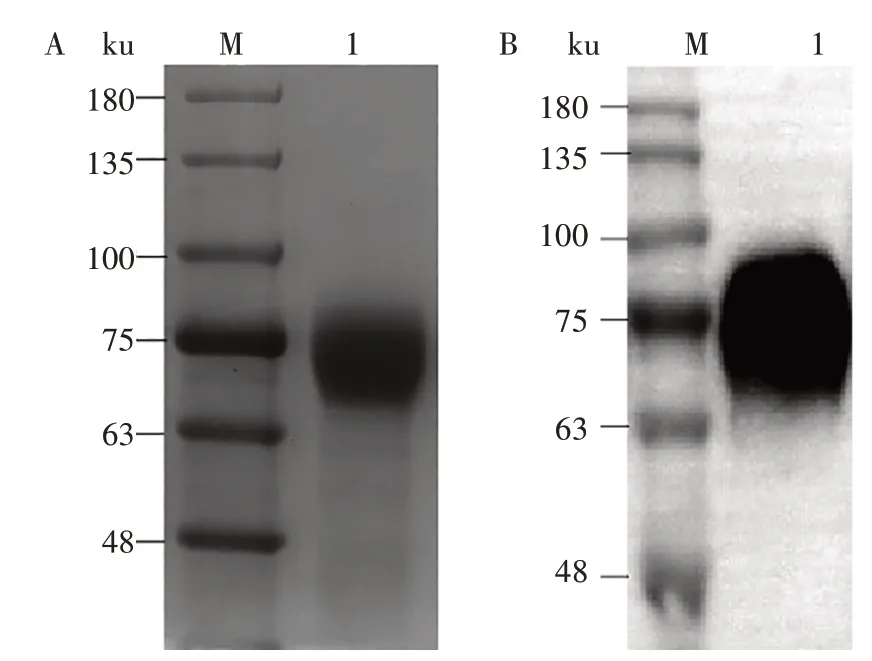
图8 凝胶过滤层析纯化重组S1蛋白的SDS-PAGE(A)和Western blot(B)分析Fig.8 SDS-PAGE(A)and Western blot(B)analysis of recombinant S1 protein purified by gel filtration chromatography
2.3 重组S1蛋白的活性测定
将纯化的重组S1蛋白进行间接ELISA 分析,结果(图9)显示,重组S1 蛋白能与1∶512 000 倍稀释的PDCoV 阳性血清发生反应,表明得到的S1 蛋白具有良好的生物活性。
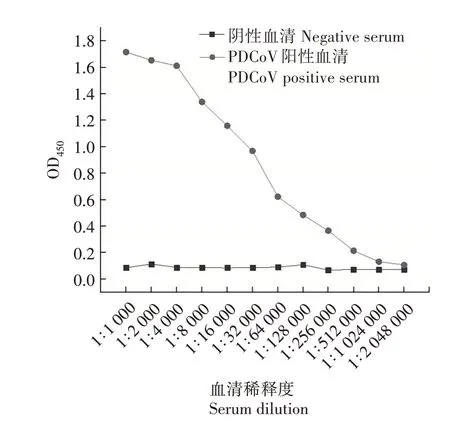
图9 间接ELISA检测重组S1蛋白活性Fig.9 Detection of recombinant S1 protein activity by indirect ELISA
2.4 重组S1蛋白的免疫原性测定
2.4.1 小鼠血清效价测定 第2 次免疫小鼠后7 d采集小鼠血清测定效价,结果如图10所示,4只小鼠免疫后均产生高水平的抗体,血清效价为1∶64 000。2.4.2 IFA 鉴定 选取2号小鼠血清进行IFA 检测,结果(图11)显示,免疫后的小鼠血清与PDCoV反应良好。
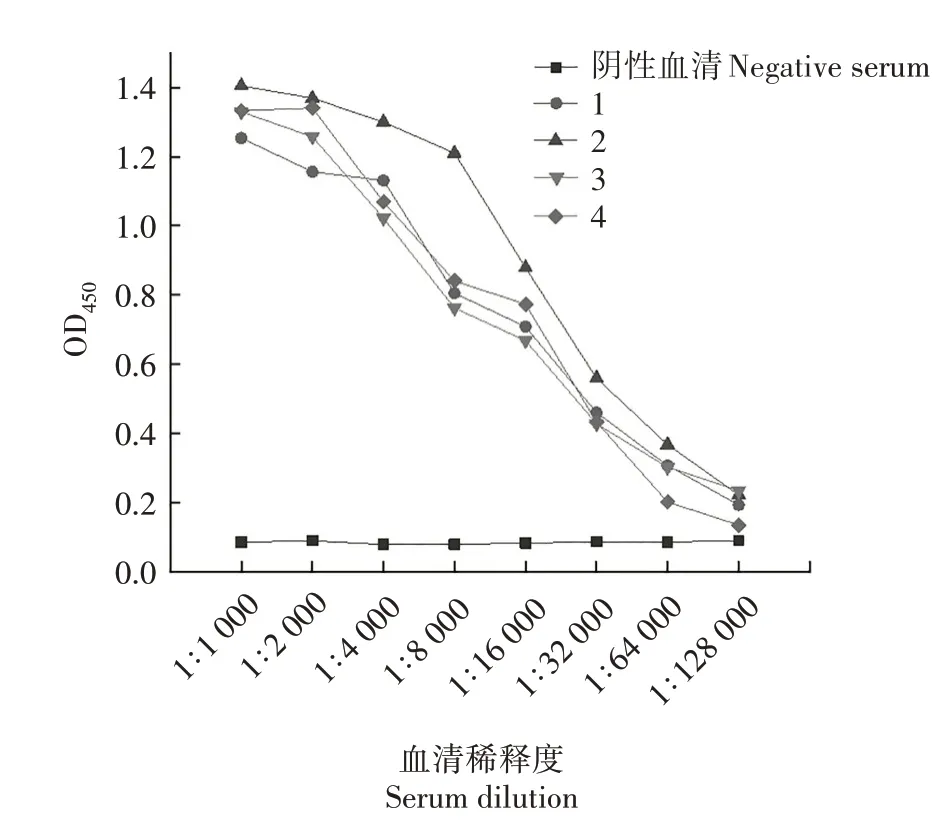
图10 小鼠血清效价测定Fig.10 Assay of serum titer in mice
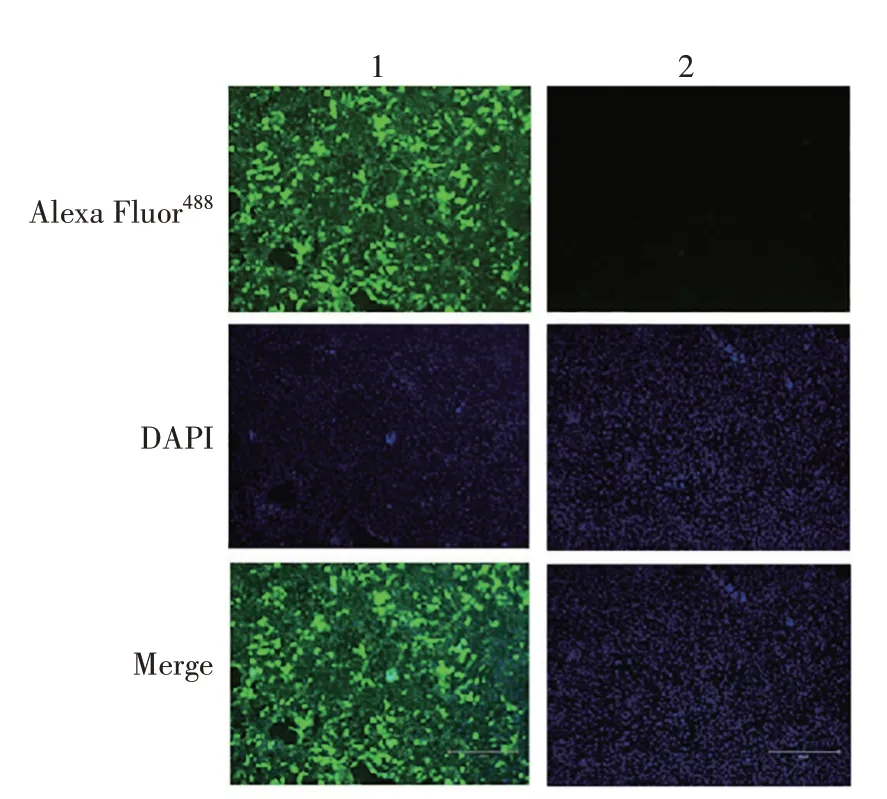
图11 小鼠血清的IFA鉴定Fig.11 IFA identification of mouse serum
2.4.3 病毒中和试验 选取2号小鼠血清进行中和试验,中和效价为1∶128。表明纯化后的重组S1 蛋白具有良好的免疫原性,能够诱导机体产生抗PDCoV的中和抗体。
3 结论与讨论
PDCoV 是近几年新出现的可引起猪只呕吐、水样腹泻的肠道冠状病毒[3],目前尚无有效的治疗药物和疫苗,因此进行有关PDCoV 的研究和防治非常紧迫。前人对冠状病毒的研究发现,S 蛋白在感染宿主过程中能诱导T细胞免疫应答从而引发保护性免疫,是主要的中和表位区,能诱导中和抗体产生[21-22]。CHEN 等[16]研究发现,PDCoV S 蛋白中的免疫显性中和区位于S1-CTD 区域。无论是针对PDCoV 检测诊断技术的研究还是疫苗的研发,S 蛋白都是研究的热点。侯林杉等[23]在大肠杆菌中表达了PDCoV S1 蛋白,但糖蛋白生物制剂的治疗效果很大程度由其翻译后修饰决定,特别是糖基化修饰[24],原核表达系统并不能满足这一需求。张爽等[25]在昆虫细胞中成功表达了PDCoV S1蛋白,但蛋白质表达量难以提高。蛋白质表达量的高低及表达蛋白质的系统能否大规模培养是疫苗生产中必不可少的衡量指标。因此,表达系统的选择对蛋白质特性和最大获得产量有着重要影响。CHO 细胞是生物制药行业中生产治疗性蛋白最可靠的宿主细胞[26],该表达系统既具有转录后修饰的功能,又能够实现大规模生产,且自身内源蛋白分泌表达较少,是目前广泛应用的哺乳动物细胞表达系统[18]。此外,由于标签蛋白的存在使得蛋白质的纯化变得方便快捷,现有许多针对猪疾病的亚单位疫苗带有相同的标签蛋白,这就导致在检测不同病毒的过程中可能引起交叉反应,给疾病的防控工作带来困难。所以,在蛋白质的结构解析、诊断试剂和疫苗的研究中,标签蛋白的存在会带来潜在干扰,接近天然构象的无标签蛋白的生产在这些研究中十分必要[27]。
本研究设计构建pCGS3-S1质粒电转染至CHO细胞,经有限稀释法筛选,并进行SDS-PAGE 和Western blot 验证,筛选出可高量表达PDCoV S1 蛋白的CHO 细胞系,连续传代结果表明1F4 细胞系稳定性良好。表达的无标签重组S1 蛋白经阴离子交换层析和凝胶过滤层析两步纯化后得到纯度高于90%的重组S1 蛋白,大小约为75 ku,产量为28.5 mg/L。经间接ELISA 检测,纯化后的重组S1蛋白可与1∶512 000倍稀释后的PDCoV 阳性血清发生有效反应,表明获得的重组S1 蛋白具有良好的生物活性。将重组S1 蛋白免疫小鼠2 次后产生了高水平特异性抗体,中和抗体水平为1∶128,高于范前进[28]研究中利用大肠杆菌表达的S1-CTD 蛋白所产生的中和抗体水平(1∶64),表明本研究利用CHO细胞表达的重组S1蛋白能够更好地诱导体液免疫应答。
综上,本研究成功构建了1株PDCoV S1蛋白表达量高、免疫原性好的CHO 细胞系,为PDCoV S1蛋白的功能研究及诊断试剂和疫苗的研制奠定基础。

