肺内型错构瘤临床及影像特点分析
姜若波,刘 敏,汤 泊(通信作者)
(沭阳县中医院放射科 江苏 宿迁 223600)
错构瘤是肺内最常见的第三位孤立性良性结节,包括支气管内型(中央型)及肺内型(周围型),以肺内型多见(约90%),肺内错构瘤是包含软骨、内衬上皮的裂隙、脂肪、平滑肌、骨组织和结缔组织等结构的良性病变[1]。典型错构瘤影像表现为钙化及脂肪密度影,若分叶较多或病情复杂者,则难与肺癌及肉芽肿性病变等鉴别,故本文通过回顾性分析于沭阳县中医院经外科手术病理确诊的65例错构瘤患者的临床资料及影像学特征,提高临床工作中对该病的认识。
1 资料与方法
1.1 一般资料
回顾性分析2018年1月—2022年12月于沭阳县中医院经外科手术及穿刺活检术后病理证实的65例错构瘤患者的相关临床资料(影像学资料、实验室检查、病理结果等),其中男性30例,女性35例,年龄26~81岁,平均年龄(52.62±10.30)岁。行胸部CT平扫检查30例;增强检查18例(其中平扫+增强检查4例);胸部CTA检查17例;加行肺部MR检查2例。
1.2 方法
入组患者术前均行薄层CT检查,CT扫描设备为GE LightSpeed 64排螺旋CT机,从肺尖扫描至双侧肺底水平,扫描参数:管电压120 kV,自动管电流mAs,层厚1.5 mm薄层重建;增强检查扫描则采用高压注射器于肘静脉注射非离子型对比剂(碘佛醇300 mgI/mL),流速3 mL/s,剂量1.5 mL/kg;设置胸主动脉靶血管。胸部CTA检查扫描范围同普通CT检查。所有检查均有纵隔窗(窗宽:400 HU;窗位:40 HU)和肺窗(窗宽:1 200 U;窗位:-600 HU)。2例加行肺部MR(平扫+增强)检查。
1.3 图像分析
入组患者所有相关影像学资料由两名影像诊断医师分别阅片后,采集各例患者影像资料中病灶形态学特征(位置、大小、形态、密度)及强化方式、临近组织器官是否受累等信息,CT值测量避开钙化及血管等结构。
2 结果
2.1 影像学表现
65例患者术前均行胸部CT检查。病灶形态多呈类圆形,部分呈圆形;肿瘤最大径0.6~3.8 cm,平均为1.4 cm,最大径>3 cm者4例,最大径≤3 cm者61例。CT特征见表1。65例肺内型错构瘤患者中有2例病灶位于胸膜下,与脏层胸膜贴近,分界模糊,但未见胸膜受累、淋巴结肿大、临近脏器受累等表现。入组中有2例患者在胸部CT检查后加做肺部MR检查,MR成像中呈稍短T1稍长T2信号,ADC值未减低,增强后为轻度的不均匀强化,TIC曲线呈速升平台型,结节周围均未见肿大淋巴结征象。见图1、图2。
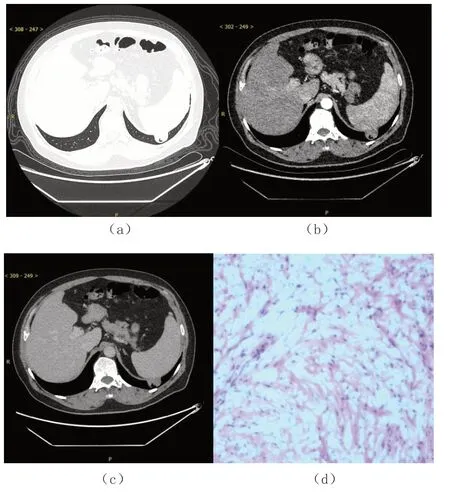
图1 纤维平滑肌型错构瘤
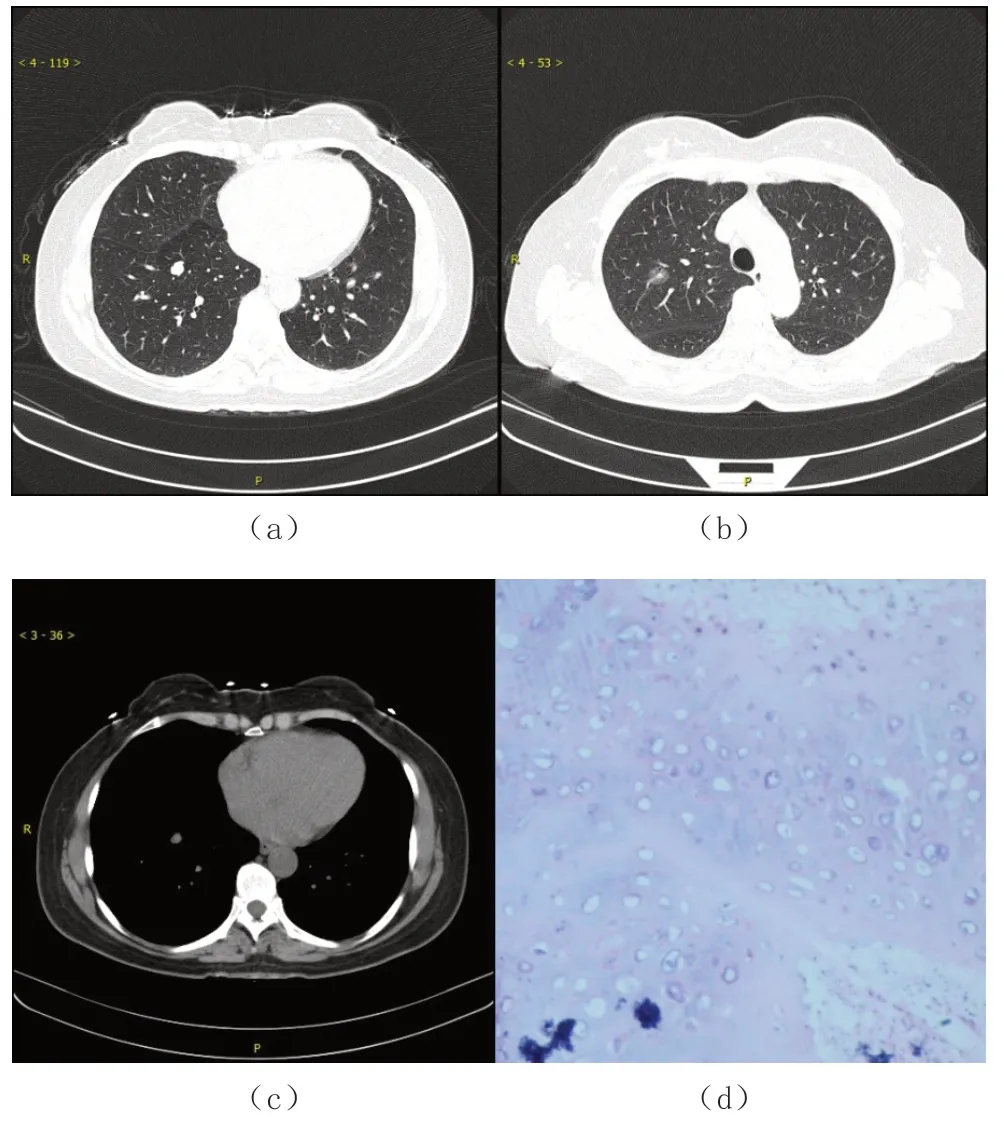
图2 软骨型错构瘤
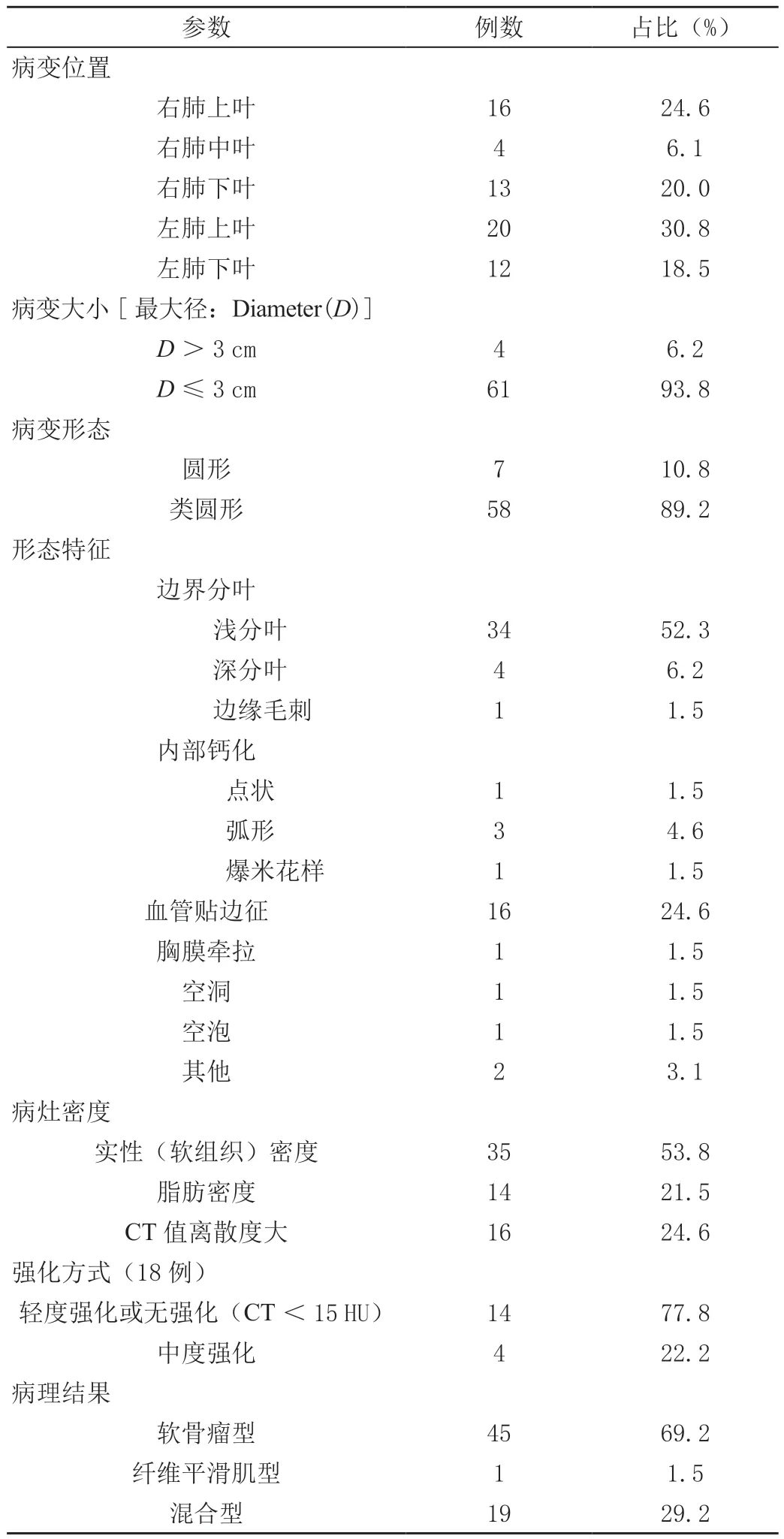
表1 65例肺内型错构瘤影像特征
2.2 病理学表现
65例错构瘤中45例为软骨瘤型,1例纤维平滑肌型,19例为典型错构瘤。肉眼观:体积不等的分叶状灰白的或灰色的肿物,触之质地硬实,界清,与肺实质之间有纤维分隔,易于从中剥脱。镜下观:19例中混杂有不同成分的软骨、脂肪、纤维结缔及平滑肌组织等结构;45 例以软骨成分为主;1例镜检表现为梭形细胞肿瘤,平滑肌成分为主,结合免疫组化梭形细胞平滑肌肌动蛋白(SMA)阳性,结蛋白(desmin)阳性提示纤维平滑肌细胞型错构瘤。
2.3 临床表现
本组65例错构瘤有4例伴有其他肺叶的磨玻璃结节(术后病理分别为不典型增生、原位癌及肺腺癌),另2例有鳞癌术后病史。余患者多因临床体检、肺部手术后复查或咳嗽、胸痛、背部疼痛等就诊时偶然发现;其中1例患者随访1年过程中肿瘤直径略有增大。65例患者中37例患者可见CYFRA211(细胞角蛋白19片段)、CA199(糖类抗原19-9)、CA72(糖类抗原72-4)、NSE(神经元特异性烯醇化酶)轻度异常,以NSE轻度升高居多(28例)。
3 讨论
肺错构瘤是由德国病理学家Eugen Albrecht于1904年首次发现,近年来,被认为是起源于支气管具有分化为多种成熟间叶组织能力的未分化间质细胞的良性病变[1-2],男女发病率比为(2~4):1。研究中女性患者比例高,与选择偏倚相关。肺错构瘤大体分型包括肺实质内型及支气管内型。根肺错构瘤组织学成分主导性差异,分为软骨瘤型、纤维平滑肌瘤型、平滑肌瘤型、腺纤维瘤型等。病理分型中以软骨瘤型错构瘤居多。病理学上肺软骨瘤型错构瘤、平滑肌型错构瘤、腺纤维瘤型则分别需与肺软骨瘤平滑肌瘤、孤立性腺纤维瘤等相鉴别[3]。
肺内错构瘤的特异性CT表现:①表现为肺内单发结节,多数边缘光滑清晰,多为周围型结节;中央型错构瘤若为较大的支气管或气管腔内结节,可因气道受阻有阻塞性肺炎、阻塞性肺不张等表现。②部分瘤体内的软骨成分的钙化或骨化而影像学上表现为典型爆米花样钙化,钙化多见于较大病变,小于2 cm的病变少见,钙化位置多样(边缘或中央,偏心,散在);75%的病变直径大于5 cm,此次分析研究中病灶大于3 cm者较少,考虑到医疗健康管理系统的完善导致早期发现就诊治疗者居多。该疾病的特异性诊断为爆米花钙化和脂肪密度影,由于出现钙化的可能性受肿瘤直径及软骨钙化程度影响[2],故典型表现者比例并不高。肺错构瘤内的成分复杂及差异性大,导致CT值离散度大和强化方式差异,CT值离散度大即在同一层面病灶的不同处测量的CT值相差较大,部分报道称错构瘤分叶表现越明显、密度越不均匀,CT值离散度越大[3]。增强检查时以不均匀轻度强化常见,中度强化者少见;若瘤内以脂肪和软骨成分为主,血供少则表现为轻度或无强化;若以平滑肌及腺体成分为主,则可表现为中度或稍明显强化。本次研究中增强检查病例呈轻度或无强化、中度强化,与既往报道较一致[4]。部分学者认为在CT检查基础上可另行MR检查帮助诊断,可见较典型的裂隙样结构[2],因样本量有限,此次研究中仅有2例患者接受磁共振检查,表现为稍短T1稍长T2信号,ADC值未减低,增强后不均匀轻度强化,TIC曲线呈速升平台型,结节局部可见信号较低的裂隙样结构,MRI成像梯度自旋回波序列的进、出相有助于检查CT无法检出的含有微小脂肪成分的错构瘤[7]。较多文献报道中肺错构瘤除分叶征,其他恶性肿瘤征象极少见,本次研究中少部分患者的影像学特征分析时发现具有空泡征(1例)、空洞(1例)、胸膜牵拉(1例)及边缘毛刺(1例)等征象,此类征象可见于恶性肿瘤,对诊疗产生误导性。另有16例病变存在血管贴边征,本研究发现具有空洞、空泡征象的错构瘤各1例,既往研究中发现空洞型错构瘤较少。有个案文献报道提示空洞型孤立性肺结节也可为肺错构瘤[6]。
肺内型错构瘤因多数脂肪不可见或缺乏钙化导致误诊。肺内型错构瘤需与硬化性肺泡血管瘤、周围性肺癌、结核球、类癌等进行鉴别诊断。硬化性肺泡血管瘤多为圆形或类圆形的结节,密度常较均匀,边缘可见分叶,由于组织学成分血管瘤样区和乳头区[8]的存在,增强检查可表现为中度或显著强化[9]。瘤体内或边缘可见钙化,周围可有“晕征”改变,可有“边缘假包膜征”(轻度强化的高密度环),结节对周围血管表现为“推而不侵”,边缘可见强化的血管向肺门延伸的“血管贴边征”。通过以上征象及强化方式与错构瘤加以鉴别。炎性肉芽肿病变中结核球以上叶尖后段和下叶背段多见,周围可见卫星灶,纵隔内或肺门淋巴结可有钙化。患者临床实验室检查有助于鉴别诊断。周围型肺癌多数具有分叶征、空泡征、棘突征、胸膜凹陷征等恶性征象,部分可伴有淋巴结肿大、瘤内坏死等表现,较易进行鉴别判断。类癌特点为支气管腔外的边界清楚的结节或肿块,钙化较常见。增强后呈显著均匀强化,中心型类癌毗邻气管时可有偏心钙化[10],需注意与中央型错构瘤重点鉴别。
既往相关文献报道中提及良恶性结节的患者的血清中CEA、NSE、CA125和CYFRA21-1的表达水平稍高于正常人群[11],良性结节患者多升高不明显。本次研究中除CYFRA211、NSE轻度升高外,CA72也有轻度升高表现。因此在临床工作中需要留意血清标志物的特异性较低情况。多数肺内错构瘤若无明显临床症状相关性,可在穿刺活检明确病理类型后随诊观察,不予外科手术切除。若病灶随访观察过程中有所增大,部分肺癌患者伴肺内错构瘤[12]要求外科手术处理;极少个案报道的胸膜转移[13]或癌变、肉瘤样变发生[14]等情况应外科切除。
综上所述,肺内型错构瘤在影像学上主要表现为伴有钙化、浅分叶或CT离散值较大的肺内边界清晰结节,少数可有空洞、胸膜牵拉等不典型特征,增强后无强化或轻度强化,注意CT及MR影像上脂肪成分的检测,结合临床资料可做出相应的诊断,提高临床工作中对该病的诊断准确率。

