阿片类药物成瘾的运动干预及其作用机制研究进展
于志梅,刘 军
阿片类药物是指从罂粟中提取的天然生物碱以及具有类似性质的半合成或合成化合物。其中,最初由罂粟中分离得到吗啡,在对吗啡的结构进行分析和改良后获得海洛因、可待因、烯丙吗啡等衍生物质(图1,表1)。阿片类药物通过内源性阿片肽(endogenous opioid peptide, EOP)系统发挥药理作用,具有高度成瘾性,可导致成瘾者产生强迫性觅药和复吸行为,造成严重的公共安全卫生问题。运动已被证明可从不同方面对甲基苯丙胺和阿片类药物成瘾过程包括起始、维持、戒断以及复吸等各阶段起到保护作用(柯钰婷 等,2015;Morais et al.,2018)。运动具有成本低、安全、方便等优点,已应用于对药物依赖者的强制隔离戒毒过程中,逐渐成为药物成瘾的有效干预措施之一。
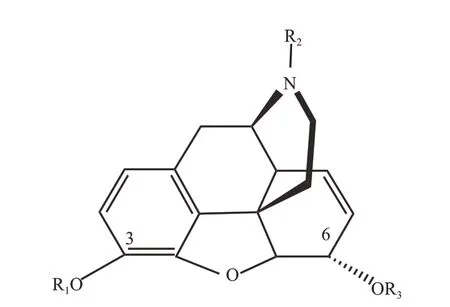
图1 吗啡及其衍生物共同结构Figure 1. Common Structure of Morphine and Its Derivatives
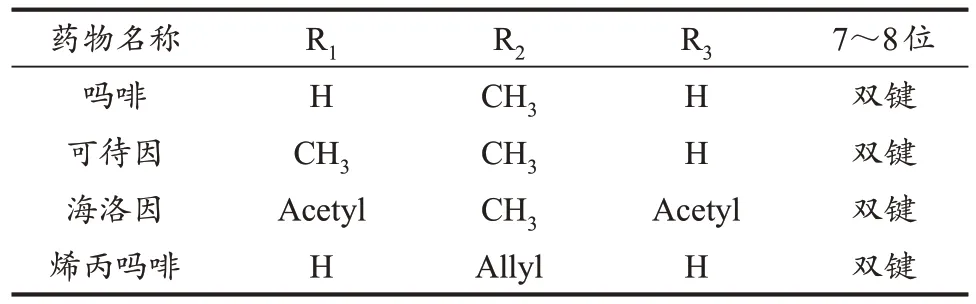
表1 常见的阿片类药物化学结构Table 1 The Chemical Structure of Common Opioids
1 阿片类药物成瘾的生理基础
奖赏效应是导致阿片类药物成瘾的直接原因,药物的反复使用可提高大脑奖赏系统奖赏阈值,成瘾的生理基础涉及多巴胺(dopamine, DA)能系统和EOP 系统,二者同时也是治疗阿片类药物成瘾的重要靶点。
1.1 奖赏产生的神经解剖学基础
奖赏系统被定义为“渴求”和“喜欢”。中枢神经系统(central nervous system,CNS)中涉及奖赏产生的脑区有前额叶皮层(prefrontal cortex,PFC)、杏仁核(amygdala,AMY)、中脑腹侧被盖区(ventral tegmental area,ⅤTA)、伏隔核(nucleus accumbens,NAc)等,可产生EOP 和DA 等具有欣快感的物质,在情感、动机和奖赏等相关生理和病理行为中发挥重要作用,DA 能系统主要作用表现为“渴求”,带来短暂的快感,而EOP 物质主要作用表现为“喜欢”,维持长久的愉悦(Berridge,2009;Serafini et al.,2020)。奖赏性刺激通过作用于脑内奖赏系统,引起NAc 区DA 释放量增加,产生奖赏效应。其中,ⅤTA 投射至NAc 的DA 能通路是大脑奖赏系统的核心部分,也是各种奖赏效应产生的共同通路。内啡肽(endorphin,EP)、脑啡肽和强啡肽等EOP 通过激活位于神经元细胞膜上的μ 阿片受体(μ-opioid receptor,MOR)、κ 阿片受体(κ-opioid receptor,KOR)以及δ 阿片受体(δ-opioid receptor,DOR)调节多种情绪和生理反应,其中β-EP 是EOP 系统的重要组成成分,能够与阿片受体结合,产生欣快感、满足感等奖赏效应(Conway et al.,2022;Gupta et al.,2021;Roth-Deri et al.,2008)。
1.2 阿片类药物成瘾的生理机制
阿片类药物摄入后作用于中枢,改变DA 能系统和EOP 系统的稳态,且二者作用交互增强,产生毒瘾(Roth-Deri et al.,2008),其成瘾涉及大脑奖赏系统。其中,DA能系统奖赏效应是包括阿片类药物在内的许多成瘾性药物产生精神依赖的直接原因,也是阿片类药物奖赏效应产生的最后通路(Koob et al.,2010)。此外,有研究发现,丘脑室旁核(paraventricular thalamus,PⅤT)是阿片类药物成瘾相关记忆网络的关键节点,PⅤT-NAc 通路可能参与介导吗啡成瘾的戒断反应,抑制该通路可以消除由阿片类药物戒断产生的生理和心理上的负面作用(Zhu et al.,2016)。PⅤT 还可通过中央杏仁核(central amygdaloid nucleus,CeA)和NAc 分别控制吗啡相关记忆的形成和维持,CeA 的促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH)神经元可通过抑制性环路调控ⅤTA 中吗啡激活的奖赏神经元集群,介导吗啡戒断诱发的负性强化效应,并确认了PⅤT-NAc-外侧下丘脑(lateral hypothalamus,LH)神经环路是治疗阿片成瘾的潜在靶标(Jiang et al.,2021;Keyes et al.,2020)。
研究显示,阿片药物可能存在独立于DA 能系统的强化作用途径,但通过与阿片受体结合直接或间接作用于DA 能神经元,增加NAc 中DA 水平,产生奖赏效应,这是阿片类药物成瘾的主要机制之一(图2)。其途径包括:1)外源性阿片类药物摄入激活位于ⅤTA 尾部的喙内侧被盖核(rostromedial tegmental nucleus,RMTg)的GABA 能中间神经元上的MOR,通过与Gi/o 蛋白偶联抑制GABA 能神经元活性,使受其调节的DA 能神经元脱抑制,增加DA的释放,作用于DR 引起奖赏效应(吴静 等,2019;Le Merrer et al.,2009);2)阿片类药物还可抑制DA 的重摄取,增加胞外DA 浓度,产生奖赏效应。此外,机体EOP 水平下降是阿片类药物依赖和耐受的主要机制之一(Shi et al.,2009)。正常情况下,EOP 系统处于平衡状态,长期使用外源性阿片类药物后会激活EOP 系统引起奖赏效应,还会与内源性阿片类物质竞争性结合阿片受体,打破EOP系统的稳态,抑制β-EP 合成和释放,导致内源性EOP 系统功能受损(孙鲁月 等,2021)。

图2 阿片类药物成瘾的生理机制Figure 2. Physiological Mechanisms of Opioid Addiction
2 运动干预阿片类药物成瘾的可能机制
2.1 运动调节中枢神经系统递质稳态
阿片类药物长期作用于中枢神经系统会影响大脑的自然奖赏系统,造成中枢神经递质系统稳态失衡,引起包括DA 及其受体、阿片肽及其受体水平异常等改变,产生奖赏效应,引起欣快感。研究表明,运动可以通过调节体内与奖赏系统有关的DA 及其受体水平,影响DA 能信号传导,以及通过调节EOP 系统,释放内源性阿片类物质,并使谷氨酸和GABA 水平及其功能正常化来改善奖赏系统功能,减少对成瘾药物的易感性和渴求(Weinstock et al.,2012;Zhou et al.,2016)。
2.1.1 运动通过调节DA及其受体表达恢复DA系统稳态
长期摄入阿片类药物会破坏DA 能系统稳态,导致中脑边缘DA 奖赏环路功能异常,包括突触多巴胺转运蛋白(dopamine transporter,DAT)再摄取的减少、NAc 内DA 浓度增加、DA 受体1(dopamine receptor 1,D1R)表达增加、DA受体2(dopamine receptor 2,D2R)表达减少、酪氨酸羟化酶(tyrosine hydroxylase,TH)表达和DA 能神经元自噬增加等(Li et al.,2018;Zhou et al.,2016),且ⅤTA DA 神经元胞体体积减小(Doyle et al.,2021)。通过吗啡建立条件性位置偏爱(conditioned place preference,CPP)会增加腹侧海马(ventral hippocampus,vHip)和mPFC 中D1R-细胞外信号调节激酶(extracellular regulated protein kinases,ERK)-cAMP 反应元件结合蛋白(cAMP-response element binding protein,CREB)通路的活性(Wang et al.,2019)。成瘾期,ⅤTA 区D2R 表达下调,其负反馈抑制作用减弱,药物高易感性可能与D2R 表达较低有关(王传升 等,2010),提示,通过提高D2R 的表达水平,可有效降低机体对药物的渴求程度。此外,在D2R 基因敲除小鼠中,吗啡等阿片类药物的奖赏效应可被抑制(De Mei et al.,2009)。在慢性暴露后阻断D2R 可恢复磷酸化Akt(p-Akt)/磷酸化糖原合成激酶-3β(p-GSK3β)水平,抑制吗啡CPP 的恢复(Wang et al.,2019)。有研究发现,使用D1R 和D2R 拮抗剂可有效降低吗啡CPP 的获得、表达并缩短其消退期和抑制消退期后的恢复,且D2R 对吗啡CPP 恢复的影响大于D1R,原因可能是药物的药理性质不同或2 种拮抗剂在海马CA1 内的扩散特性不同(Assar et al.,2016;Nazari-Serenjeh et al.,2021)。而在由食物剥夺(food deprivation,FD)和吗啡阈下剂量(0.5 mg/kg)联合诱导的吗啡CPP 恢复实验中,D1R的作用比D2R 更突出,是由于施加的应激源不同,D2R 拮抗剂不影响联合诱导的吗啡CPP 恢复(Nazari-Serenjeh et al.,2020)。同时,在海马的齿状回和ⅤTA 也可观察到吗啡寻求恢复的抑制(Farahimanesh et al.,2018)、获得和表达减弱,以及消退期缩短(Katebi et al.,2018)。慢性阿片类药物暴露后,大鼠基底外侧杏仁核(basolateral nucleus of amygdala,BLA)D3R 的表达选择性下调,D3R 基因的缺失会增加对海洛因的易感性和海洛因寻求行为(Rosen et al.,2017;Zhan et al.,2018)。戒断期间,DA 神经元放电和细胞外DA 水平下降,产生戒断症状(Koob,2020)。
研究表明,运动可以代替阿片类药物通过增加DA 浓度和D2R 的表达等途径调节中脑DA 稳态,使奖赏系统正常化(冯俊鹏 等,2019)。运动后即刻DA 水平升高,并在运动结束后一段时间内逐渐下降(赵非一 等,2018)。大强度运动更有利于刺激DA 生成(冯俊鹏 等,2019)。60 min 的剧烈跑台运动会增强大鼠体内海马中DA 的释放(Goekint et al.,2012)。有氧运动可减少D1R 水平和增加D2R 水平,调节DA 稳态,减少药物的正性强化作用(Robison et al.,2018),抗阻运动可显著减少雌性大鼠海洛因自我给药,且NAc 核心区中D1R、D2R 和D3R 的mRNA 表达显著降低,D1R 和D2R 的比例对成瘾易感性具有重要影响,抗阻运动可能通过降低大鼠DR 基因表达进而降低海洛因的正性强化作用,进而平衡NAc 中腺苷酸环化酶(adenylate cyclase,AC)和cAMP 依赖的蛋白激酶活性,此外还可增加NAc 壳中的D5R mRNA 表达,D5R 的激活可增强奖赏通路中的脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号,使NAc 中BDNF 水平正常化(Smith et al.,2018)。
2.1.2 运动调节EOP系统功能
外源性阿片类药物摄入会导致EOP 系统功能损伤,造成奖赏环路异常(孙鲁月 等,2021)。EOP 通过与位于神经元细胞膜上的阿片受体结合对奖赏和厌恶处理发挥关键作用,MOR 和DOR 在药物奖赏中起作用,前者可促进药物使用并导致耐受和依赖,后者可改善情绪状态,调节学习和记忆;KOR 在药物厌恶中起作用,维持戒断的厌恶状态(Darcq et al.,2018)。阿片类药物依赖遗传易感性的相关研究多集中在阿片受体的单核苷酸多态性上,MOR 基因OPRM1、KOR 基因OPRK1 和强啡肽原(prodynorphin,PDYN)基因以及孤啡肽受体基因均与阿片类药物成瘾密切相关(Kreek et al.,2019)。其中,OPRM1 基因中的A118G 等位基因可增加阿片类药物成瘾风险(Taqi et al.,2019),是相关研究中常见且广泛的与成瘾相关的候选基因。同时,外源性阿片类药物摄入,与阿片受体竞争结合,导致EOP 系统功能损伤,使内源性EP 生成受到抑制,导致成瘾者出现相对的EP 缺乏(Reed et al.,2017)。β-EP 水平与欣快感呈正相关,随着外源性阿片药物的不断摄入,机体内β-EP 浓度增加,阿片受体逐渐产生耐受性,使得依赖者的需求增加,戒断情况下,EOP 不能满足机体正常功能活动的需要,导致机体生理功能紊乱,进而出现各种戒断症状。
目前,阿片类成瘾药物治疗主要采用以阿片受体激动剂和拮抗剂为靶标的方式,但两者的疗效均不理想,而运动可激活奖赏系统,以非药理学方式降低机体对毒品的渴求,通过增强EOP 的应答与分泌,增加体内β-EP 浓度,合理调节下丘脑和血浆中β-EP 含量,提高机体运动能力,形成良性循环(朱浩,2019)。研究认为,运动促使机体对毒品诱导的渴求行为减弱是由于激活了EOP 系统,且运动强度与EP 释放可能存在U 型关系(Ahmadi et al.,2018)。长期规律的中等强度有氧运动可以通过影响DA和EOP 系统调节奖赏系统功能,从而控制毒瘾的形成和减轻戒断症状(冯俊鹏 等,2019)。有氧游泳训练能够显著提高吗啡依赖小鼠β-EP 水平,从而逆转依赖的形成(于动震 等,2010)。抗阻运动能够降低海洛因暴露大鼠中MOR mRNA 的表达,导致海洛因自我给药显著减少(Smith et al.,2018)。8 周有氧和力量运动后的血浆β-EP水平均提高,但有氧运动组上升幅度大于力量运动组(朱浩,2019)。有氧运动的强度与β-EP 及其他阿片肽的释放呈正相关(Ahmadi et al.,2018)。通过运动产生的β-EP 能够发挥心理代偿作用改善心理戒断症状,还能与阿片受体结合激活奖赏系统,促进DA 释放(孙鲁月 等,2021)。
2.2 运动增加催产素水平
催产素(oxytocin,OT)是一种下丘脑神经肽,人类血浆OT 水平存在显著个体差异,是成瘾相关易感性的原因之一。阿片类药物会导致OT 系统功能减退,表现为OT合成与释放减少、OT 受体mRNA 表达上调和活性增加,进而使下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴和DA 能系统过度激活等(Che et al.,2021),导致复吸。此外,OT 在减少阿片类药物使用方面具有积极作用,可通过调节DA 能系统和5-羟色胺能神经传递抑制药物奖赏;在戒断期,通过抑制HPA 轴促肾上腺皮质激素释放因子(corticotrophin releasing factor,CRF)释放缓解戒断情绪;还可防止药物相关线索诱导的药物寻求恢复(Che et al.,2021)。急性OT 给药可以减轻海洛因依赖患者的渴求、戒断症状并降低皮质醇水平,改善皮质醇/脱氢表雄酮硫酸盐(dehydroepiandrosterone-sulfate,DHEA-S)比值(Moeini et al.,2019)。卡贝缩宫素(CBT)是一种OT 类似物,可以减轻小鼠吗啡戒断引起的包括焦虑、抑郁样行为、社交能力降低等负面情绪以及阻止应激诱导的吗啡CPP 的恢复(Zanos et al.,2014)。
运动可以调节成瘾者血浆OT 水平,定期有氧运动会增加雌性小鼠的血浆OT 水平,减少焦虑(Yüksel et al.,2019)。有氧运动与阻力训练和8 周的递增负荷相结合,可以增加血浆OT 水平,显著降低女性海洛因成瘾者社交焦虑障碍(social anxiety disorder,SAD)和线索诱导的渴望严重程度(Wang et al.,2021),提示,OT 是预测女性海洛因戒断患者社交焦虑严重程度的潜在外周生物标志物。OT 能系统在阿片类药物成瘾和复发中具有关键作用,通过与单胺能、谷氨酸能等系统的相互作用及其对HPA 轴等的影响有助于减轻戒断反应,是运动治疗药物成瘾,特别是预防复发的新靶点。
2.3 运动提高BDNF的表达
BDNF 是一种中枢神经营养因子,可穿过血脑屏障参与许多神经过程,与多种精神疾病和成瘾障碍有关。阿片类药物引起中枢神经系统的神经毒性,与BDNF 表达的改变有关(Palma-Álvarez et al.,2017)。研究显示,海洛因成瘾者血小板数量、转化生长因子-β1(transforming growth factor-β1,TGF-β1)和血浆BDNF 水平降低,神经营养因子的保护作用降低,进而导致执行功能被破坏(Lu et al.,2017)。血浆BDNF 水平不受BDNF Ⅴal66Met 基因变异的影响,与海洛因使用年限呈负相关,超过15 年的海洛因依赖患者血浆BDNF 水平显著低于少于5 年的患者(Chen et al.,2015)。动物实验中,大鼠大脑药物成瘾相关区域BDNF 水平显著降低(Chen et al.,2012)。在人类海洛因成瘾者、海洛因自我注射大鼠和重复吗啡治疗小鼠ⅤTA的BDNF mRNA 水平均显著降低,且慢性吗啡暴露导致BDNF 外 显 子II、IⅤ和ⅤI 的 转 录 水 平 下 降(Koo et al.,2015)。血清BDNF 水平与BDNF 启动子甲基化率呈负相关,阿片类药物使用者BDNF 的甲基化水平升高(Schuster et al.,2017)。BDNF 基因启动子区DNA 甲基化的增加与海洛因成瘾有关(Xiao et al.,2021)。由此可见,BDNF的下调表明海洛因成瘾者有一定程度的神经元退化及神经营养因子保护作用降低,执行功能被破坏。Heberlein等(2011)报道了阿片类药物依赖患者在阿片维持治疗期间血清BDNF 水平的增加与对海洛因的渴望有关。海洛因依赖患者在早期戒断(1~7 天)和戒断后1 个月血清BDNF 水平升高(Zhang et al.,2014)。BDNF 表达的增加可能会抵消慢性阿片类药物使用对神经元的影响,是一种对神经元损伤的代偿反应。
运动能增加慢性吗啡暴露下的海马BDNF 水平,不同运动强度对海马BDNF 水平的影响不同,定期适度的强迫运动有利于男性成瘾者克服认知和焦虑类行为缺陷(Shahroodi et al.,2020)。BDNF 通过酪氨酸激酶B(TrkB)发挥作用,吗啡依赖大鼠自主运动可以通过TrkB 介导的机制减轻吗啡依赖严重程度,改善认知障碍(Miladi-Gorji et al.,2011)。8 周有氧和无氧运动通过刺激TrkB 增加脑内BDNF 的表达,显著提高血浆BDNF 水平,抗阻运动未见显著影响(Hamedinia et al.,2017)。另一项研究表明,抗阻运动会增加海洛因暴露大鼠NAc 核心区中BDNF 外显因子I、IIB、IIC、IⅤ、ⅤI 和IX 的mRNA 表达(Smith et al.,2018)。运动中产生的代谢物乳酸通过血脑屏障,诱导一种重要的调节因子NAD+依赖性去乙酰化酶sirtuin1(SIRT1)激活,进而通过过氧化物酶体增殖物激活受体γ辅助活化因子1α(peroxisome proliferator-activated receptor γ coactivator 1α,PGC1α)/Ⅲ型纤维蛋白结构域结合蛋白5(fibronectin type Ⅲ domain-containing protein 5,FNDC5)通路诱导BDNF 表达来促进学习和记忆的形成(El Hayek et al.,2019)。运动可减轻长期吗啡接触后BDNF 水平降低导致的焦虑和记忆受损的影响,但高强度运动可能由于皮质酮水平增加进一步降低后BDNF 水平(Ghodrati-Jaldbakhan et al.,2017)。因此,运动通过影响BDNF 水平而改善药物成瘾者症状,但具体运动方式的作用效果和机制仍待深入研究。
2.4 运动调节神经系统免疫机能
摄入大量阿片类药物会诱发成瘾相关脑区胶质细胞(小胶质细胞与星形胶质细胞)的防御反应,释放免疫相关的炎性细胞因子。吗啡摄入激活MOR,通过蛋白激酶Cε-Akt-ERK1/2 信号上调小胶质细胞中核因子-κB(nuclear factor-kappa B,NF-κB)的活性及白介素-1(interleukin-1,IL-1)、肿瘤坏死因子-α(tumor necrosis factor α,TNFα)、白介素-6(interleukin,IL-6)等由NF-κB 调节的促炎因子,以此来调节神经炎症反应(Gessi et al.,2016)。此外,慢性吗啡给药显著增加NAc Toll 样受体2(Toll-like receptor 2,TLR2)的表达,TLR2 基因敲除小鼠戒断症状显著减弱,通过TLR2 触发小胶质细胞激活,刺激炎性细胞因子产生,可显著增强野生型小鼠TNF-α 和IL-6 的表达(Zhang et al.,2011),抑制ⅤTA 中TLR4/信号转导和转录激活因 子3(signal transducers and transcription activator 3,STAT3)信号通路可以抑制吗啡诱导的CPP 的获得和维持(Chen et al.,2017)。同时,长期服用曲马多(为合成的可待因类似物)会使活性氧(reactive oxygen species,ROS)产生增加,ROS 通过激活NF-κB 产生多种炎症介质来引发炎症,氧化应激和炎症可以协同作用,引起大脑脂质过氧化、炎症和凋亡标志物上调,表现为脑组织中NF-κB、TNF-α 和IL-6 水平显著升高(Mohamed et al.,2019)。且海洛因成瘾者B 细胞总数增加,IgG3、IgG4、IgM、转化生长因子α(transforming growth factor-α,TGF-α)、TNF-α、IL-8 和sCD40L 水平显著升高(Piepenbrink et al.,2016),还会诱导皮质和纹状体中趋化因子CCL5 的表达增加(Campbell et al.,2013)。
运动可以通过调节血液中免疫细胞的活性和免疫因子的含量增强机体免疫机能,代偿由于药物滥用导致的机体免疫力下降(石海旺 等,2021)。高强度间歇训练(high intensity interval training,HIIT)后,成瘾者抑郁、焦虑和物质渴求症状显著减少,血清胰岛素样生长因子1(insulin-like growth factors-1,IGF-1)水平增加,但并未改变血清干扰素-γ(interferon-γ,IFN-γ)和IL-17 水平(Taş Dürmüş et al.,2020)。相反,在吗啡戒断综合征期间进行8 周适度运动后,小鼠IFN-γ 水平增加、IL-17 血清水平降低(Heidarianpour et al.,2016),提示,通过适当强度的运动可以把增加IFN-γ 水平作为一种减少炎症、改善免疫系统功能的方法。重复中等强度的运动可以增强免疫系统功能,增强抗氧化能力,减轻氧化应激损伤,提高能量产生效率,从而降低炎症性疾病的发病率(Scheffer et al.,2020)。
3 阿片类药物成瘾的运动干预形式
成瘾是一种慢性疾病,其治疗应遵循持续的干预模式(图3),干预强度应个性化,并及时根据成瘾的严重程度及并发症等情况进行调整,保证运动的安全性和最佳康复效果。
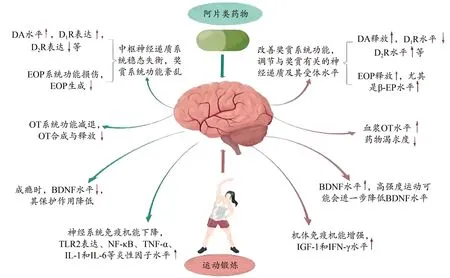
图3 阿片类药物成瘾及其运动干预机制Figure 3. Mechanisms of Opioid Addiction and Exercise Intervention
3.1 有氧运动
有氧运动具有运动强度低,简便易行等优点,在运动干预药物成瘾中应用较多,主要包括跑步、游泳和太极拳等形式。大鼠进行每周5 天、共6 周的跑台训练(速度为10 m/min),第1 天训练10 min,之后每天增加10 min,增加到60 min 后不再增加训练时间,大鼠总跑量约为16.5 km,训练后大鼠D1R 水平降低,D2R 水平增加,药物寻求行为下降(Robison et al.,2018)。Rosa 等(2020)对吗啡成瘾小鼠进行1 h/天(2 次30 min,中间休息10 min),5 次/周,持续短期(2 周)、中期(4 周)和长期(6 周)3 种不同时间的游泳干预,运动后药物偏好均呈下降趋势,且NAc 和海马中的DAT 和D1R 水平降低。海洛因成瘾者采用70%~80%HRmax强度进行20 min 急性有氧运动,可以减轻对海洛因的渴望并促进抑制控制,这种有益效果在运动后可持续40 min(Wang et al.,2020)。综上,研究显示,有氧运动对于改善焦虑作用较为显著,中到大强度有氧运动对成瘾者情绪性状态的改善效果优于低强度有氧运动(邓晓琴等,2021)。
3.2 抗阻运动
抗阻运动是指肌肉在克服外来阻力时进行的主动运动,包括克服自身体质量以及借助训练器械等运动,训练强度一般用1RM 的百分比表示。海洛因成瘾者进行40 min 低强度(30%~35% 1RM)、中等强度(55%~60%1RM)和高强度(75%~80% 1RM)的坐式胸肌推举、坐式蹬腿、高位下拉3 项不同动作组成的上、下肢训练后,发现不同强度抗阻运动对海洛因成瘾者心理渴求及执行功能具有剂量效应关系,高强度抗阻运动对成瘾者渴求度减缓和改善抑制功能的效益更佳(吕泽慧 等,2021)。通过让雌性海洛因成瘾Long-Evans 大鼠穿着加重背心攀爬梯子进行持续5 周、6 次/周的抗阻训练,海洛因自我给药率显著下降,且NAc 中D1R mRNA、D2R mRNA 和D3R mRNA的表达显著降低,D5R mRNA和BDNF基因表达显著上升,提示,抗阻运动可以降低海洛因的积极强化作用(Smith et al.,2018)。
3.3 HIIT
HIIT 是一种能够在较短时间内进行的全力、快速、爆发式训练方式。戒毒人员进行为期16 周4 个阶段的HIIT,3 次/周,1 h/次,适应阶段强度为60%O2max,提高阶段强度为60%~75%最大心率(maximal heart rate,MHR),强化阶段强度为70%~85% MHR,巩固阶段强度为70%~80% MHR,每个阶段都针对不同的素质进行训练,发现肌肉力量、柔韧素质和平衡能力等身体素质和机能状态提高,血常规指标和SOD 活性显著增加,丙二醛水平显著降低,提示,HIIT 能够显著改善机体运输氧气的能力,增强机体抗氧化能力,还可促进神经生物学机能的良性改变(刘杨子纯 等,2021)。阿片类物质使用障碍患者进行为期21 天的HIIT 治疗,在功率自行车上(Monark)进行连续3 次Wingate 无氧功率测试,工作负荷为0.05 kg/kg 体质量,共5 次,每次运动后休息3 天,发现HIIT 对细胞因子的平衡有较大的影响,血清IGF-1 水平增加,可以显著减少患者的抑郁、焦虑和物质渴求症状(Taş Dürmüş et al.,2020)。
4 总结
阿片类药物成瘾会破坏奖赏系统稳态,不同形式运动针对阿片类药物成瘾的靶点,通过调节中枢神经递质系统稳态、OT、BDNF 和免疫水平重建身体内生理功能的稳态,有效减少药物渴求,防止复吸发生,但具体运动剂量效应和机制仍需进一步研究予以明确。运动干预需因人而异,实时监控干预过程,及时调整运动处方,以在控制风险的情况下使运动效益最大化。

