强脉冲光治疗重度慢性眼移植物抗宿主病的安全性和有效性
阴小月,王 贺,张照委,王仡宁,张 玲,李明新
0 引言
移植物抗宿主病(graft-versus-host disease,GVHD)是异基因造血干细胞移植(allogenic hematopoietic stem cell transplantation,allo-HSCT)主要且严重的并发症[1],据统计GVHD发病率在30%~70%,根据其临床表现及发病时间,分为急性GVHD(acular GVHD, aGVHD)和慢性GVHD(chronic GVHD, cGVHD),cGVHD累及皮肤、肺、口腔、肝脏、肾脏、眼、生殖道等全身多个器官,眼部是cGVHD常见的靶器官[2]。cGVHD患者中有60%~90%出现持续干眼,称为慢性眼移植物抗宿主病(chronic ocular graft-versus-host disease,coGVHD)[3]。目前coGVHD的发病机制不明,大部分学者认为coGVHD的特征是T细胞介导的免疫性炎症损伤,主要累及眼表组织,进一步导致组织纤维化[4]。患者早期通常表现出干眼的症状,如眼干、眼痛、异物感、疲劳感、畏光、流泪、视物模糊、视力波动等,发展到晚期而出现角膜溃疡、睑球黏连等[1,2,5],严重影响患者的生活质量[1,6]。目前coGVHD的治疗以减少眼表炎症为核心,局部免疫抑制剂滴眼液为一线治疗,如环孢素滴眼液,而激素类滴眼液也有益于减轻眼表炎症,但需注意监测眼压变化及观察白内障等不良反应。补充泪液以不含防腐剂的人工泪液为主,另外局部促泪液分泌剂对此类患者也有效。物理治疗如热敷、睑板腺按摩及睑缘清洁有利于减少泪液的蒸发,特殊治疗包括泪点栓塞、湿房镜、自体血清、角膜接触镜和手术治疗等[7-9]。
强脉冲光(intense pulsed light,IPL)作为一种新兴的治疗干眼的方法,首次发现在眼科使用IPL装置的报告可追溯到2002年,当时Toyos等[10]用IPL治疗酒渣鼻时观察到睑板腺功能障碍(meibomian gland dysfunction,MGD)相关干眼患者的眼表症状改善。IPL是一种非激光、高强度光源,其波长通常在500~1200nm范围内[11]。由于IPL具有加热、液化睑脂,疏通睑板腺和减少蠕形螨及细菌的滋生等作用,目前主要用于睑板腺功能障碍所致干眼及蠕形螨睑缘炎[12]。据我们所知目前研究强脉冲光治疗coGVHD较少,本研究通过强脉冲光应用于coGVHD,评估强脉冲光治疗此类干眼的疗效性和安全性。
1 对象和方法
1.1 对象采取前瞻性随机对照临床研究,2022-01/09招募经徐州医科大学附属医院就诊,既往行allo-HSCT,并经我院血液科、眼科诊断为coGVHD患者35例35眼,若双眼符合入组标准,则随机选择一眼纳入研究,若单眼符合入组标准,则选择此眼纳入研究。采用随机数字表法将患者随机分为两组,其中试验组20例20眼,对照组15例15眼。纳入标准:(1)经我院血液科、眼科诊断为coGVHD,诊断根据国际coGVHD共识小组(the International Consensus Criteria on oGVHD, ICCGVHD)制定的共识标准[13]。(2)根据《中国干眼专家共识:检查和诊断(2020年)》[14]经过我院眼科诊断为重度干眼患者。(3)年龄≥18岁,并自愿参与本项研究。排除标准:(1)有角膜接触镜配戴史患者;(2)6mo内有眼表炎症患者,如角膜炎、结膜炎等;(3)眼部手术史或重大外伤患者;(4)其他全身疾病相关干眼患者,如干燥综合征、黏膜类天疱疮、Stevens Johnson综合征、糖尿病、银屑病、Graves病及天疱疮等;(5)角膜上皮剥脱、角膜穿孔等患者;(6)怀孕、不能配合或不能完成随访等患者;(7)治疗区域皮肤破损、皮肤癌变、对光敏感等患者。本研究通过徐州医科大学附属医院伦理委员会审查并批准开展(伦理号:XYFY2022-KL232-01),所有患者已签署试验知情同意书和治疗知情同意书。
1.2 方法所有患者均以右旋糖酐羟丙甲纤维素滴眼液每天4次、环孢素滴眼液每天2次滴眼治疗,试验组在此基础上加以强脉冲光治疗,每2wk 1次,共4次。
1.2.1IPL治疗方法根据《强脉冲光治疗睑板腺功能障碍及其相关干眼专家共识(2022)》[12]进行治疗。选择M22的优化脉冲技术。中国人的皮肤类型属于Ⅲ~Ⅳ型[15],滤光片选择590nm,根据患者耐受程度选择能量梯度10~16J,脉宽为6ms,脉冲延迟为50ms。治疗步骤:(1)嘱患者清洁面部,彻底清洗防晒霜等阻光物质。(2)用眼罩遮盖患者眼部,并嘱患者全程闭眼。(3)涂治疗用凝胶:双眼下睑及鼻背部均匀涂抹治疗用凝胶,厚度约2mm。(4)光斑测试:在一侧耳际前,面颊部打一测试光斑,询问患者有温热感或轻微刺痛感者为正常的治疗反应。(5)用最佳治疗能量,将光导治疗头轻置于凝胶上,从患者一侧耳际开始发射光斑,沿下睑,尽量靠近睑缘处进行照射,对颧骨区、下眼睑及面部、鼻部进行治疗,直至另一侧耳际。光斑重叠部分不应超过10%。完整操作2遍。
1.2.2 观察指标比较两组患者治疗前,治疗后2wk,1、2mo最佳矫正视力(best corrected visual acuity,BCVA)、眼压(intraocular pressure,IOP)、眼表疾病指数(ocular surface disease index,OSDI)评分、无创泪膜破裂时间(non-invasive break-up time,NIBUT)、使用眼表综合分析仪自动测量泪河高度(tear meniscus height,TMH)和结膜充血(conjunctival injection score,CIS)、睑板腺面积比例(meibomian gland area proportion,MGAP)、睑板腺功能评估(meibomian gland evaluation,MGE)、角膜荧光素染色检查(cornea fluorescein staining,CFS)、结膜丽丝胺绿染色检查(conjunctival lissamine green staining,CLGS)、睑缘异常评分(lid margin abnormality score,LMAS) 、Schirmer Ⅰ 试验(Schirmer’s Ⅰ test,SⅠt)。
1.2.2.1OSDI评分OSDI共12项问题,OSDI得分=(25×总分)/回答的问题数,总分100分,分数越高表明主观症状越严重[16-17]。所有问卷均由同一位医师进行询问并统计分数。
1.2.2.2NIBUT检查嘱患者正常瞬目后连续瞬目2次后,使用眼表综合分析仪进行对焦,保持10s不瞬目,自动测量出患者角膜Placido环第一次破裂测出的时间,即为泪膜破裂时间(TBUT),分为首次(NIBUTf)和平均泪膜破裂时间(NIBUTav)[18],测量3次,取其平均值。
1.2.2.3MGAP检查翻转上下眼睑后利用眼表综合分析仪睑板腺成像技术获取睑板腺红外成像,使用Image J软件手动计算出上下睑板腺的面积比例。
1.2.2.4MGE检查在裂隙灯下,由同一位医师挤压眼睑,每只眼分为3个位置(鼻侧、中间、颞侧),每个位置5个腺体,共计15个腺体开口,对患者睑板腺分泌功能进行评分,每只眼上下眼睑分别评分,评分标准参照《我国睑板腺功能障碍诊断与治疗专家共识(2017年)》[19]。睑板腺分泌功能评分(meibomian gland secretory function score,MGSFS)标准:挤压眼睑,0分:5个腺体均具有分泌物排出能力;1分:3或4条腺体具有分泌物排出能力;2分:1或2条腺体具有分泌排出能力;3分:睑板腺腺体均不具有分泌物排出能力。总分合计0~9分。睑板腺分泌物性状评分(meibomian gland secretion quality score, MGSQS)标准[20]:每条睑板腺分别计分,3分:分泌液体透明、清亮;2分:白色或黄白色浓厚分泌物;1分:浓稠如牙膏状分泌物,0分:无分泌物排出。1次按压可覆盖5个相邻睑板腺开口,按顺序评估鼻侧、中央、颞侧腺体,共观察15条腺体,总分0~45分。
1.2.2.5LMAS检查在裂隙灯下由同一位医师根据以下4个标准[19,21],对眼睑边缘进行0~4分的异常评估:眼睑边缘钝圆或不规则、睑缘充血、睑板腺开口异常和黏膜皮肤连接处移位。
1.2.2.6CFS检查用生理盐水浸湿荧光素染色条接触患者下颞侧睑结膜面,嘱患者眨眼5次后在裂隙灯显微镜下用钴蓝光进行观察。将角膜分为4个象限,每个象限单独计算,0分:无染色;1分:1~30个染色点;2分:染色点>30个但各点之间无融合;3分:染色已融合或见大片染色。总分合计0~12分[22]。
1.2.2.7CLGS检查用无防腐剂的生理盐水湿润丽丝胺绿染色条接触下颞球结膜,嘱患者眨眼5次后。在裂隙灯下将眼表面分为鼻侧睑裂区球结膜、角膜、颞侧睑裂区球结膜3个区域,每一区域的染色程度分0~3分,0分:无染色;1分:少量散在点状染色;2分:较多点状染色但未融合成片;3分:出现片状染色,共计0~9分[22]。
1.2.2.8SⅠt检查无需行表面麻醉,轻轻拉开下睑,将折叠的泪液分泌试纸条放在下睑中外1/3下睑结膜穹窿内,5min后,读取泪液浸湿的长度。
1.2.2.9 安全性评估随访期间观察是否有治疗区域皮肤烫伤、红肿、睫毛脱落等不良反应。

2 结果
2.1 两组患者治疗前一般资料比较本研究共纳入患者35例35眼,研究期间有2例患者因个人原因退出研究,最终纳入患者33例33眼,其中试验组18例18眼,对照组15例15眼。两组患者治疗前一般资料和治疗情况比较差异均无统计学意义(P>0.05),见表1、2。

表2 两组患者治疗情况比较 例(%)
2.2 两组患者治疗前后OSDI评分比较两组患者治疗前后OSDI评分组间比较差异无统计学意义(F组间=0.337,P组间>0.05),时间和交互作用差异均有统计学意义(F时间=127.409,P时间<0.05;F时间×组间=15.074,P时间×组间<0.05)。各组内进一步两两比较的结果见表3。

表3 两组患者治疗前后OSDI评分比较 分)
2.3 两组患者治疗前后TMH比较两组患者治疗前后TMH组间比较差异无统计学意义(F组间=0.642,P组间>0.05),时间和交互作用差异均有统计学意义(F时间=47.130,P时间<0.05;F时间×组间=5.504,P时间×组间<0.05)。各组内进一步两两比较的结果见表4。

表4 两组患者治疗前后TMH比较
2.4 两组患者治疗前后NIBUTf比较两组患者治疗前后NIBUTf比较,差异均有统计学意义(F组间=10.839,P组间<0.05;F时间=29.688,P时间<0.05;F时间×组间=5.743,P时间×组间<0.05)。两组患者治疗前NIBUTf比较差异无统计学意义(P=0.907),治疗后2wk,1、2mo比较差异均有统计学意义(P<0.05)。各组内进一步两两比较结果见表5。
表5 两组患者治疗前后NIBUTf比较
2.5 两组患者治疗前后NIBUTav比较两组患者治疗前后NIBUTav比较差异均有统计学意义(F组间=10.441,P组间<0.05;F时间=64.879,P时间<0.05;F时间×组间=15.109,P时间×组间<0.05)。两组患者治疗前、治疗后2wk NIBUTav比较差异无统计学意义(PP>0.05),治疗后1、2mo比较差异均有统计学意义(P<0.05)。各组内进一步两两比较结果见表6。
表6 两组患者治疗前后NIBUTav比较
2.6 两组患者治疗前后CFS比较两组患者治疗前后CFS比较差异均有统计学意义(F组间=4.408,P组间<0.05;F时间=280.151,P时间<0.05;F时间×组间=32.349,P时间×组间<0.05)。两组患者治疗前、治疗后2wk,1mo CFS比较差异无统计学意义(P>0.05),治疗后2mo比较差异有统计学意义(P<0.05)。各组内进一步两两比较的结果见表7。两组典型病例治疗前后CFS情况见图1。
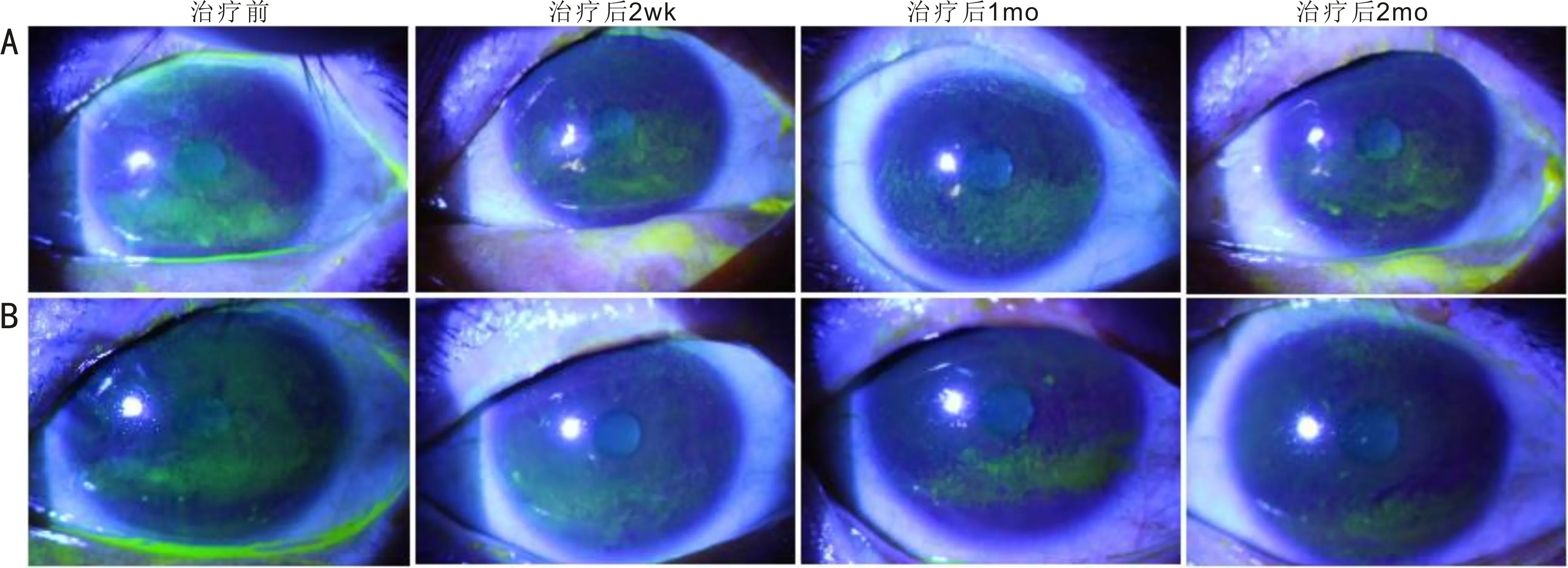
图1 两组典型病例治疗前后CFS情况 A:对照组患者右眼治疗后角膜荧光素着染逐渐减轻;B:试验组患者左眼角膜荧光素着染逐渐减轻,相较对照组明显。

表7 两组患者治疗前后CFS比较 分)
2.7 两组患者治疗前后CLGS比较两组患者治疗前后CLGS比较差异均有统计学意义(F组间=4.836,P组间<0.05;F时间=216.961,P时间<0.05;F时间×组间=20.273,P时间×组间<0.05)。两组患者治疗前、治疗后2wk CLGS比较差异无统计学意义(P>0.05),治疗后1、2mo比较差异均有统计学意义(P<0.05)。各组内进一步两两比较结果见表8。两组典型病例治疗前后CLGS情况见图2 。
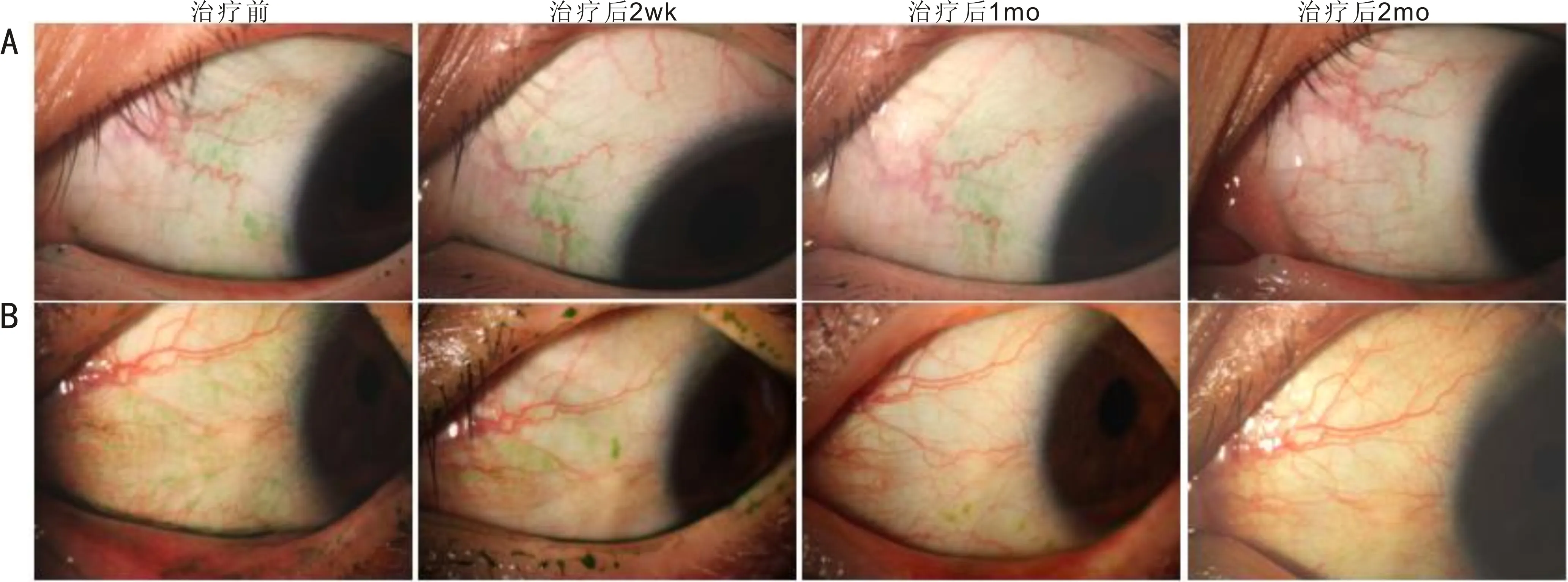
图2 两组典型病例治疗前后CLGS情况 A:对照组患者左眼鼻侧治疗后CLGS逐渐减轻;B:试验组患者左眼鼻侧CLGS逐渐减轻,相较对照组明显。

表8 两组患者治疗前后CLGS比较 分)
2.8 两组患者治疗前后CIS比较两组患者治疗前后CIS比较时间和交互作用差异均有统计学意义(F时间=88.899,P时间<0.05;F时间×组间=5.180,P时间×组间<0.05),但组间比较差异无统计学意义(F组间=0.768,P组间>0.05)。各组内进一步两两比较结果见表9。两组典型病例治疗前后眼前节照相见图3。

图3 两组典型案例治疗前后眼前节照相情况 A:对照组患者右眼,治疗后结膜充血逐渐减轻,睑缘的充血及状态无明显变化;B:试验组患者左眼,治疗后不仅结膜充血逐渐减轻,相较对照组明显,睑缘的充血也逐渐减轻,睑缘从钝圆变得锐利。

表9 两组患者治疗前后CIS比较 分)
2.9 两组患者治疗前后BCVA比较两组患者治疗前后BCVA比较时间和交互作用差异均有统计学意义(F时间=35.223,P时间<0.05;F时间×组间=3.782,P时间×组间<0.05),但组间比较差异无统计学意义(F组间=0.638,P组间>0.05)。各组内进一步两两比较结果见表10。

表10 两组患者治疗前后BCVA比较
2.10 两组患者治疗前后上眼睑MGAP比较两组患者治疗前后上眼睑MGAP比较差异均无统计学意义(F组间=0.143,P组间>0.05;F时间=0.848,P时间>0.05;F时间×组间=0.982,P时间×组间>0.05),见表11。
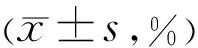
表11 两组患者治疗前后上眼睑MGAP比较
2.11 两组患者治疗前后下眼睑MGAP比较两组患者治疗前后下眼睑MGAP比较时间和交互作用差异有统计学意义(F时间=45.760,P时间<0.05;F时间×组间=43.670,P时间×组间<0.05),组间比较差异无统计学意义(F组间=0.106,P组间>0.05)。各组内进一步两两比较结果见表12 。两组典型病例治疗前后睑板腺红外照相情况见图4。

图4 两组典型案例治疗前后睑板腺红外照相情况 A:对照组患者左眼下睑板腺,治疗后睑板腺面积无明显变化;B:试验组患者右眼下睑板腺,治疗后患者下睑睑板腺面积在治疗后2wk,1mo无明显改变,但治疗后2mo时睑板腺面积增加,且腺体边缘清晰度较前增加。
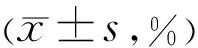
表12 两组患者治疗前后下眼睑MGAP比较
2.12 两组患者治疗前后上眼睑MGSFS比较两组患者治疗前后上眼睑MGSFS比较差异均有统计学意义(F组间=6.760,P组间<0.05;F时间=77.123,P时间<0.05;F时间×组间=50.439,P时间×组间<0.05)。两组患者治疗前、治疗后2wk上眼睑MGSFS比较差异无统计学意义(P>0.05),治疗后1、2mo比较差异均有统计学意义(P<0.05)。各组内进一步两两比较的结果见表13。

表13 两组患者治疗前后上眼睑MGSFS比较 分)
2.13 两组患者治疗前后下眼睑MGSFS比较两组患者治疗前后下眼睑MGSFS比较差异均有统计学意义(F组间=4.981,P组间<0.05;F时间=73.147,P时间<0.05;F时间×组间=45.126,P时间×组间<0.05)。两组患者治疗前、治疗后2wk下眼睑MGSFS比较差异无统计学意义(P>0.05),治疗后1、2mo比较差异均有统计学意义(P<0.05)。各组内进一步两两比较的结果见表14。

表14 两组患者治疗前后下眼睑MGSFS比较 分)
2.14 两组患者治疗前后上眼睑MGSQS比较两组患者治疗前后上眼睑MGSQS比较差异均有统计学意义(F组间=10.875,P组间<0.05;F时间=83.130,P时间<0.05;F时间×组间=57.098,P时间×组间<0.05)。两组患者治疗前、治疗后2wk上眼睑MGSQS比较差异无统计学意义(P>0.05),治疗后1、2mo比较差异均有统计学意义(P<0.05)。各组内进一步两两比较的结果见表15。

表15 两组患者治疗前后上眼睑MGSQS比较 分)
2.15 两组患者治疗前后下眼睑MGSQS比较两组患者治疗前后下眼睑MGSQS比较差异均有统计学意义(F组间=10.042,P组间<0.05;F时间=97.745,P时间<0.05;F时间×组间=76.857,P时间×组间<0.05)。两组患者治疗前、治疗后2wk下眼睑MGSQS比较差异无统计学意义(P>0.05),治疗后1、2mo比较差异均有统计学意义(P<0.05)。各组内进一步两两比较的结果见表16。

表16 两组患者治疗前后下眼睑MGSQS比较 分)
2.16 两组患者治疗前后LMAS比较两组患者治疗前后LMAS比较差异均有统计学意义(F组间=6.290,P组间<0.05;F时间=163.553,P时间<0.05;F时间×组间=114.428,P时间×组间<0.05)。两组患者治疗前、治疗后2wk LMAS比较差异无统计学意义(P>0.05),治疗后1、2mo比较差异均有统计学意义(P<0.05)。各组内进一步两两比较的结果见表17。

表17 两组患者治疗前后LMAS比较 分)
2.17 两组患者治疗前后SⅠt比较两组患者治疗前后SⅠt比较差异无统计学意义(均P>0.05),见表18。

表18 两组患者治疗前后SⅠt比较 [M(P25,P75),mm/5min]
2.18 两组患者治疗前后眼压比较两组患者治疗前后眼压比较 差异均无统计学意义(F组间=0.444,P组间>0.05;F时间=0.574,P时间>0.05;F时间×组间=0.498,P时间×组间>0.05),见表19。
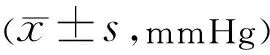
表19 两组患者治疗前后眼压比较
2.19 两组患者并发症情况随访期间均未观察到患者皮肤烫伤、红肿、睫毛脱落等不良反应。
3 讨论
coGVHD的发病机制目前不明,大部分学者认为coGVHD的发病机制是供体来源的CD4+、CD8+T细胞识别宿主抗原,进一步激活免疫系统,免疫炎症损伤所致组织纤维化,主要累及包括泪腺[23]、睑板腺[24]、结膜[25]、角膜[26]等眼表组织,从而影响泪腺、睑板腺及结膜的分泌功能,破坏泪膜稳定性,进一步形成了泪液的高渗压和泪膜不稳定,泪液的高渗状态泪膜的不稳定又加剧和放大了眼表组织的炎症,炎症进一步损伤眼表组织,形成一个眼表炎症级联反应[4-5]。患者通常表现出严重的干眼症状,且由于眼表的免疫炎症作用,coGVHD比一般干眼症状重,严重影响患者生活质量[6,27]。coGVHD的治疗,目前缺乏详细眼部治疗指南,出现干眼症状时,通常根据干眼相关治疗指南进行治疗[4,8,28-29]。一线治疗仍然是人工泪液,且推荐使用不含防腐剂的人工泪液[7-8]。根据coGVHD目前研究得出的发病机制,炎症是干眼发生的核心,减轻眼表的炎症是仍然必不可少,一线抗炎治疗为免疫抑制剂滴眼液如环孢素滴眼液、他克莫司滴眼液,激素类滴眼液如氟米龙滴眼液有益于抗炎治疗,但禁用于角膜上皮损伤、基质变薄及感染患者,且使用过程中需严密监测眼压及观察白内障等不良反应[9]。应用目前治疗许多患者仍不能缓解眼表不适症状。
IPL的工作原理是通过对氙气腔室的触发试电离产生的高强度光辐射[30]。IPL使用依赖于特定的能量吸收团(发色团),发色团能够吸收来自这种宽光谱光波长(吸收带)的能量,皮肤中血红蛋白、黑色素和水是IPL治疗的主要靶点,诱发热效应。其中血红蛋白受热变性、凝固,使异常血管闭塞,消除局部炎症源,是IPL主要的治疗原理[12,30]。强脉冲光治疗干眼的机制目前尚不明确,大多数学者认为其具有封闭睑缘异常血管及睑板腺的加热、液化达到疏通睑板腺的作用,还具有减少蠕形螨的附着及抗菌作用,目前主要运用于睑板腺功能障碍、蠕形螨睑缘炎相关干眼[12,31-32]。其有效性及安全性得以证实。
本研究发现两组患者OSDI评分及BCVA较治疗前明显改善,试验组的改善更为显著,但两组间比较无统计学意义,表明联合IPL治疗可改善coGVHD患者的症状。
此外有研究表明GVHD患者的眼睑皮肤松弛相比正常人程度更大,并认为这可能与泪液及眼睑中的MMP-7、MMP-9等弹性蛋白酶因子的上调,使眼睑弹性蛋白降解增加,从而眼睑的弹性纤维减少有关[33-34]。这可能导致coGVHD患者的睑缘位置不正及眨眼不完全,从而使泪液蒸发增加。研究表明IPL可促进成纤维细胞的增殖和新胶原纤维、弹性纤维的合成[35-36],同时使泪液中MMP-9减少[37],可能从机制上促使coGVHD的眼睑状态回复。这可能解释了本研究中IPL治疗coGVHD患者睑缘状态的改善。
睑板腺功能障碍是coGVHD最常见的表现之一,据报道发病率可达47.8%[38]。既往研究已表明coGVHD患者中的睑板腺损伤,使用共聚焦显微镜观察到淋巴细胞聚集、浸润、假膜形成导致的导管上皮细胞破坏及脱落,最终在睑板腺的孔口、小管、导管和腺泡周围出现广泛纤维化[24]。MGD患者发现睑板腺导管上皮的角化过度和睑脂的黏性增加,引发导管阻塞促使局部炎症反应,进一步致导管囊性扩张,直至萎缩[39]。既往研究观察到IPL治疗MGD患者的睑板腺分泌功能、睑板腺分泌物评分改善[40-41],将IPL应用到coGVHD患者中,仅在下睑发射光斑,观察到患者上下睑板腺分泌功能及睑板腺分泌物性状均改善,此与Toyos等[42]用于MGD的研究一致,并认为上睑板腺功能改善与眼眶血管系统的有益因子(抗氧化剂、抗炎因子、热休克蛋白)的传递和皮肤、结缔组织间的热传递有关。而通过Image J计算出睑板腺面积比例,观察到IPL治疗后coGVHD患者的下睑睑板腺面积比例的增加,而上睑睑板腺面积比例较治疗前增加,但差异无统计学意义,这与既往研究不同,Huo等[21]发现治疗干燥综合征相关干眼(SS-DE)后下睑睑板腺缺失无明显改善,Toyos等[42]发现IPL治疗MGD后下睑睑板腺缺失评分无明显改善,而上睑睑板腺缺失面积评分较前改善,但差异无统计学意义。肖宇等[43]IPL联合睑板腺按摩治疗MGD患者发现上下睑板腺缺失评分无明显改善。Hwang等[44]回顾37例诊断为眼移植物抗宿主病的患者后发现睑板腺可能不会受到不可逆转的损伤,可能进一步解释了coGVHD患者的睑板腺损伤与SS-DE和MGD所致的睑板腺损伤的不同,coGVHD的核心可能在于炎症。
IPL同时具有抗炎作用,D’Souza等[37]在利用IPL治疗睑板腺功能障碍的顽固性干眼患者中测量泪液细胞因子水平,发现泪液中IL-1β、IL-17F、MMP-9及 MMP-9/TIMP-1水平降低;同样Gao等[45]发现IPL治疗后的泪液中炎症细胞因子的下降。对其免疫炎症方面是否有作用尚待明确,Di Marino等[46]发现IPL联合低强度光治疗干燥综合征相关干眼(SS-DE)的BUT、OSDI等临床指标的改善,同样Huo等[21]也同样报道了IPL联合睑板腺按摩对于SS-DE患者具有良好的效果。既往研究中,Wang等[47]研究发现环孢素滴眼液对于coGVHD患者眼表状态的改善,目前环孢素滴眼液成为治疗coGVHD的一线抗炎药物[9]。在本研究中,对照组中BUT、CFS、CLGS较治疗前改善表明使用人工泪液和环孢素滴眼液治疗coGVHD有效性,此与既往研究结果一致[47],但联合IPL治疗后眼表指标的改善更明显,可能源于IPL的抗炎及增加泪膜的稳定性的作用。IPL对于coGVHD炎症的直观作用仍然不明。
CD8+和CD4+T细胞浸润coGVHD患者泪腺中导管的上皮,导致组织损伤,并产生炎症反应,导致泪腺导管的纤维化,进一步引起泪液分泌减少[1,4]。既往研究表明环孢素滴眼液可使SⅠt增加[48],本研究无论是对照组还是试验组均未出现SⅠt实测值统计学意义的升高,可能本研究纳入的均为严重的病例,这也与Wang等[47]研究结果一致。但患者的TMH较治疗前改善,可能由于炎症改善,泪膜稳定性改善,泪液蒸发减少,从而增加了TMH。
既往研究报导[10]IPL可能引起患者治疗区域皮肤烫伤、红肿、睫毛脱落等不良反应,但本研究随访期间并未观察到患者出现上诉症状。
我们的研究发现IPL能有效改善患者眼表症状及体征,无明显副作用,具有安全性和有效性,且IPL对于重度coGVHD睑板腺功能的改善明显,同时增加泪膜稳定性。本研究存在不足:(1)本研究纳入的患者数量较少,观察周期较短,需要进一步扩大样本量研究;(2)患者上睑睑板腺功能及分泌物性状评分较前改善,但睑板腺面积无明显改善,可能由于观察周期太短;(3)另外传统观点认为IPL的主要治疗作用在于抗炎作用,本研究患者眼表状态的改善可能由于IPL的抗炎作用,但我们并未观察炎症因子水平的改变;(4)此外部分研究[49]发现coGVHD患者的角膜神经的减少及弯曲度增加,角膜神经改变是干眼的重要指标,下一步我们将更加深入的进行眼表炎症因子、角膜神经等研究。

