五子衍宗方免煎颗粒对实验性自身免疫性脑脊髓炎小鼠炎性反应的影响及机制
王旭,李艳荣,樊慧杰,孙芮芮,贾多,贾璐,吕建军,肖保国,马存根,4,柴智 (.山西药科职业学院中药系,山西 太原 000;.山西中医药大学基础医学院,山西 晋中 0069;.复旦大学华山医院神经病学研究所,上海 0005;4.山西大同大学脑科学研究所,山西 大同 07009)
多发性硬化(Multiple sclerosis,MS)以中枢神经系统慢性炎性脱髓鞘病变为特点,主要累及脊髓和白质,表现为神经功能缺损[1]。该疾病的发病具有遗传易感性,患者成年早期发病率高,且女性高于男性,大部分患者反复发作,伴随空间多发性和时间多发性,极易致残[2]。MS 的病理过程涉及炎性反应如γ 干扰素(IFN-γ)、肿瘤坏死因子α(TNF-α)、白细胞介素17(IL-17)等炎性因子的释放,大量炎性细胞浸润是MS 的病理特征,炎症在MS 的各个阶段都会导致脱髓鞘及组织损伤[3]。抑制炎性反应可有效延缓MS 的病程和进展[4]。实验性自身免疫性脑脊髓炎(Experimental allergic encephalomyelitis,EAE)模型是以特异性致敏的CD4+T 细胞介导为主的,以中枢神经系统内小血管周围出现单个核细胞浸润及髓鞘脱失为特征的自身免疫性疾病,是人类MS 的理想动物模型,被广泛应用于MS 的实验研究[5-6]。中医药在改善MS 患者疾病症状、稳定疾病发展及整体调节等方面具有独特优势[7]。本课题组前期研究表明,经典补肾名方五子衍宗丸能够改善EAE 小鼠神经功能评分[8],对脱髓鞘模型小鼠有促进再髓鞘化的作用[9],可能与降低炎症因子分泌进而改善炎性环境有关。故本研究拟基于EAE 小鼠模型进一步探讨五子衍宗方免煎颗粒对MS 炎性反应的影响及机制。
1 材料与方法
1.1 动物 8~10 周龄雌性C57BL/6 小鼠36 只,SPF级,体质量(20±2)g,购自北京维通利华实验动物科技有限公司,实验动物生产许可证号:SCXK(京)2017-0011。本实验经山西中医药大学伦理委员会批准,动物伦理审批号:2018DW116。动物适应性饲养1 周后进行实验。
1.2 药物及试剂 每1 g 五子衍宗方免煎颗粒由菟丝子(炒)0.56 g、枸杞子0.07 g、覆盆子0.139 g、盐车前子0.21 g、五味子(蒸)0.021 g 五味药组成,原方配伍比例为8∶8∶4∶2∶1。本研究所用五子衍宗方免煎颗粒均购自太原市同仁堂药店,批号:16091703。将五子衍宗方免煎颗粒研磨成微细粉末状,用0.9%生理盐水溶解配制成0.32 g·mL-1溶液备用,使用前充分摇匀。
髓鞘少突胶质细胞糖蛋白多肽35-55(MOG35-55),上海强耀生物科技有限公司,批号:9001;百日咳毒素,美国Sigma 公司,批号:231144;结核分枝杆菌,美国Becton Dickinson 公司,批号:231141;完全弗氏佐剂,美国Alexis 公司,批号:60301;HE染色试剂盒(货号:G1120-100),LFB 染色试剂盒(货号:M066),均购自北京索莱宝科技有限公司;IL-12(货号:DY406-05)、TNF-α(货号:DYDY419-05)、IFN-γ(货号:DY421-05)、IL-17(货号:DY410-05)ELISA 检测试剂盒,均购自美国R&D 公司;RNA 提取液(货号:G3013)、Servicebio®RT First Strand cDNA Synthesis Kit(货号:G3330)、2×SYBR Green qPCR Master Mix(货号:G3320),均购自武汉赛维尔生物科技有限公司;异丙醇(货号:80109218)、HyPure TMMolecular Biology Grade Water(货号:SH3053802),美国HyClone 公司; TLR4、TNF-α引物,由北京擎科生物科技公司合成;Rho 蛋白激酶2(ROCKII)抗体,美国eBioscience 公司,批号:124024;磷酸化肌球蛋白磷酸酶(P-MYPT1)抗体,美国ENZO 公司,批号:E03110;核因子-κB/p65(NF-κB/p65)抗体,英国Abcam 公司,批号:ab124024;β 肌动蛋白(β-actin)抗体,美国Cell Signaling 公司,批号:4870S;HRP Goat anti-rabbit IgG,上海康为医疗科技发展有限公司,批号:01334/10412。
1.3 主要仪器 PowerPacTM型电泳仪、PowerPacTM型半干转膜仪、HOOD-Ⅱ型凝胶成像分析仪、CFX96型实时荧光定量PCR 仪器,美国Bio-Rad 公司;CM1950 型冰冻切片机、DM2000 型荧光显微镜,德国Leica 公司;NanoDrop2000 型超微量分光光度计,美国Thermo Fisher 公司;SpectraMax Plus 384 型酶标仪,美国Molecular Devices 公司。
1.4 模型复制 用生理盐水溶解MOG35-55配成水剂,用完全弗氏佐剂将结核分枝杆菌配成油剂,使用针管混合器把油剂与水剂按1∶1 充分混合,制成油包水样抗原乳剂,静置后无分层视为合格。于小鼠背部第4~5 节脊椎两侧选4 个点,皮下注射抗原乳剂(每只0.1 mL,MOG35-55含量为250 μg,结核分枝杆菌含量为350 μg);免疫当日和48 h 后,各组小鼠分别腹腔注射百日咳毒素(每只每次300 ng)。以小鼠尾张力下降为EAE 发病起始。
1.5 分组及给药[8]将36 只C57BL/6 小鼠随机分为正常组、模型组及五子衍宗方组(五子衍宗方免煎颗粒,16 g·kg-1·d-1),每组12 只。从免疫后第3 天开始灌胃(0.05 mL·g-1·d-1)给药,每天2 次,早晚间隔12 h,持续干预25 d;正常组和模型组小鼠给予等体积生理盐水(0.5 mL)灌胃。
1.6 神经功能评分 从免疫当天起,参考国际通用的5 分制评分[10],每日对各组小鼠进行神经功能评分。0 分:无症状;1 分:尾张力消失,轻度步态笨拙;2 分:单侧后肢无力,辅助翻身后恢复;3 分:双侧后肢均瘫痪无力,刺激后可稍有挪动;4 分:双侧后肢均瘫痪并伴有前肢单侧或双侧瘫痪;5 分:动物处于濒死或死亡状态。如症状介于两者之间的以±0.5 分计。
1.7 样品采集与处理 脾细胞悬液制备:实验第28 天,小鼠麻醉后在无菌条件下摘取完整脾脏,迅速置于高糖培养基(灭菌)中低温保存。随后于无菌操作台上,用注射器的无菌注射芯在0.7 μm 滤皿中将脾脏完全、充分研磨,剔除白色筋膜;加入1 mL 高糖培养基,连同脾细胞一起全部移入无菌离心管中;用台盼蓝染液对脾细胞进行计数。
脊髓组织冰冻切片制备:取出脾脏后,通过心脏灌注生理盐水至肝脏发白,然后推注4%多聚甲醛溶液灌流进行体内组织固定。分离脊髓,以OCT 包埋,在液氮中冷冻,用冰冻切片机制备厚度10 μm的脊髓冰冻切片。
1.8 HE 染色法检测脊髓炎性细胞浸润情况 取脊髓组织冰冻切片于水中浸泡2 min,苏木素染色5 min;快速水洗后,于0.5%盐酸乙醇分化5~15 s;快速水洗,伊红染色2 min;快速水洗,依次经70%、80%、90%、95%、100%乙醇梯度脱水;二甲苯透明,中性树胶封片,光镜下观察并分析脊髓白质区炎性细胞浸润面积占整个脊髓面积的比值。
1.9 LFB 染色法检测脊髓髓鞘脱失情况 取脊髓组织冰冻切片于95%乙醇中浸泡15 min 固定,然后浸入固蓝溶液中,60 ℃烤箱孵育过夜。次日取出切片,在95%乙醇溶液和去离子水中分别浸洗10 min;然后在0.05%碳酸锂溶液中快速浸洗10 s;于70%乙醇溶液中分化至肉眼能够清晰分辨灰白质;最后经浸洗、梯度乙醇脱水、二甲苯透明及中性树胶封片后,于光镜下观察并分析脊髓白质区髓鞘脱失面积占整个脊髓面积的比值。
1.10 ELISA 法检测小鼠脾细胞上清液中炎性因子水平 将各组小鼠脾细胞混悬液在常温下以1 500 r·min-1(离心半径8 cm)离心5 min,弃上清;移入10 mL 灭菌离心管中,PBS 冲洗后,以2 000 r·min-1(离心半径8 cm)离心10 min,弃上清;加入20 mL 含MOG的高糖培养基,在5% CO2培养箱中孵育48 h 后,离心取上清液,保存备用。严格按照ELISA 试剂盒说明书步骤操作,分别检测上清液中IFN-γ、TNF-α、IL-17、IL-12、IL-6 及IL-1β 含量。
1.11 qRT-PCR 法检测小鼠脾细胞TLR4、TNF-α mRNA 表达情况 取各组脾细胞悬液,采用TRIzol试剂提取总RNA,以紫外分光光度法检测总RNA 浓度及纯度。采用逆转录试剂盒进行逆转录反应制备cDNA,反应条件:25 ℃、5 min,50 ℃、15 min,85 ℃、5 min,4 ℃、10 min。然后进行荧光定量PCR 反应,取0.2 mL PCR 管,配制PCR 反应体系:7.5 μL 2×qPCR Mix、4.0 μL ddH2O、2.0 μL cDNA、正/反向引物各0.75 μL。PCR 扩增反应条件:95 ℃预变性10 min,95 ℃下变性15 s,60 ℃下退火30 s,共循环40 次;扩增循环结束后,降温至65 ℃,每15 s 升温0.3 ℃,升温至95 ℃完成熔解。反应结束后,计算Ct 值,以β-actin 为内参基因,采用2-△△Ct法计算目的基因相对表达水平。各基因合成引物序列见表1。
1.12 Western Blot 法检测小鼠脾脏ROCKII、P-MYPT1 及NF-κB 蛋白表达情况 4 ℃条件下,将小鼠脾脏组织加裂解液充分裂解,提取总蛋白,采用BCA 法测定蛋白含量。加Loading buffer 上样缓冲液制备样品,经SDS-PAGE 电泳、转膜后,用5%脱脂奶粉封闭1.5 h;洗涤后,分别加入一抗ROCKII、P-MYPT1、NF-κB 及β-actin 抗体,4 ℃下孵育过夜;次日洗膜后,加入相应二抗,室温下孵育2 h;洗涤后,以凝胶成像分析仪检测蛋白条带;采用Image Lab 3.0 软件进行灰度值比较,以β-actin 为内参,对目的蛋白进行半定量分析。
1.13 统计学处理方法 采用GraphPad Prism 8.0 统计软件进行数据分析;计量资料以均数± 标准差(±s)表示;多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t检验,不满足方差齐性则采用非参数检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 五子衍宗方免煎颗粒对EAE 小鼠神经功能的影响 结果见图1。与正常组比较,模型组小鼠在免疫后第10 天开始发病,平均起病时间为(11.20±1.10)d;小鼠开始出现精神萎靡不振、皮毛失泽不整,尾部及后肢肌力下降甚至出现瘫痪,平均最高神经评分为(3.50±0.35)分,神经功能评分显著升高(P<0.05,P<0.01)。与模型组比较,五子衍宗方组小鼠在免疫后第14 天开始发病,平均起病时间为(15.00±1.00)d,起病时间明显推迟(P<0.05);小鼠精神状态及相关症状得到明显改善,平均最高神经评分为(2.50±0.35)分,神经功能评分显著降低(P<0.05,P<0.01)。
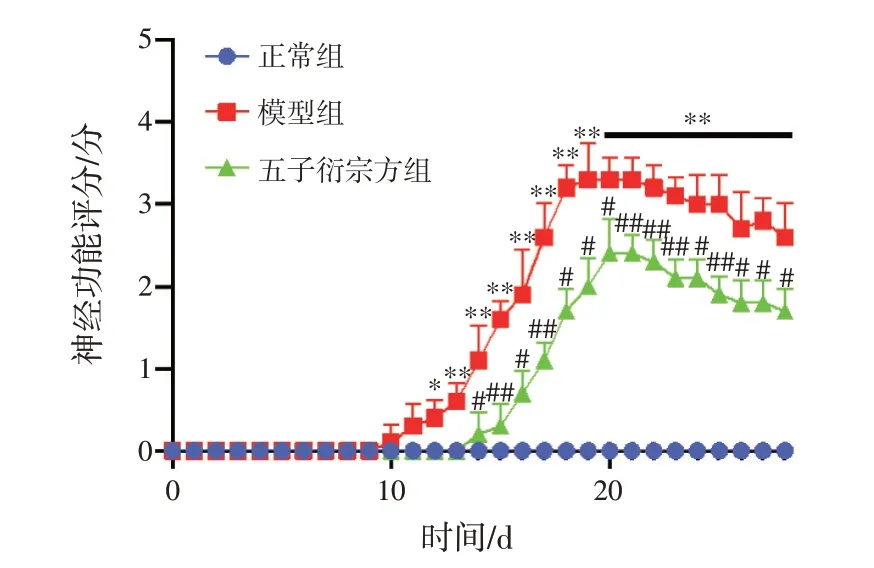
图1 各组小鼠的神经功能评分(±s,n=12)Figure 1 Neurological function score of mice in each group(±s,n=12)
2.2 五子衍宗方免煎颗粒对EAE 小鼠脊髓炎性细胞浸润的影响 结果见图2。正常组、模型组、五子衍宗方组小鼠脊髓白质区炎性细胞浸润面积占整个脊髓面积的比值分别为(0.56±0.11)%、(6.16±0.75)%、(3.79±0.25)%。与正常组比较,模型组小鼠脊髓炎性细胞浸润显著增加(P<0.001);与模型组相比,五子衍宗方组小鼠脊髓炎性细胞浸润显著减少(P<0.01)。
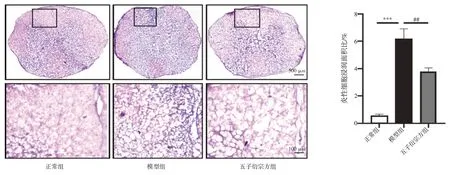
图2 各组小鼠脊髓炎性细胞浸润情况(HE 染色,×50,×200;±s,n=12)Figure 2 Infiltration of inflammatory cells in spinal cord of mice in each group(HE staining,×50,×200;±s,n=12)
2.3 五子衍宗方免煎颗粒对EAE 小鼠脊髓髓鞘脱失的影响 结果见图3。正常组、模型组、五子衍宗方组小鼠脊髓白质区髓鞘脱失面积占整个脊髓面积的比值分别为(1.77±0.58)%、(9.81±1.66)%、(4.12±0.67)%。与正常组比较,模型组小鼠髓鞘脱失显著增加(P<0.01);与模型组相比,五子衍宗方组小鼠髓鞘脱失显著减少(P<0.01)。
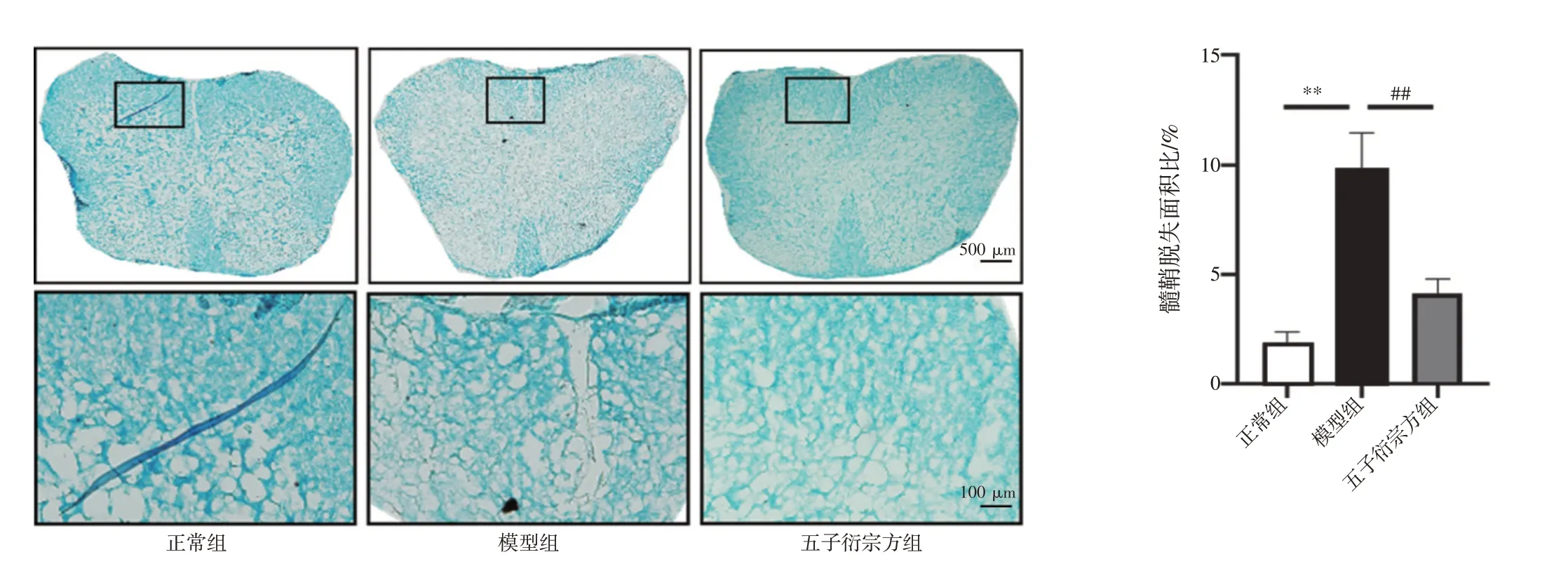
图3 各组小鼠脊髓髓鞘脱失情况(LFB 染色,×50,×200;±s,n=12)Figure 3 Demyelination of spinal cord in each group of mice(LFB staining,×50,×200;±s,n=12)
2.4 五子衍宗方免煎颗粒对EAE 小鼠脾细胞炎性因子表达水平的影响 结果见图4、图5。与正常组比较,模型组小鼠脾细胞IFN-γ、TNF-α、IL-17、IL-12、IL-6 及IL-1β 的表达水平显著上升(P<0.001);与模型组比较,五子衍宗方组小鼠脾细胞IFN-γ、TNF-α、IL-17、IL-12、IL-6 及IL-1β 的表达水平显著降低(P<0.01,P<0.001)。

图4 各组小鼠脾细胞炎性因子IFN-γ、TNF-α、IL-17 及IL-12 的表达情况(±s,n=6)Figure 4 Expressions of inflammatory factors IFN-γ,TNF-α,IL-17 and IL-12 in splenocyte of mice in each group(±s,n=6)
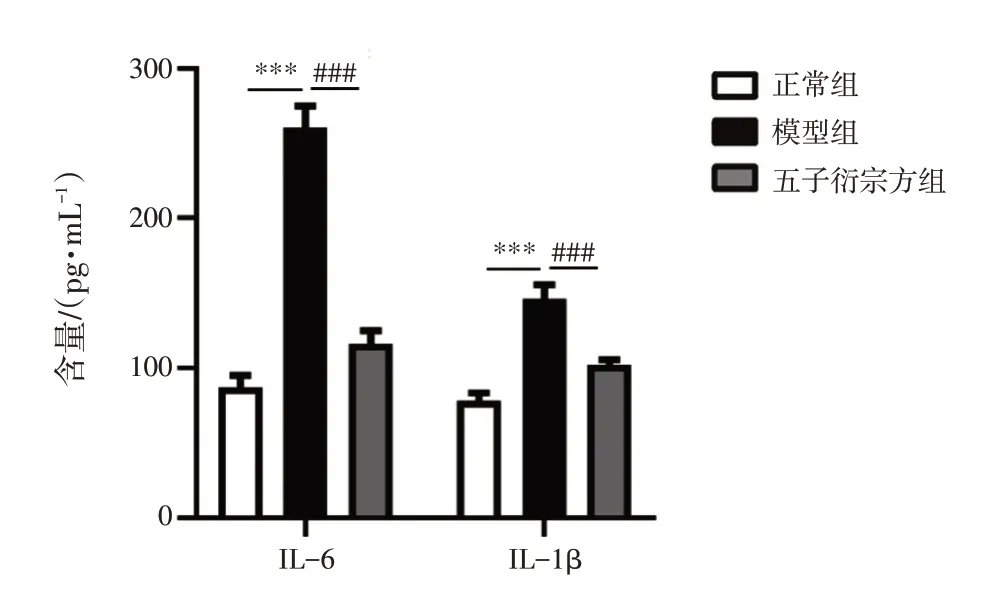
图5 各组小鼠脾细胞炎性因子IL-6、IL-1β 的表达情况(±s,n=6)Figure 5 Expressions of inflammatory factors IL-6 and IL-1β in splenocyte of mice in each group(±s,n=6)
2.5 五子衍宗方免煎颗粒对EAE 小鼠脾细胞TLR4、TNF-α mRNA 表达的影响 结果见图6。与正常组比较,模型组小鼠脾细胞TLR4、TNF-α mRNA 表达水平均显著上升(P<0.01,P<0.001);与模型组比较,五子衍宗方组小鼠脾细胞TLR4、TNF-α mRNA表达水平均显著降低(P<0.01,P<0.001)。

图6 各组小鼠脾细胞TLR4、TNF-α mRNA 表达情况(±s,n=3)Figure 6 The mRNA expressions of TLR4 and TNF- α in splenocyte of mice in each group(±s,n=3)
2.6 五子衍宗方免煎颗粒对EAE 小鼠脾脏组织ROCKII、P-MYPT1、NF-κB 蛋白表达的影响 结果见图7。与正常组比较,模型组小鼠脾脏ROCKII、P-MYPT1、NF-κB 蛋白表达量显著升高(P<0.01,P<0.001);与模型组比较,五子衍宗方组小鼠脾脏ROCKII、P-MYPT1、NF-κB 蛋白表达量均显著降低(P<0.01)。

图7 各组小鼠脾脏组织ROCKII、P-MYPT1、NF-κB 蛋白表达情况(±s,n=3)Figure 7 The protein expressions of ROCKII,P-MYPT1 and NF-κB in splenic of mice in each group(±s,n=3)
3 讨论
多发性硬化(MS)因病变累及部位的空间多发性而导致临床症状广泛,主要表现为肢体麻木无力、肌力减退、共济失调、自主神经功能紊乱及精神障碍等[11]。中医将MS 归属为“痿证”“痹证”范畴,认为病位在“脑与髓”,“肾虚”是本病的根本病因,五子衍宗方具有补肾益精之功效[12],可用于本病的治疗。本研究表明,五子衍宗方免煎颗粒能够明显延长EAE 小鼠的发病时间,降低神经功能评分,显示出治疗效果。此外,MS 的病理表现无论在急性期还是缓解期均有广泛的白质炎性脱髓鞘[13]。其病灶部位不仅局限于白质区域,皮层也有受累,随疾病进程,炎性细胞浸润和髓鞘脱失持续恶化[14]。本研究通过病理学观察表明,EAE 模型组小鼠脊髓呈现大量炎性细胞浸润和脱髓鞘现象,五子衍宗方免煎颗粒干预后,脊髓白质炎性细胞浸润及脱髓鞘程度显著减轻。由此可见,五子衍宗方免煎颗粒治疗可明显缓解EAE 小鼠的临床神经功能症状,减轻脊髓炎性病变及髓鞘脱失,具有神经保护作用。
MS 是主要由CD4+Th1 细胞介导的炎性脱髓鞘疾病,Th 细胞分化促进炎性因子释放,机体产生炎性病变[15]。IL-17 是一种高度致炎细胞因子,能启动和刺激炎性细胞产生;IFN-γ 是EAE 发病的关键致病因子,可释放TNF-α 等介质并引起脱髓鞘;TNF-α、IL-6 及IL-1β 能刺激巨噬细胞释放炎性介质;IL-12 在Th1 细胞分化中起重要作用,抑制IL-12 可调控Th1 细胞分化,减轻EAE 的病理变化[16]。研究[17]证实,MS 患者血清和脑脊液中炎性因子水平的升高与临床发病进程密切相关。TLR4 是Toll 样受体家族成员,分布广泛,表达于中枢神经系统多种细胞中[18]。研究[19]证明,TLR4 在炎性反应中起着关键作用,可通过启动相应的炎性反应参与识别和清除病原微生物。TLR4 介导的神经炎性反应参与了MS 的发生发展[20],激活TLR4 会产生高水平的促炎因子,造成髓鞘损伤[21]。在MS 患者和EAE 小鼠的脊髓中,TLR4 表达水平均明显升高,而抑制TLR4 表达对延缓EAE 的发生有一定作用[22]。因此,减轻炎性反应是缓解和治疗MS 的重要策略。本研究结果显示,EAE 小鼠脾细胞的IFN-γ、TNF-α、IL-17、IL-12、IL-6 及IL-1β 水平均显著升高,TLR4 基因表达亦显著上调,提示小鼠体内存在严重炎性反应;而五子衍宗方免煎颗粒干预后,炎性因子及炎性受体的表达水平均显著下调。
MS 的病理改变与Rho/ROCK 信号通路的激活有关[23]。在中枢神经系统中,Rho/ROCK 信号通路激活后,可进一步激活效应底物ROCKII,刺激效应分子P-MYPT1 产生,促进炎性反应[24]。Rho 激酶抑制剂可下调NF-κB 表达,减轻炎性反应,减少炎性细胞浸润,促进髓鞘再生[25]。本研究结果显示,五子衍宗方免煎颗粒可抑制EAE 小鼠脾脏组织NF-κB、ROCKII 及P-MYPT1 蛋白表达,提示其可能通过抑制Rho 及NF-κB 信号通路的激活来抑制炎性反应。
综上所述,五子衍宗方免煎颗粒能够改善EAE小鼠的神经功能,减少炎症浸润及脱髓鞘等病理损害,具有神经保护作用,其作用机制可能与抑制Rho及NF-κB 信号通路,降低相关炎性因子水平有关。

