CCNA1在甲状腺癌组织中的表达及其与甲状腺癌预后关系的研究
马孝广,王 艳,高 威,张年庆
(蚌埠医学院第一附属医院肿瘤外科,安徽 蚌埠 233000)
甲状腺癌为临床常见恶性肿瘤,研究显示,甲状腺癌的发病率逐年升高,预计将成为全球第四大癌症类型[1]。流行病学研究表明,甲状腺癌最常见的组织学类型是乳头状癌,约占甲状腺癌的80%[2]。目前,伴随医疗技术的发展和诊疗技术水平的提升,甲状腺癌患者的总体生存率也有所提高,但新增病例的不断出现引起了国内外医学界的高度关注。得到证实的是,年龄、性别、环境、遗传等患者基础资料以及病理类型、临床分期、免疫因素、淋巴结转移、分子生物学等临床资料均是影响甲状腺癌发生发展以及预后质量的主要影响因素[3]。伴随分子生物学研究的进展,从分子水平探究甲状腺癌的发病机制研究逐步开展,这为甲状腺癌的分子诊断、预后判断及分子靶向治疗奠定了理论基础。因此,在甲状腺癌的临床研究领域,寻找合适的靶点,针对甲状腺癌细胞的精准治疗是该领域的研究热点。我们开展该项研究的目的,是探索协助甲状腺癌诊治和判断预后的分子标志物,以期指导在肿瘤转移的某个阶段进行医学干预,为阻断或延迟甲状腺癌的转移提供潜在的诊疗手段提供依据,从而达到治疗的效果。
1 资料与方法
1.1 一般资料104例甲状腺癌组织病理标本均来源于本院2016年1月至2017年9月期间收治的、术后确诊为甲状腺癌的患者。所有研究对象均经病理学确诊,并有完整的随访资料。其中男58例,女46例;年龄33~71岁,平均年龄(60.5±10.4)岁。入组样本均符合巴西病理学会(BSP)的甲状腺癌诊断标准。纳入标准:经病理切片证实为甲状腺癌;临床资料完整;术后均接受甲状腺激素抑制治疗。排除标准:伴重要脏器(心、肝、肾等)功能障碍;合并其他恶性肿瘤;妊娠及哺乳期女性;临床资料缺乏;伴严重免疫缺陷性疾病。纳入本研究的临床病理学标本均经患者签字同意后使用,本研究方案经本院医学伦理委员会批准通过。
1.2 CCNA1蛋白表达检测采用免疫组织化学染色法,检测甲状腺癌组织中CCNA1蛋白的表达情况。将检测标本制成石蜡切片,经烤片、脱蜡、水化等流程后,进行抗原修复,经3%的过氧化氢阻断标本中的内源性过氧化物酶进行封闭。随后经血清、一抗、二抗作用,DAB显色,苏木素复染,乙醇与二甲苯透明,中性树胶封片后光镜下观察。CCNA1蛋白阳性染色定位于细胞核中,阳性物质呈棕黄色或棕褐色。根据甲状腺癌组织CCNA1蛋白表达检测结果进行分组,将CCNA1蛋白表达阳性的病例设为阳性组(55例),将CCNA1蛋白表达阴性的病例设为阴性组(49例)。
1.3 观察指标
1.3.1 CCNA1蛋白表达与甲状腺癌临床病理特征的关系 收集研究对象的临床资料(性别、年龄、肿瘤直径、病理类型、TNM分期、分化程度、淋巴结转移、包膜侵犯)。分析CCNA1蛋白表达与甲状腺癌临床病理特征的关系。
1.3.2 CCNA1蛋白表达与甲状腺癌患者预后的关系分析 所有研究对象随访时间≥60个月。比较两组无进展生存期(Progression-free survival,PFS)、总生存期(Overall survival,OS)。PFS定义为:从接受术后甲状腺激素抑制治疗开始,到病人出现肿瘤进展或死亡的时间。OS定义为:从接受术后甲状腺激素抑制治疗开始,到患者死亡的时间或末次随访时间。
1.4 统计学处理采用SPSS 25.0软件进行数据分析,正态计量数据用“均数±标准差”表示,两组独立,正态,方差齐资料组间比较采用t检验。计数资料采用例数或百分比表示,两组间比较采用卡方检验。两组间生存分析差异应用Log-rank法进行检验。检验水平(α)=0.05。
2 结果
2.1 CCNA1蛋白免疫组化染色结果CCNA1蛋白阳性表达呈现为细胞核内棕黄色颗粒,见图1A、图1B。CCNA1蛋白阴性组的免疫组化染色结果显示,细胞核内无棕黄色颗粒染色,见图1C、图1D。

图1 CCNA1蛋白表达
2.2 CCNA1蛋白表达与甲状腺癌临床病理特征的关系由表1中的内容可知,CCNA1蛋白表达情况与甲状腺癌患者的性别、年龄、病理类型、包膜侵犯情况无关(两组间各指标构成比情况无明显差异)(P>0.05)。CCNA1蛋白表达情况与甲状腺癌患者的肿瘤直径、TNM分期、分化程度、淋巴结转移情况密切相关。经统计,肿瘤直径≥4 cm、TNM分期为III/IV期、分化程度低、有淋巴结转移的患者,CCNA1蛋白表达阳性的构成比更高(P<0.05)。
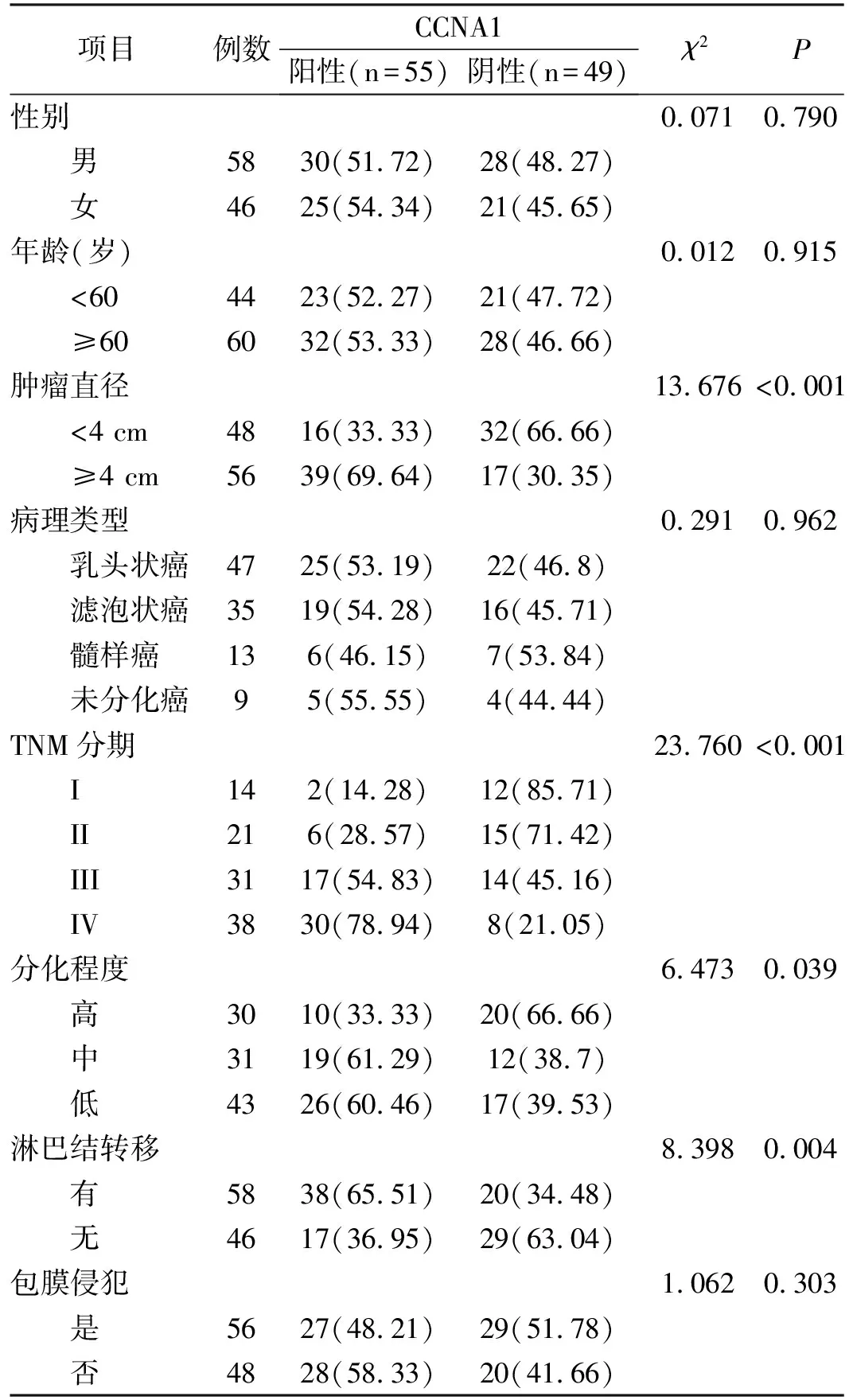
表1 CCNA1蛋白表达与甲状腺癌临床病理特征的关系
2.3 CCNA1蛋白表达与甲状腺癌患者预后关系分析设置随访截止日期为2022年9月,CCNA1蛋白表达阴性组出现终点事件(死亡)2例,CCNA1蛋白表达阳性组出现终点事件(死亡)8例。总体5年生存率为90.38%。CCNA1蛋白表达阴性组中位OS为64.61个月(95%CI:62.73~66.50);CCNA1蛋白表达阳性组中位OS为62.86个月(95%CI:60.77~64.94)。阳性组中位OS短于阴性组,组间差异有统计学意义(χ2=3.906,P=0.048),见图2。CCNA1蛋白表达阴性组中位PFS为59.02个月(95%CI:56.33~61.72);CCNA1蛋白表达阳性组中位PFS为54.67个月(95%CI:51.33~58.01)。阳性组中位PFS短于阴性组,组间差异有统计学意义(χ2=4.351,P=0.037),见图3。

图2 甲状腺癌患者OS生存分析
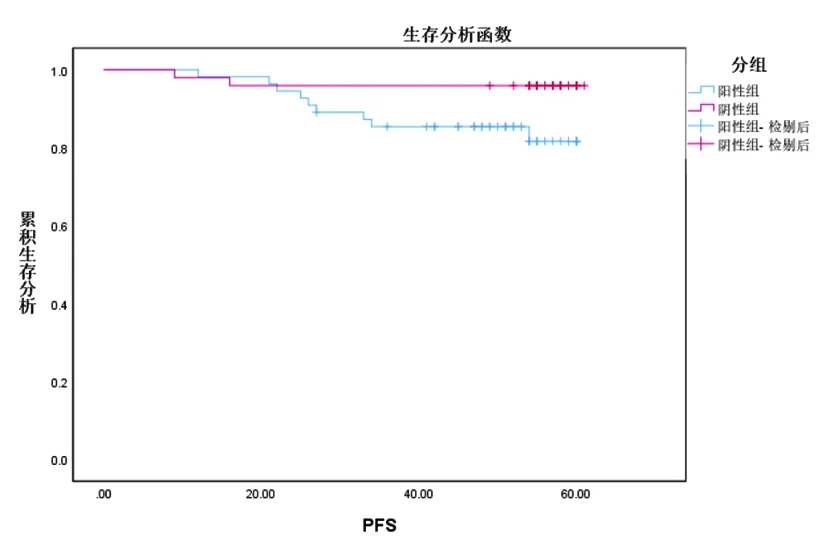
图3 甲状腺癌患者PFS生存分析
3 讨论
目前临床常见的甲状腺癌诊断方法包括病理学指标、影像学、生化检验等,各诊断方法的诊断结果均存在一定的不确定性,这提示我们需要更新、更高效和敏感的方法来协助诊断。分子标志物往往是以一系列化合物的形式存在,在临床诊断中具有灵敏度和稳定性高的特点,被视为相关疾病的诊断和预后评价工具[4-5]。
CCNA1蛋白由CCNA1基因编码,是一种重要的细胞周期调节因子,属于MAPK/ERK信号通路,直接参与甲状腺癌的发生[6]。有研究结果表明,抑癌基因启动子的异常甲基化发生在多种肿瘤疾病的发生发展过程中,这也是癌细胞致病的一种普遍现象[7]。由启动子甲基化引起的抑癌基因的表观遗传沉默在肿瘤发生过程中起着重要作用。一项荟萃分析表明:在白种人和亚洲人群中,CCNA1甲基化与人类恶性肿瘤不良进展之间存在显著联系[8]。人类CCNA1基因编码的CCNA1蛋白属于高度保守的细胞周期蛋白家族,在与细胞周期调节因子(转录因子E2F-1、P21家族蛋白等)结合后,可参与细胞周期的调控过程。有学者在研究中发现,宫颈癌患者中普遍存在CCNA1甲基化的现象,且这种甲基化的现象与病情发展的病理阶段密切相关[9]。具体来看,正常细胞内未出现CCNA1甲基化的现象,而在鳞状上皮内瘤变、浸润性癌组织中,可见显著的CCNA1甲基化现象。且宫颈组织损伤的严重程度与CCNA1的甲基化程度呈显著正相关[10]。另有研究表明,在小鼠肿瘤模型中,CCNA1表达水平较高的组别,发生肿瘤细胞浸润至肺、肝、淋巴结的构成比较高;而CCNA1表达水平较低的组别几乎无此现象发生[11]。这些结果均表明,CCNA1可能是癌侵袭和转移的一个关键调节因子,CCNA1的高表达最终为肿瘤的生长提供了良好的环境。
在甲状腺癌的研究领域,CCNA1在肿瘤的进展中起到至关重要的作用的研究也在逐步开展。最近的研究表明,CCNA1基因编码的CCNA1蛋白在甲状腺乳头状癌中存在过表达的现象,CCNA1基因可作为甲状腺乳头状癌的潜在诊断标记物[12-13]。该蛋白在不同类型甲状腺癌中的表达情况及其与肿瘤患者预后的关系以及该蛋白促进肿瘤侵袭转移机制仍未明确。我们开展该项研究目的在于探索CCNA1在甲状腺癌进展中的作用及其可能的分子机制,以期为甲状腺癌的诊断和靶向治疗提供分子理论基础。本研究由于客观条件的限制,未对正常组织和甲状腺癌组织中的CCNA1表达情况进行统计与比较,仅对CCNA1蛋白表达与甲状腺癌临床病理特征进行了分析。分析结果显示,CCNA1蛋白表达情况与甲状腺癌的肿瘤直径、TNM分期、分化程度、淋巴结转移情况密切相关。肿瘤直径越大、TNM分期越高、分化程度越低、存在淋巴结转移的患者CCNA1蛋白的阳性表达率越高。说明CCNA1蛋白表达水平升高可能是甲状腺癌发生发展过程中的重要事件,CCNA1蛋白可能具有明显的促癌作用。预后生存分析的研究结果则提示,CCNA1蛋白表达阳性组中位PFS、中位OS均明显短于阴性组。在一定层面上证实了CCNA1蛋白表达水平升高与甲状腺癌预后较差之间的密切关系。
综上所述,CCNA1蛋白表达与甲状腺癌肿瘤直径、TNM分期、分化程度、淋巴结转移情况、预后等均有密切关系。CCNA1蛋白表达异常可能是甲状腺癌发生发展过程中的重要影响因素,但目前引起CCNA1基因水平上调的机制尚未完全清楚,关于CCNA1的具体促癌作用机制尚需深入研究。

