SUMO修饰IFNγ信号转导域偶联截短型TGF-β II型受体的融合蛋白可溶性表达条件优化
董溢馨,王小花,刘海峰
(牡丹江医学院 1.生命科学学院;2.基础医学院,黑龙江 牡丹江 157011)
肝纤维化(Liver fibrosis,LF)是慢性肝损伤后组织过度修复反应的结果,主要表现为细胞外基质(extracellular matrix,ECM)的过度产生和沉积[1]。活化的肝星状细胞(activated hepatic stellate cells,aHSCs)中转化生长因子-β1(transforming growth factor-beta 1,TGF-β1)过量产生激活TGF-β1/Smad信号通路促使肝纤维化发生[2],在TGF-β1/Smad介导的信号通路中,TGFβ1与细胞膜表面TGF-β Ⅱ型受体(transforming growth factor-β receptor type Ⅱ,TβRⅡ)结合使自身磷酸化,进而募集TGF-β Ⅰ型受体(transforming growth factor-β receptor type Ⅰ,TβRⅠ)形成三聚体复合物TGF-β1/TβRⅠI/TβRⅡ,促进Smad2/3磷酸化形成p-Smad2/3,进一步与Smad4结合形成复合体进入细胞核调节相应纤维化相关基因转录和表达[3]。此外在TGF-β1/Smad信号通路中存在一个负调节因子Smad7,Smad7的高表达可抑制Smad2/3磷酸化而抑制纤维化的发生[4]。aHSCs可通过分泌TGF-β1加剧肝纤维化的发生发展,因此被认为是肝纤维化的关键细胞。另外,与静态期肝星状细胞(quiescent hepatic stellate cells,qHSCs)相比,aHSC表面血小板衍生生长因子β受体(platelet derived growth factor-β receptor,PDGFRβ)表达显著增加,因此PDGFRβ成为靶向抗纤维化药物递送的靶点[5]。以上研究表明,靶向aHSC并双重抑制细胞中TGF-β1/Smad信号转导的抗纤维化药物设计策略,不但可提高治疗效率,而且还可降低副作用,已越来越引起研究者的关注。
研究发现,截短型TGF-β Ⅱ型受体(truncated transforming growth factor-β receptor type II,tTβRII)和具有信号转导功能的干扰素γ信号转导域(interferon gamma peptidomimetic,mIFNγ)通过不同方式抑制TGF-β1/Smad信号转导达到抗纤维化的作用[6-7],具体表现为:tTβRⅡ与细胞膜表面野生型TβRⅡ竞争性结合TGFβ1,下调p-Smad2/3的水平而抑制肝纤维化;而mIFNγ可上调Smad7蛋白表达从而下调p-Smad2/3的水平而发挥抗纤维化功能。因而,课题组前期先将mIFNγ与tTβRⅡ偶联,进一步被可结合PDGFRβ的多肽BiPPB修饰,构建成理想的抗肝纤维化成蛋白药物BiPPB-mIFNγ-tTβRⅡ,以使药物靶向递送至aHSCs发挥双重抑制TGF-β1/Smad信号转导功能。
研究发现,小分子泛素相关修饰物(small ubiquitin-related modifier,SUMO)修饰的蛋白不但可增强目的蛋白可溶性表达,而且可保护其不被蛋白酶降解[8-9]。因此我们将SUMO修饰BiPPB-mIFNγ-tTRβⅡ形成SUMO-BiPPB-mIFNγ-tTRβⅡ,以期其在宿主细胞中高可溶性表达。
本实验以课题组前期构建SUMO-BiPPB-mIFNγ-tTRβⅡ质粒为研究对象,通过改变异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactopyranoside,IPTG)浓度、诱导温度和时间对其可溶性表达条件进行优化,为进一步制备生物活性的蛋白和后续功能研究奠定基础。
1 材料和方法
1.1 主要试剂与仪器大肠杆菌Rosetta/pET28a/SUMO-BiPPB-mIFNγ-tTRβⅡ(本实验室保存);蛋白胨(Oxoid公司);氯化钠(Sigma-Aldrich公司);酵母提取物(Oxoid公司);异丙基-β-D-硫代半乳糖苷(上海浩然生物技术有限公司);硫酸卡纳霉素(Solarbio公司);恒温摇床(上海知楚仪器有限公司);电泳仪(BIO-RAD公司)。
1.2 不同诱导条件下重组蛋白的全菌表达将大肠杆菌Rosetta/pET28a/SUMO-BiPPB-mIFNγ-tTRβⅡ于含有卡纳霉素的LB培养基中过夜活化,按照1∶100的比例将活化菌液加入LB培养基,37 ℃、210 rpm/min条件下培养3.5 h(OD600约为0.8)后,加入终浓度分别为0.1、0.3、0.6或1 mmol/L的IPTG,同时在37 ℃、6 h,16 ℃、16 h或20 ℃、20 h条件下培养,同时以不加IPTG的未诱导菌液为对照组。收集未诱导菌和诱导菌500 μL,12 000 rpm/min离心弃掉培养基,PBS重悬,将其与SDS上样缓冲液混合煮沸10 min,SDS-PAGE电泳分析全菌蛋白表达。
1.3 不同诱导条件下重组蛋白的可溶性表达按上述诱导方法,取诱导菌3 mL,12 000 rpm/min离心弃掉培养基,PBS重悬,进一步冰浴超声破碎(功率200 W,超声5 s,暂停5 s为1个循环,进行3个循环)后,12 000 rpm/min离心取上清,沉淀用PBS重悬,取蛋白样品分别与SDS上样缓冲液混合煮沸10 min,SDS-PAGE电泳鉴定分析可溶性蛋白表达。
1.4 蛋白表达结果分析融合蛋白在全菌中表达和可溶性表达实验均重复三次,使用ImageJ软件分析SDS-PAGE凝胶中目的蛋白的表达。
1.5 统计学分析使用GraphPad Prism 8.0.2 进行统计学分析,定量数据采用“均值±标准差”表示,组间差异进行单向方差分析,采用Dunnett检验进行多重比较,P<0.05 认为具有统计学意义。
2 结果
2.1 重组蛋白在全菌中的表达分析经不同条件诱导后,SDS-PAGE分析融合蛋白在全菌中表达情况。结果表明:与未诱导菌液相比,诱导后菌液中目的蛋白在全菌中获得表达,分子量约为38 kDa,如图1A,B和C所示。进一步经凝胶电泳图像分析,结果表明,在16℃,0.1、0.3、0.6或1 mmol/L的IPTG诱导16 h后,目的蛋白占全菌蛋白的含量分别为14.14%、15.24%、14.27%和11.31%(图1D);在20℃,0.1、0.3、0.6或1 mmol/L的IPTG诱导20 h后,目的蛋白占全菌蛋白含量分别为13.79%、14.68%、16.69%和13.71%(图1E);在37 ℃,0.1、0.3、0.6或1 mmol/L的IPTG诱导6 h后,目的蛋白占全菌蛋白含量分别为12.23%、11.27%、9.29%和7.72%(图1F)。由以上结果可见,20 ℃、0.6 mmol/L IPTG诱导20 h菌液中目的蛋白在全菌蛋白的含量最高,约为16.69%。
2.2 重组蛋白的可溶性表达分析收集诱导菌液进行超声破碎,进一步将破碎后的沉淀和上清经SDS-PAGE分析融合蛋白在不同诱导条件下的可溶性表达,如图2A,B和C所示。结果表明,在不同诱导条件下,超声破碎后的上清总蛋白中均有目的蛋白表达,以可溶性表达形式存在,但表达量有差异,具体为:在16 ℃,0.1、0.3、0.6或1 mmol/L的IPTG诱导16 h后,目的蛋白占上清总蛋白分别为18.64%、15.35%、18.58%和16.81%(图2D);在20 ℃,0.1、0.3、0.6或1 mmol/L的IPTG诱导20 h后,目的蛋白含占上清总蛋白分别为14.83%、12.84%、20.24%和13.84%(图2E);在37 ℃,0.1、0.3、0.6或1 mmol/L的IPTG诱导6 h后,目的蛋白占上清总蛋白分别为11.93%、8.17%、8.24%和8.52%(图2F)。由以上结果可见,20 ℃、0.6 mmol/L IPTG诱导20 h后上清中目的蛋白表达含量较高,占上清总蛋白含量的为20.24%。
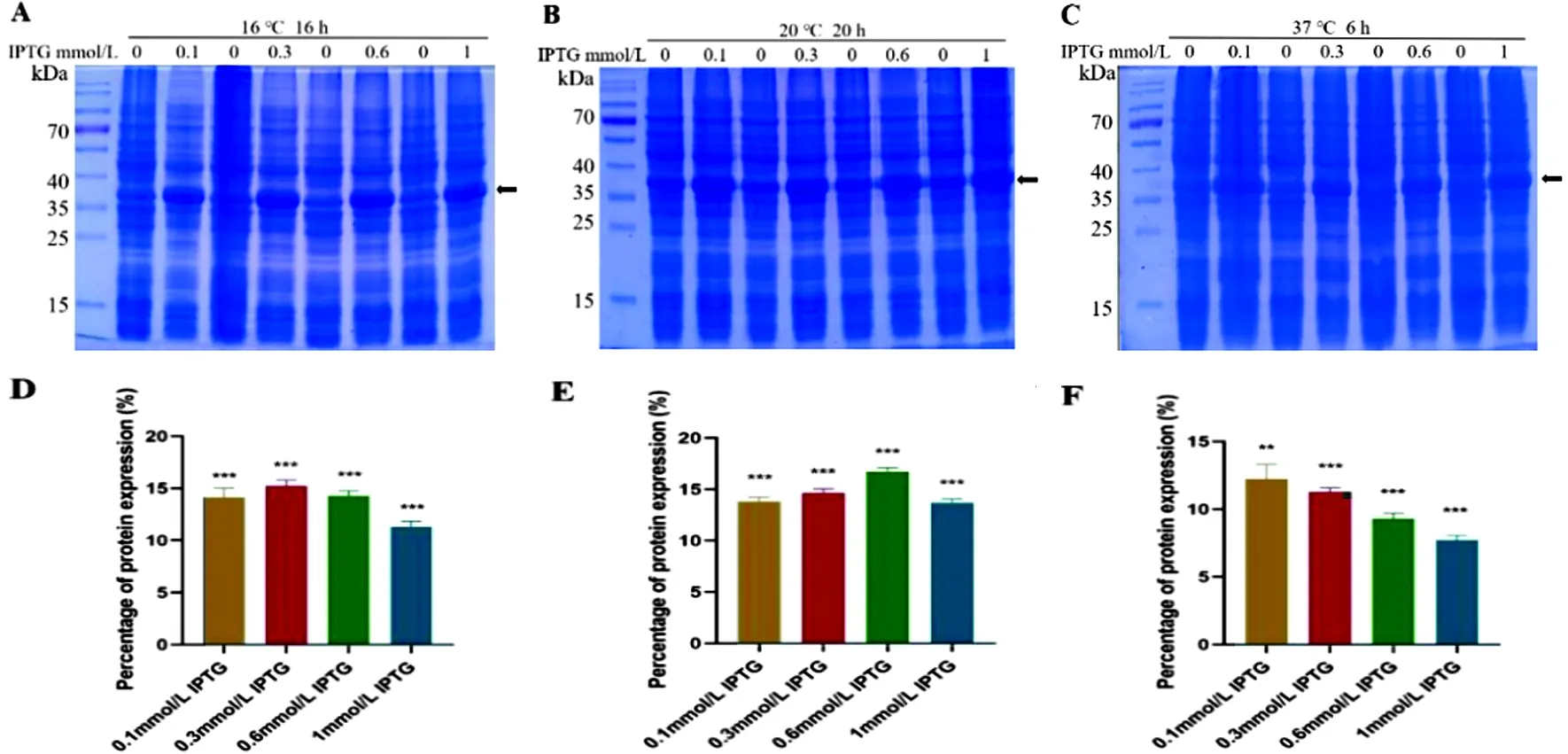
图1 SDS-PAGE分析在不同诱导条件下融合蛋白在全菌中表达
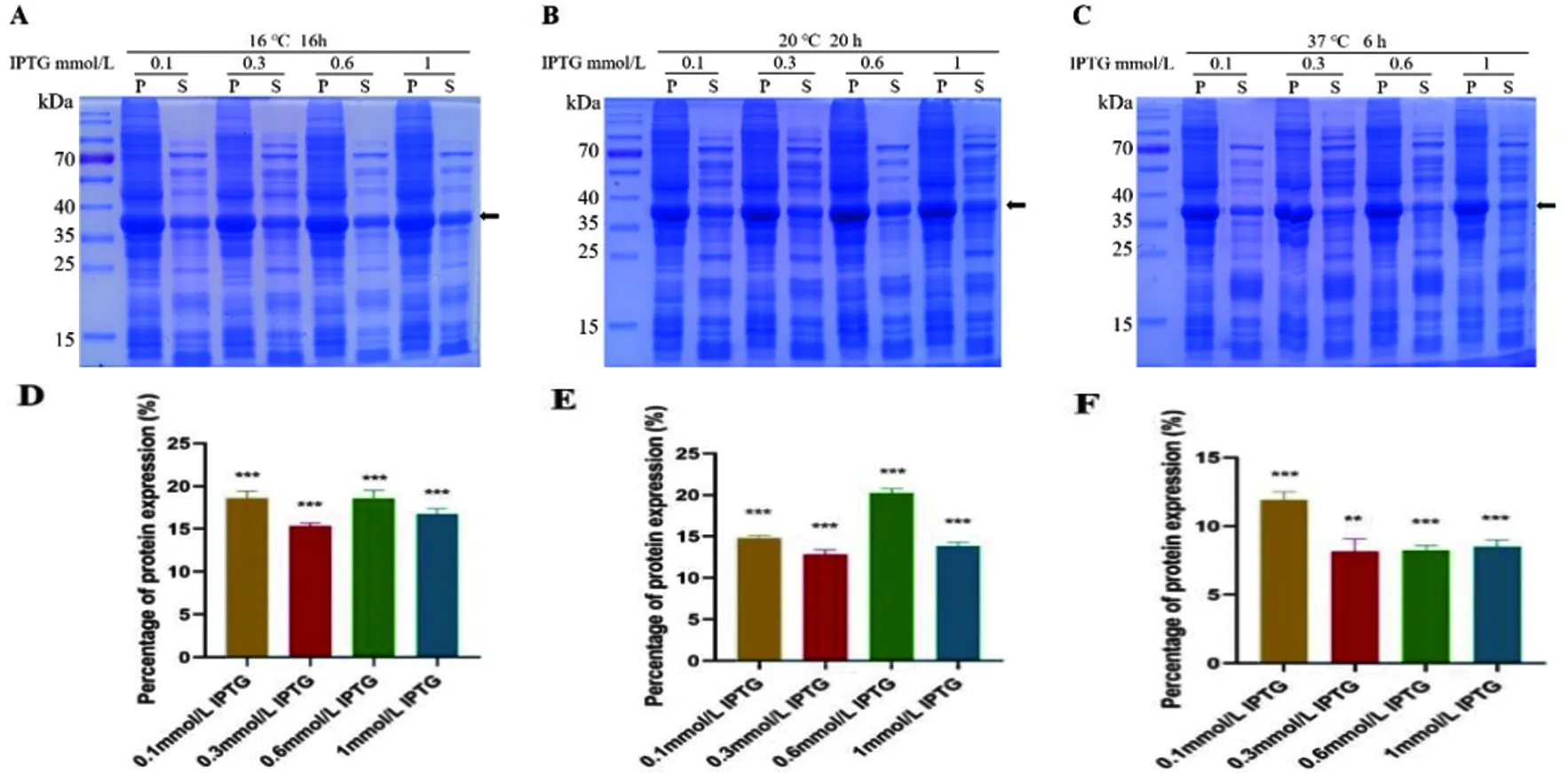
图2 SDS-PAGE分析融合蛋白在不同诱导条件下的可溶性表达
3 讨论
肝脏受到慢性或持续性损伤时可引起慢性肝脏炎症,进一步过量产生和异常沉积ECM,最终导致纤维瘢痕形成而发展至肝纤维化[10]。肝纤维化的病理过程受多种信号通路调控,其中TGF-β1/Smad信号通路在肝纤维化的发生发展中起关键作用。研究表明,肝纤维化是一种可逆的病理反应,因而及时防治肝纤维化可预防慢性肝病发展为肝硬化和肝癌。因此,肝纤维化治疗药物的研发成为近年来研究的热点。
TGF-β1/Smad信号通路与纤维化的进程和发展密切相关。过表达的TGF-β1与TβRⅡ和TβRⅠ结合形成三聚体复合物,通过p-Smad2/3蛋白表达增加和Smad7蛋白表达降低,引起纤维化的发生[2-3]。课题组前期筛选的tTβRⅡ由于保留TGF-β1的结合域并删除信号转导域,因而外源性tTβRⅡ与TGF-β1的结合,仅保留结合不发生下游的信号转导,通过抑制TGF-β1与野生型TβRⅡ结合,进而弱化TGF-β1/Smad信号通路的转导达到抗纤维化的作用[11]。而mIFNγ为保留IFNγ传导域和删除其受体结合域,因而外源性mIFNγ促进Smad7蛋白表达,进而抗肝纤维化的功能,同时由于删除其受体结合域,避免与正常细胞表面IFNγ受体(IFNγR)结合而引起副作用[7]。依据上述研究结果[6-7,11],本实验室前期成功构建新型的抗肝纤维化的融合蛋白的质粒BiPPB-mIFNγ-tTRβⅡ,其将mIFNγ和tTRβⅡ基因偶联并进行BiPPB修饰,通过BiPPB与过表达的PDGFRβ结合而靶向aHSC,进而分别抑制Smad2/3磷酸化和促进Smad7蛋白表达,达到双重抑制TGF-β1/Smad信号通路而发挥高效抗纤维化的作用。为增强融合蛋白的可溶性表达水平,进一步在N端添加SUMO标签,构建成SUMO-BiPPB-mIFNγ-tTRβⅡ,不但可增加蛋白的可溶性表达特性,而且可防止蛋白在宿主体内的降解。
另外获取大量可溶性蛋白与大肠杆菌的诱导的温度、时间、IPTG浓度密切相关,37 ℃为大肠杆菌的最适生长温度,温度较高时会引起蛋白表达过快,可使蛋白质三级结构错误折叠形成包涵体,因而降低诱导温度可以缓慢表达蛋白,形成正确的三级空间结构避免包涵体的生成。蛋白表达时间亦是影响蛋白正确折叠表达的一个重要因素,诱导时间短蛋白表达较少可以使其形成正确的三级结构防止包涵体的生成,而诱导时间长会导致蛋白质结构的错误折叠至使包涵体生成。与温度和时间影响可溶性蛋白表达相同,IPTG促使蛋白表达,选取最适IPTG浓度可使蛋白质正确折叠,避免包涵体的形成。因此优化大肠杆菌的诱导的温度、时间、IPTG浓度是获得大量具有生物活性蛋白的基础。因而本实验对SUMO-BiPPB-mIFNγ-tTRβⅡ在大肠杆菌中表达条件进行优化,以筛选可溶性表达的最佳条件。本实验通过将融合蛋白SUMO-BiPPB-mIFNγ-tTRβⅡ在不同IPTG浓度(0.1、0.3、0.6和1 mmol/L)、不同诱导温度(37 ℃、16 ℃和20 ℃)和时间(6 h、16 h和20 h)条件下表达水平,并使用凝胶电泳图像分析系统比较分析,以评价蛋白表达水平以选取最佳诱导表达条件。在本实验中我们可以得出结论,在20 ℃、0.6 mmol/L IPTG诱导20 h菌液中目的蛋白在全菌中表达含量最高,占全菌总蛋白16.69%。再进一步对其可溶性表达进行分析得出结论,20 ℃、0.6 mmol/L IPTG诱导20 h后上清中目的蛋白表达含量较高,占上清总蛋白20.24%。这是由于在20 ℃、0.6 mmol/L IPTG诱导20 h的条件下,目的蛋白大量表达并且正确折叠,避免包涵体的生成,因此可以在诱导表达的上清中获得。
综上所述,本实验成功获得融合蛋白SUMO-BiPPB-mIFNγ-tTRβⅡ最佳诱导条件为20 ℃、0.6 mmol/L IPTG诱导20 h,为进一步制备生物活性的蛋白和后续功能研究奠定基础。

