燕子花WRKY11基因克隆、结构分析及功能验证1)
叶王斌 王玲 周晟 杨娟 刘桂伶 范丽娟
(东北林业大学,哈尔滨,150040)
WRKY作为最大的转录因子家族之一,WRKY转录因子家族成员的特征是氨基酸序列中含有一段具有高度保守的结构域。目前在发现的WRKY转录因子中,证明多数WRKY转录因子不仅参与植物应对生物胁迫和非生物胁迫的过程(增强植物对逆境的抵抗力)[1-6],而且WRKY转录因子还参与调控植物生长发育过程中的各个阶段(从种子萌发[7-8]、根系发育[9]、花期调控[10]、花色苷形成[11]、果实成熟[12]到叶片衰老[13-15]等),在植物的整个生长周期中,WRKY转录因子扮演着重要的角色[16]。最早在烟草、拟南芥等植物中发现WRKY家族中的WRKY11具有多功能的重要基因,在植物防御过程中发挥着正向调控作用[17-18];虎皮兰PcWRKY11基因可以通过降低活性氧(ROS)水平和增加渗透物质的合成,适应适度的盐胁迫[19];转紫花苜宿MsWRKY11基因的大豆,提高了大豆的耐盐性,而且株高、单株角果数、单株粒数和百粒质量均高于野生型大豆[20];MsWRKY11基因在紫花苜蓿中的过表达通过降低叶片的气孔密度来提高水分利用效率和抗旱性[21];水稻OsWRKY11基因过表达可增强对干旱胁迫的耐受性,并诱导干旱相关基因的表达,同时还提高了水稻对白叶枯病菌的抗性[22];WRKY11基因能促进花青素的积累[23-24];蔡毓晖[25]发现水稻OsWRKY11基因突变产生了晚花和矮化的表型,并影响了植株对稻瘟病菌的抗性。因此,WRKY11基因除了在植物抗逆防御机制中及花青素合成中起作用,在植物花期调控、株高及子实产量等调控中也起到重要的作用。
目前,WRKY11转录因子的功能研究大部分以抗逆防御响应功能及机理研究为主,而在观赏花卉花期调控育种中极少研究。燕子花(Irislaevigata)是鸢尾科(Iridaceae)鸢尾属(Iris)的多年生草本花卉,也是我国东北地区重要的水生观赏花卉,燕子花单花葶着花2~4朵,花蓝紫色,花型独特,花色艳丽,开花较早,花期长,耐寒性强[26],不仅具有较高的观赏价值,也是新兴的优质切花材料。根据对燕子花转录组分析,发现WRKY11转录因子与花期调控相关[27]。为了验证WRKY11转录因子与花期调控相关性,本研究以燕子花为材料,以燕子花花被片为cDNA模板,克隆了燕子花IlWRKY11基因,对IlWRKY11蛋白质结构进行生物信息学分析、亚细胞定位,并通过该基因转化模式植物拟南芥,开展WRKY11转录因子对花期调控方面的功能解析。
1 材料与方法
1.1 试验材料
本试验以种植于东北林业大学苗圃的燕子花的花被片为基因克隆的植物材料。植物表达载体GV1300质粒(pCAMBIA1300::GFP)由海南大学彭明实验室惠赠。
1.2 燕子花总RNA的提取及反转录cDNA获得
使用全能型植物RNA提取试剂盒OminiPlant RNA Kit (CWBIO)提取燕子花花被片总RNA;用反转录试剂盒PrimerScriptTMRT Reagent Kit (TAKARA)合成第一链cDNA,并用作基因克隆模板。
1.3 基因克隆
根据燕子花转录组数据库中IlWRKY11基因的序列,用Primer 5.0设计ORF克隆引物,引物序列如下:
IlWRKY11-F(5’-ATGACGGCCGTCGATATG-3’);IlWRKY11-R(5’-CTCGACGGGCTTTAGGAT-3’)。
用于ORF克隆的聚合酶链式反应(PCR)体系为50 μL,其中,包括模板cDNA 1 μL、上游引物(IlWRKY11-F)2 μL、下游引物(IlWRKY11-R)2 μL、脱氧核糖核苷三磷酸(dNTPs)、PCR反应缓冲液(10×PCR Buffer)5 μL、MgSO4溶液3 μL、高保真性PCR酶(KOD-Plus-Neo,TOYOBO)1 μL、双蒸水(ddH2O)31 μL。PCR反应程序为:95 ℃、5 min(预变性);95 ℃、30 s(变性),56 ℃、45 s(退火),72 ℃、90 s(延伸),变性、退火及延伸循环35次;72 ℃、10 min。
经1%琼脂糖凝胶电泳检测和胶回收目的片段,连接至平末端载体Peasy Blunt Zero(全式金),转化大肠杆菌感受态DH5α(唯地生物)并涂板,37 ℃倒置过夜培养后,挑取单克隆进行PCR检测,根据凝胶电泳结果选择条带长度合适的阳性菌过夜摇菌10 mL,次日吸取2 mL的菌液送至生物公司测序,得到测序结果后,用DNAMAN(LynnonBiosoft,USA)软件将测序结果与数据库的序列进行比对,将序列正确的菌液进行质粒提取,具体操作步骤参照质粒小提试剂盒(TIANGEN)。
1.4 生物信息学分析方法
使用ProtParam、Protscale等在线数据库对IlWRKY11基因编码氨基酸序列进行对照分析(分子式、相对分子质量、理论等电点(PI)值、稳定性、疏水性等理化性质);使用SOPMA数据库预测蛋白质二级结构;使用SWISS-MODEL数据库预测分析蛋白质三级结构;使用DNAMAN软件对同源序列进行多序列比对;通过iTOL在线数据库,使用邻位相连法构建系统进化树,自举(Bootstrap)重复1 000次[28];通过STRING在线数据库进行蛋白互作分析及功能预测。
1.5 载体构建
根据植物表达载体GV1300的图谱和序列,通过诺唯赞在线引物设计工具(https://www.vazyme.com)设计获得无缝克隆引物,引物序列(下划线部分为载体同源臂序列)如下:
IlWRKY11-BamHⅠ-F(5’-TTGATACATATGCCCGTCGACATGACGGCCGTCGATATG-3’);
IlWRKY11-SalⅠ-R:(5’-CCCTTGCTCACCATGGATCCCTCGACGGGCTTTAGGAT-3’)。
用含目的基因的质粒为模板,通过聚合酶链式反应(PCR)扩增为目的基因添加载体同源臂,反应体系和程序参照基因克隆的方法,同时用限制性核酸内切酶(BamHⅠ和SalⅠ)线性化GV1300载体质粒。应用同源重组试剂盒(ClonExpress II One Step Cloning Kit(诺唯赞))方法将线性化载体与目的片段连接,连接产物转化大肠杆菌DH5α后,进行涂板筛选及PCR鉴定,并送至生物公司测序,确保目的基因成功与表达载体连接。
鉴定为阳性的重组质粒转化农杆菌感受态GV3101(唯地生物)后,涂布在质量浓度50 mg/L卡那霉素和质量浓度50 mg/L利福平的YEP培养基上,挑取单克隆进行PCR鉴定,获得阳性菌落后进行扩培,加入等体积50%甘油混合均匀,存于冰箱-80 ℃保存备用。
1.6 亚细胞定位
采用瞬时过表达本氏烟草的方法进行亚细胞定位。从冰箱中取出带有重组质粒的农杆菌GV3101菌株划线进行活化,在28 ℃培养箱中暗培养36 h左右,挑取单克隆菌株进行PCR鉴定,再将鉴定正确的菌液在YEP液体培养基(利福平质量浓度25 mg/L、卡那霉素质量浓度50 mg/L、吗啉乙磺酸(MES)摩尔浓度10 mmol/L、乙酰丁香酮摩尔浓度40 μmol/L)中扩大培养。吸取100 μL菌液加入到10 mL的YEP培养基中,28 ℃振荡培养;5 000 rpm离心收集菌体,用摩尔浓度10 mmol/L的MgCl2重悬菌体,并用分光光度计将OD600调至1.5左右,然后使乙酰丁香酮最终摩尔浓度定为200 μmol/L,黑暗静置3 h;将菌液注射到本式烟草的叶背面,黑暗放置12 h后正常培养;3~4 d后撕取叶面下表皮制片,在荧光显微镜下观察荧光部位。
1.7 拟南芥的转化、筛选和鉴定
分别将含有空载和目的基因的农杆菌采用蘸花法[29]遗传转化拟南芥(Col-0),收取T1代种子。将T1代种子消毒并播种在质量浓度25 mg/L潮霉素的1/2MS培养基上,选择正常生长的幼苗种植在营养土(V(泥炭土)∶V(蛭石)∶V(珍珠岩为)=3∶1∶1)中,直至收集T2代种子。采用相同方法获得T3代纯合体拟南芥种子,用于后续试验。
提取拟南芥总RNA,反转录成cDNA。根据IlWRKY11基因序列设计实时荧光定量PCR特异性引物,以AtActin2(AT3G18780)为内参基因,引物序列如下:
AtActin2-F(5’-CTCCTTTGTTGCTGTTGACTAC-3’);
AtActin2-R(5’-GCACAATGTTACCGTACAGATC-3’);
IlWRKY11-qPCR-F(5’-TTCTCGCTCTCCCTCCTATT-3’);
IlWRKY11-qPCR-R(5’-GCCGTTGCACTTCTTCTTGT-3’)。
荧光定量PCR的体系为20 μL,其中,包括10 μL 2×SYBR Premix Ex Taq酶,上下游引物各0.5 μL,2 μL cDNA模板,7 μL ddH2O。反应程序为:95 ℃,10 min(预变性);94 ℃,30 s(变性);60 ℃,45 s(退火);72 ℃,30 s(延伸);72 ℃,7 min;4 ℃,保持;变性、退火及延伸循环45次。溶解曲线:95 ℃,15 s;60 ℃,1 min;95 ℃,继续。
1.8 转基因拟南芥的性状数据
将过表达IlWRKY11(OE)、转空载体(EV)和野生型(WT)拟南芥种子,同时点在筛选培养基上,萌发7 d后移栽至营养土中正常培养,培养室的光周期为光照10 h、黑暗14 h,每两天浇一次水,当拟南芥花葶抽出高度达到1 cm时记录时间,当第一朵花开放时,统计开花时间、莲座叶与茎生叶的数目,每个株系记录15株。采用Excel 2019 (Microsoft,USA)和SPSS 26.0 (IBM Corp,USA)软件对实验数据进行均值、标准误差、方差分析及显著性分析[30-31]。
1.9 拟南芥开花相关基因的表达量
为了进一步探究IlWRKY11基因所参与的成花途径,通过实时荧光定量PCR对过表达IlWRKY11拟南芥开花相关基因[32](光周期途径CO基因、春化途径VRN1基因、赤霉素途径GA20OX基因、年龄途径SPL3基因、糖途径TPS1基因、温度途径SVP基因、自主途径FCA基因以及开花整合因子SOC1和FLC基因)进行了表达量检测,AtActin2作为内参基因,结果用2-ΔΔCT法计算各株系的表达量[33],用Origin 2019(OriginLab,USA)作图。所用引物序列下:
AtActin2-F(5’-CTCCTTTGTTGCTGTTGACTAC-3’);
AtActin2-R(5’-GCACAATGTTACCGTACAGATC-3’);
AtCO-F(5’-CACAGGTGAATACAGTCAACACC-3’);
AtCO-R(5’-CCATGGATGAAATGTATGCGTTATGG-3’);
AtVRN1-F(5’-CTGAGGGTCCCAGATAAGTTTG-3’);
AtVRN1-R(5’-GTCAGCTTTCCTTAGTCCTACAC-3’);
AtGA20OX1-F(5’-CGGTTTTGCGACGACATGAG-3’);
AtGA20OX1-R(5’-TAGCCCCAGAAGCTCCATGA-3’);
AtSPL3-F(5’-CTCATGTTCGGATCTCTGGTC-3’);
AtSPL3-R(5’-TTTCCGCCTTCTCTCGTTGTG-3’);
AtTPS1-F(5’-ATTGGCATAGATTCTGATCGGT-3’);
AtTPS1-R(5’-TCAAGACGATCAACACCTAACA-3’);
AtSVP-F(5’-GAAGAGAACGAGCGACTTGG-3’);
AtSVP-R(5’-GAGCTCTCGGAGTCAACAGG-3’);
AtFCA-F(5’-GCTCTTGTCGCAGCAAACTC-3’);
AtFCA-R(5’-GATCCAGCCCACTGTTGTTTAC-3’);
AtSOC1-F(5’-GATCGAGTCAGCACCAAACC-3’);
AtSOC1-R(5’-TCCTATGCCTTCTCCCAAGA-3’);
AtFLC-F(5’-AGCCAAGAAGACCGAACTCA-3’);
AtFLC-R(5’-AGCTTCTGCTCCCACATGAT-3’)。
2 结果与分析
2.1 目的基因的克隆
由图1可知,以前期获得的燕子花转录组WRKY基因序列为参考,设计ORF克隆引物,以燕子花的花被片cDNA为模板克隆目的片段,IlWRKY11的ORF为888 bp,编码295个氨基酸,并将序列上传至基因数据库(GenBank)对照,基因号为ON399551。
M为DL2000参考标志,1-2为WRKY11基因全长。
2.2 燕子花IlWRKY11蛋白的生物信息学分析
通过STRING在线数据库进行蛋白互作分析及功能预测,燕子花IlWRKY11蛋白的相对分子质量32 291,蛋白质理论等电点为9.76,分子式为C1398H2237N419O421S20,脂溶性指数为57.93,不稳定指数(II)为43.69,属于不稳定的亲水性蛋白。由图2A可知,利用Protscale在线数据库验证IlWRKY11蛋白的亲疏水性,显示IlWRKY11蛋白最强的亲水值为-3.200,最强的疏水值为1.322,说明IlWRKY11蛋白属于不稳定的亲水性蛋白。由图2B可知,用SOPMA在线数据库对IlWRKY11蛋白进行二级结构预测结果显示,IlWRKY11蛋白有22.37%的α-螺旋、9.83%的延伸折叠、5.76%的β-转角和62.03%的无规则卷曲。由图2C可知,通过SWISS MODEL在线数据库分析,以2ayd.1.A为模板,构建了蛋白的三级结构模型,GMQE(全局模型质量估测)反映了使用该模板构建的模型的预期准确性以及目标的覆盖范围,数字越大表示可靠性越高,QMEAN(模型平均相似度)得分表示模型结构与相似大小的试验结构之间的一致性,GMQE值为0.18,一致性为55.41%,表明所建模型可靠性较好,质量较高。

图2 IlWRKY11蛋白的亲疏水性及结构
由图3可知,使用DNAMAN在线数据库进行多序列比对,燕子花IlWRKY11蛋白序列与已有的石刁柏(Asparagusofficinalis,XP020266739)、椰树(Cocosnucifera,KAG1331934)、岷江百合(Liliumregale,QRX38913)、油棕(Elaeisguineensis,XP010929316)、深圳拟兰(Apostasiashenzhenica,PKA65788)、海枣(Phoenixdactylifera,XP008799447)、荷花(Nelumbonucifera,XP010265415)等植物的WRKY11相似度均达到65%以上。其中,燕子花IlWRKY11蛋白序列与石刁柏的相似度达到70.03%,与深圳拟兰的氨基酸序列相似度为71.80%。

图3 IlWRKY11与近缘植物WRKY11蛋白的多序列比对
由图4可知,利用iTOL在线网站构建系统发育树,整个系统发育树有3大分支,其中,燕子花IlWRKY11与深圳拟兰、石刁柏的亲缘关系最近,其次是岷江百合、椰树、海枣、油棕等植物亲缘关系相对较近,与紫苏(Perillafrutescensvar.frutescens,KAH6804508.1)、拟南芥(Arabidopsisthaliana,NP849559)、荷花(Nelumbonucifera,XP010265415)、河岸葡萄(Vitisriparia,XP034698984)、胡桃(Juglansregia,XP018855788)、杨梅(Morellarubra,KAB1204309)等植物的亲缘关系最远。

图4 燕子花IlWRKY11与其它植物IlWRKY蛋白的系统进化
由图5可知,使用STRING在线软件,用与IlWRKY11蛋白同源性最高的模式植物拟南芥的WRKY11蛋白进行蛋白互作分析,发现WRKY11蛋白可与CAM3、HB52、CRCK1、CRCK2、BRCA1、DEL1等蛋白互作,这些蛋白激酶和过氧化物酶分别与Ca2+通道、氧化还原剂、ABA(脱落酸)生物合成和降解木质素、亚辛化、生长素分解代谢有关,能够对环境应激产生反应,有效应对生物和非生物胁迫,可见WRKY11通过这些蛋白参与植物生物和非生物胁迫,推测IlWRKY11蛋白也同样参与了植物的生物及非生物胁迫(植物抗旱、耐盐碱、抗病原菌等);而与WRKY11互作的MRF1基因(AT1G21920)在芽韧皮部伴侣细胞中能影响光周期而显著上调,并作用于光周期途径中心整合子FT基因的上游,促进植物提前开花[34],说明WRKY11通过MRF1参与花期调控,进而推测IlWRKY11蛋白也在植物的花期调控过程中发挥作用。
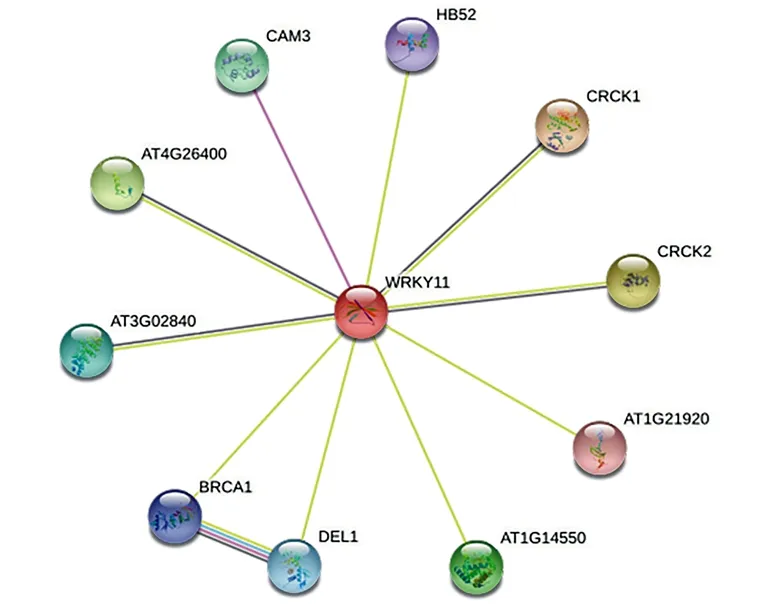
图5 拟南芥中与WRKY11互作的蛋白
2.3 IlWRKY11蛋白的亚细胞定位
由图6可知,通过无缝克隆的方式,分别将去掉终止密码子的IlWRKY11 ORF区构建到植物过量表达载体GV1300的BamHⅠ和SalⅠ酶切位点之间,获得由CaMV35S启动子驱动的GV1300-IlWRKY11-GFP融合植物表达载体。

M为DL2000参考标志,1~9位WRKY11单菌落。
由图7可知,通过瞬时转化本氏烟草的方法进行亚细胞定位,用荧光显微镜进行观察荧光位置,阳性对照GV1300-GFP在烟草表皮细胞中绿色荧光遍布整个细胞,而IlWRKY11融合蛋白仅在细胞核能观察到绿色荧光。
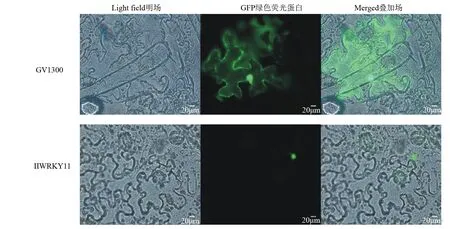
图7 IlWRKY11蛋白的亚细胞定位
2.4 WKRY11基因对拟南芥成花转变的调控
由表1可知,将T3代纯合体拟南芥种子播种在含25 mg/L Hyg的0.5倍MS培养基上筛选得到阳性植株。为了对转基因拟南芥过表达株系做了进一步筛选,确定各个株系的表达量,提取各个株系的RNA进行实时荧光定量PCR,IlWRKY11-OE1的表达量最高,其次是IlWRKY11-OE4、IlWRKY11-OE9和IlWRKY11-OE3,IlWRKY11-OE2的表达量最低,因此选择IlWRKY11-OE1、IlWRKY11-OE4和IlWRKY11-OE9进行后续试验。
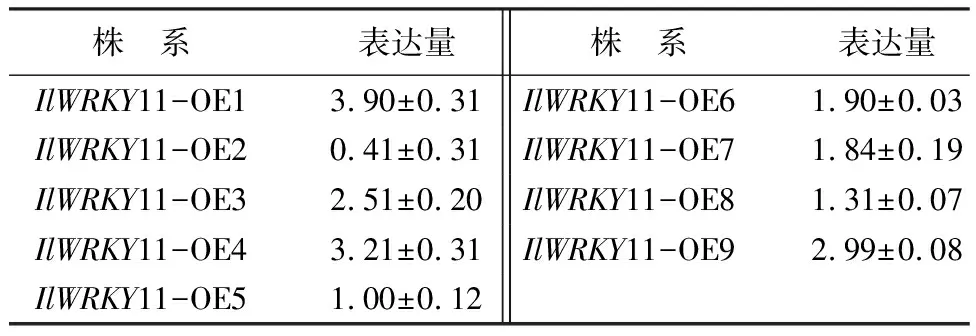
表1 转燕子花IlWRKY11基因拟南芥的不同株系的表达量分析
由图8可知,将WT、EV、IlWRKY11-OE1、IlWRKY11-OE4和IlWRKY11-OE9株系播种在1/2MS培养基上,在长日照的组培室中生长7 d,再将拟南芥幼苗转移到营养土培养观察,WT、EV、IlWRKY11-OE1、IlWRKY11-OE4和IlWRKY11-OE9各株系的生长特征(拟南芥抽薹的时间、第一朵花开放的时间、莲座叶数目)具有显著差异。

图8 转燕子花IlWRKY11基因拟南芥的表型观察
由表2可知,在短日照的条件下,WT和EV的拟南芥平均抽薹时间分别为31.0、31.6 d,平均开花时间为34.9、35.1 d,而开花时莲座叶数量分别为14.3、14.7片,开花时间没有显著差异,说明GV1300载体对拟南芥的生长发育没有产生影响。IlWRKY11-OE1、IlWRKY11-OE4和IlWRKY11-OE9植株的开花时间和莲座叶数目各株系之间没有明显差异;与WT、EV相比,IlWRKY11-OE1、IlWRKY11-OE4和IlWRKY11-OE9株系的抽薹和开花时间提前2~3 d,莲座叶数量减少。

表2 对照和过表达燕子花IlWRKY11拟南芥株系的抽薹时间、开花时间、莲座叶数量统计
2.5 过表达IlWRKY11基因对拟南芥开花相关基因的影响
植物开花由多条途径诱导,通过几个编码不同类别蛋白质的开花整合基因激活花分生组织特性基因表达,导致花的形成。为了进一步确定IlWRKY11对开花的影响及其参与的分子调控途径,通过实时荧光定量PCR的方法检测光周期途径CO(AT5G15840)、自主途径FCA(AT4G16280)、赤霉素途径GA20OX(AT1G44090)、开花整合因子SOC1(AT2G45660)、年龄途径SPL3(AT2G33810)、温度途径SVP(AT2G22540)、糖途径TPS1(AT1G78580)、开花整合因子FT(AT1G65480)、春化途径VRN1(AT3G18990)等关键基因在过表达IlWRKY11拟南芥植株中的表达情况。
由表3所示,在拟南芥萌发14 d的时候,与对照相比,过表达IlWRKY11拟南芥中使赤霉素途径GA20OX基因、春化途径VRN1基因、开花整合因子FT基因表达量显著上调,为对照的1.5倍,光周期途径CO基因、年龄途径SPL3基因、温度途径SVP基因和糖途径TPS1基因表达量均呈现显著下调趋势,为对照的0.6倍左右。表明IlWRKY11基因直接或间接影响花发育过程中多个途径及整合基因来促进开花。
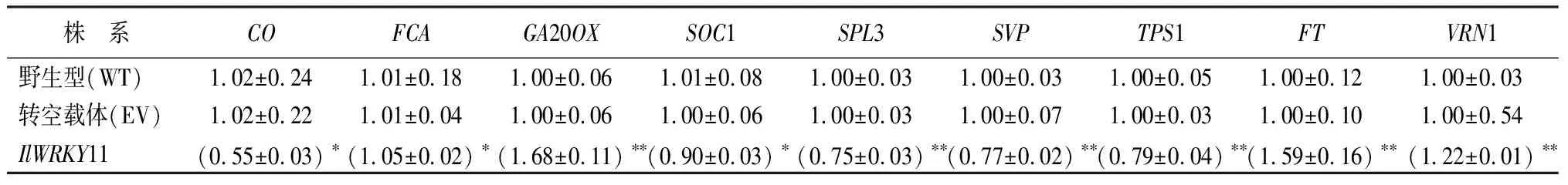
表3 过表达IlWRKY11拟南芥14 d苗龄开花各基因表达量
3 讨论
本研究成功克隆出燕子花IlWRKY11基因,基因号为ON399551,ORF为888 bp,编码295个氨基酸;IlWRKY11蛋白的相对分子质量为32 291,属于不稳定的亲水性蛋白,二级结构中无规则卷曲含量最高(62.03%),其次是α螺旋(22.37%),延伸链(9.83%)和β转角(5.76%)也分布于蛋白中,并预测了IlWRKY11基因的三级结构;IlWRKY11与椰树的蛋白同源性最高,相似度达到57.87%;IlWRKY11蛋白的转录因子的作用位置在细胞核,与有关研究[21-22,39]对WRKY11蛋白的亚细胞定位观察到的结果一致。
植物生命周期中最重要的一个环节是开花,成花调控是植物在适应不同的环境进化出来的适应机制[36]。WRKY家族对调控植物生长发育及生物和非生物胁迫的耐受性发挥着至关重要的作用,开花植物的正常功能很大程度依赖WRKY转录因子的调节,WRKY转录因子还,是开花植物对环境适应性增强的重要家族[37],因此,WRKY转录因子家族对开花植物环境适应过程中调控成花转变也发挥着关键作用。拟南芥AtWRKY71基因能够直接上调LFY和AP3基因的表达促进植物成花转变和花器官发育[38];过表达AtWRKY25基因可以使拟南芥在长日照条件下提早开花[39]。在拟南芥中,异源表达棉花GbWRKY1基因,可以通过赤霉素途径控制开花整合基因SOC1的转录,从而促进拟南芥的开花[40];低温能上调菜心BcWRKY22基因表达量,进而上调BcSOC1的表达,促进菜心抽薹开花[41];蔡毓晖等发现水稻OsWRKY11突变体对水稻花期产生了影响,产生晚花表型[25]。燕子花生长在寒冷、水湿的地区,环境上的压力也促进了环境适应基因的演化,使燕子花具有抗寒、耐盐碱的能力。本研究克隆了燕子花IlWRKY11基因,利用模式植物拟南芥与IlWRKY11同源性较高的AtWRKY11蛋白互作分析,认为IlWRKY11也参与花期调控,因此构建了GV1300-IlWRKY11-GFP植物表达载体,通过农杆菌介导法将其转入模式植物拟南芥中进行功能解析,发现燕子花IlWRKY11基因具有调控植物开花的功能,在短日照条件的生长情况下,过表达IlWRKY11基因的拟南芥表现出早花表型,进一步证明了WRKY11基因在植物开花过程中能够调控成花转变及花期。
植物的开花受到自身因素影响和外界环境的刺激,外界环境的影响程度则受制于植物本身基因的表达调控,多年生植物的基因背景比一年生植物更为复杂,调节通路也更为庞杂[42]。为了进一步探究IlWRKY11基因所参与的成花途径,通过实时荧光定量PCR对过表达IlWRKY11拟南芥开花相关基因CO、VRN1、GA20OX、SPL3、TPS1、SVP以及开花整合因子SOC1和FLC基因进行了表达量检测,发现GA20OX、VRN1以及FT基因表达量显著上调,CO、SPL3、SVP和TPS1基因均呈现显著下调趋势。过表达IlWRKY11可促进拟南芥光周期途径、赤霉素途径、年龄途径和糖途径相关基因的表达,解除了温度调控途径、春化途径相关基因对成花的抑制,从而使开花提前。
植物的开花和衰老之间存在紧密关系,衰老途径中相关基因的表达主要受年龄的影响,而不是受其他开花途径的影响[43],通常认为处于幼年阶段的植物没有开花能力,即使在满足如光周期或春化的开花条件下也会保持营养生长[44],植物开花的倾向随着年龄的增长而增加,因此和年龄途径有关的调控开花的机制不同于由环境或由激素途径调节的能力机制[45]。过表达水稻OsELF3.1的拟南芥显示出叶片的延迟衰老,并且在长日照下晚花[46];对菊花的研究发现,在调控从幼年期到成年期的过渡中,衰老相关基因的表达取决于芽的年龄,沉默CmNF-YB8基因会缩短菊花的幼年期,提前开花,同时也使植株提前触发衰老[47];拟南芥NF-Y家族的基因参与光周期途径和赤霉素途径的成花调控[48],和过表达IlWRKY11基因的拟南芥开花基因的检测结果相似。进一步的研究发现NF-Y家族成员也通过年龄途径调节开花,在开花过程的后期发挥作用,能够促进植株开花[43],与本研究检测的SPL3基因在成花转变期间上调的结果一致,因此推测IlWRKY11基因主要影响光周期途径和赤霉素途径的成花调控,同时还整合其他信号在成花转变期间通过年龄途径影响开花,其中影响年龄途径的SPL3基因是决定拟南芥幼年期的长短、影响成花调控的关键,但两者的调控关系及调控路径需要进一步解析验证。

