近现代中国水稻育种历程
李胜男 刘伟 胡兴明 赵良侠


摘要:栽培水稻起源于我国,我国以稻米为主食有着超过3 000年的历史,水稻研究的历史也十分悠久。回顾我国一百多年来水稻育种历程,育种手段从简单的品种比较发展为以科学理论为支撑的纯系育种、杂交育种和生物育种等,期间取得了矮化育种、三系法育种、两系法育种和超级稻育种等重大突破。文章根据各个时期的发展特点,将该历程总结为3个发展时期,分别为科学育种初期、独立发展时期和逐步领先时期,对各个时期的主要育种手段及所取得的成就进行了总结,列举了我国近现代水稻育种历程的一些关键基因,并对水稻育种新技术及今后我国水稻育种发展方向进行了讨论和展望。
关键词:水稻;育种历程;矮化育种;超级稻;生物育种;基因编辑
中图分类号:S511.03文献标志码:A文章编号:1002-1302(2023)11-0020-07
“国以民为本,民以食为天”。目前超5成的世界人口以稻米为主要食物来源,我国作为全球第一水稻生产大国,在水稻育种方面有着突出贡献。在过去的一百多年里,我国从落后到效仿到独立创新并逐渐领先全球的水稻育种进程,这是一代代育种家辛勤耕耘的结果。回顾我国一百多年来水稻育种的发展历程以及对世界水稻事业的贡献,可将我国近现代水稻育种历程分为3个阶段:科学育种初期、独立发展时期和逐步领先时期(表1)。
1科学育种初期(清末民初至1925年)
1898年戊戌变法后,清政府提出了一系列农业改良措施,包括成立农政机构、农业试验场和农业学校,同时翻译西方书籍,传播科学新思想,推进农业改革,这为我国当前水稻科学育种事业的开展奠定了基础。20世纪初,我国大部分省份如四川、广东、云南等都建立了农事试验场和农事学校,并已经开始搜集国内外水稻品种,开展品种比较试验。1914年,北京政府便要求各省将辖区内稻种送到农商部,并按照稻种品质优劣将稻种分为4个等级,再将优质稻种分发各省,用作来年试种,这是我国政府第1次组织的全国性水稻品种鉴定[1]。随着西方遗传学理论在我国的传播及世界农业育种技术等各类科学技术的发展,我国开展了具有开创性意义的育种工作。1919年,有我国近代运用遗传学原理开展水稻育种的具有初创者之称的原颂周先生,在南京高等师范学校的试验农场,对当地栽培的水稻品种以及从各省征集的数十个水稻良种进行品种比较试验和选种改良,并于1924年育成了改良江宁洋籼和改良东莞白2个优良纯系品种,在长江中下游地区推广效果良好[2]。在此之后,我国南方地区的许多农事试验场和农事学校都陆续开展了水稻育种工作。
2独立发展时期(1925年至20世纪50年代)
20世纪20年代,纯系育种和杂交育种等作物育种手段兴起,全国各地育种规模迅速扩大,丁颖、赵连芳、周拾禄先生等水稻育种家也陆续学成回国。1930年中央农业实验所和全国稻麦改进所成立,我国水稻育种事业正式进入利用现代科技方法的重要阶段。国际上最先进的育种技术已在我国大多数育种机构应用。与此同时,我国各研究所开始进行独立探索和研究,率先开展的矮化育种更是为解决人类的温饱问题作出了重大贡献。
2.1纯系育种
纯系育种法是近代我国水稻育种的重要手段。1925年国立广东大学(中山大学前身)率先开展了水稻纯系育种,我国最初采用洛夫的穗行纯系育种法,后经实践赵连芳、丁颖等育种家结合我国实际情况加以改进,开辟了适合我国本土的纯系育种法,中大帽子头、南特号、矮脚南特、胜利籼等优良品种均是用此法选育而来[3]。我国于1929年育成近代第1个大规模推广的优良品种——中大帽子头,全国推广面积超1万hm2。1934年江西省农业试验场从农家品种鄱阳早选得变异单穗,育成适应性广、产量高、高抗普矮病和黄矮病的籼型常规水稻,后经提纯复壮适应性增强,1958—1962年全国推广面积均在 400万hm2左右。
2.2杂交育种
我国的水稻杂交育种起步整体上略晚于纯系育种,后随着杂种优势的不断发掘,水稻杂交育种逐渐成为主流。国内以广东省率先开始水稻的杂交育种,丁颖院士开辟了我国水稻杂交育种技术及理论,1926年丁颖发现了竹占与野生稻自然杂交的杂交种子,并经过几代选育,培育出中山1号,开创了杂交稻与野生稻选育品种的先河。20世纪30年代,各地农事机构才陆续开展栽培稻与野生稻及栽培稻之间的杂交工作,有目的地选配不同亲本进行杂交、自交、回交等,结合双亲的优良性状培育出大批优良品种。1951年,沈阳农学院的杨守仁等已经开始了籼粳稻杂交工作,并采用系谱法选育优良品种。杂交育种事业的重大转折在1963年,在此之前采用杂交育种法培育的品种基本都是常规稻,直到20世紀60年代杂交水稻思想和技术被提出,1964年袁隆平在我国开创了杂交水稻研究的先河,1973年实现三系配套成功,在国际上取得瞩目成就。
2.3矮化育种
矮化育种是水稻的第1次绿色革命,我国于19世纪50年代中期开始水稻矮秆育种工作,矮脚南特、矮仔占2个矮秆品种是我国矮化育种的重要矮源。1941年,广西壮族自治区玉林市容县华侨甘利南,从南洋带回稻种,见其长得特别矮,称其为矮仔占。1953年,一场风雨,众多品种皆倒伏,唯矮仔占屹立不倒,且产量竟高达444 kg/667 m2,引起广泛关注,各地前来索要稻种,一场矮化育种革命就此展开。“中国半矮秆水稻之父”黄耀祥先生开辟了我国水稻矮化育种事业。1956年,广东省农业科学院黄耀祥先生用矮仔占4号与广场13号杂交,于1959年育成广场矮品种,随即大面积推广,后相继育成推广珍珠矮、广解9号、广陆矮4号及窄叶青8号等优良高产品种[4]。1956年,广东省汕头市潮阳县农民育种家洪群英、洪春利2人在南特16号田内,经纯系育种选育,育成了全国第1个水稻高产矮秆品种矮脚南特,成为当时的主栽品种,并成为矮化育种革命的重要矮源,是具有划时代意义的品种。我国台湾省台中区农业改良场洪秋增利用低脚乌尖与菜园种杂交,于1956年育成台中在来1号,并在1960年投入推广。矮秆品种广场矮等的育成,是我国水稻矮化育种研究的重大突破,比菲律宾国际水稻研究所1966年育出的矮秆品种IR8早7年[5]。我国的矮化育种事业,实现了水稻产量的第1次大飞跃,也是我国运用现代遗传学理论独立开展水稻研究的重大突破。
3逐步领先时期(20世纪60年代至今)
三系的配套成功,标志着我国水稻育种事业率先突破瓶颈,该技术还作为我国第1项农业高新技术出口美国。后来我国在两系法、超级稻育种、生物育种等方面也取得傲人成就。该时期,我国水稻育种由学习效仿转变为自主创新,卓有成就并在各国推广,逐步领先全球。此外,我国起步于20世纪60年代的诱变育种、70年代的细胞工程育种、80年代的无融合生殖(一系法)、90年代的分子育种等水稻育种技术现均取得了不凡成就。这些丰富的水稻育种手段,为我国的水稻育种事业带来了十足的活力,下文笔者选取了我国艰辛水稻育种历程中最具里程碑意义的成就展开详述。
3.1三系杂交稻
1961年袁隆平院士注意到天然杂交水稻的穗大粒多,经多次试验确定水稻较于异花授粉植物杂种优势同样明显,并于1964年开始研究培育杂交水稻,同时期美国、日本和国际水稻研究所也开展了水稻杂种优势利用相关研究,但因无法解决杂交稻制种问题,无奈终止。当时,袁隆平院士选用的技术路线是三系法,1964和1965年通过数以万计的逐穗检查,在大田中找到6株雄性不育水稻,但几千个杂交组合均不理想,后调整策略选择野生不育稻。功夫不负苦心人,在袁隆平思想路線指导下,李必湖及冯克珊于1970年在海南三亚一片野生稻群体中找到了野生稻天然雄性不育株(野败),成为了三系配套成功的突破口[6]。此后,全国18个单位共同攻艰,利用野败进行广泛测交、轮交和筛选,1972年颜龙安等育成二九矮1号及同型保持系,1973年广西农学院张先程找到合适的恢复系,籼型三系终得配套成功,袁隆平研制出第1个杂交水稻南优2号,颜龙安培育出强优势组合汕优2号,均得到大面积推广。李铮友等于1969年育成滇型红帽缨粳稻不育系,1975年杂交粳稻三系配套成功[7]。1980年,由谢华安研发的汕优63是我国推广面积最大的杂交水稻,截至2020年,我国推广面积最大的杂交稻还有汕优64、威优64、冈优22、汕优2号、汕优6号、威优6号、Ⅱ优838、D优63和汕优10号(国家水稻数据中心:http://www.ricedata.cn/variety/)。我国杂交水稻三系配套的成功,不仅让水稻产量上升到一个新平台,也为解决我国粮食短缺问题作出了重大贡献。
3.2两系杂交稻
20世纪80年代中期,三系杂交稻的产量及优势水平一直处于徘徊局面,同时不育系繁殖和制种成本相对也很高,光温敏雄性不育为杂交稻育种带来转机。1973年石明松在晚粳品种农垦58中,发现天然不育株,经多年播种鉴定,发现其长日高温不育,短日低温可育,可作一系两用。1981年,石明松发表《晚粳自然两用系选育及应用初报》一文,并称之为两用系(现称为光温敏不育系),采用此系不需要保持系,制种较三系法简单,省力省田[8]。1980年起湖北省农业科学院开始研究该材料不育的原因,1985年,综合各方研究,普遍认同调控其育性的主要因素是光照长度,温度起辅助作用,并命名该材料为农垦58S[9-10]。自农垦58S发现后,全国掀起两系法研究热潮,两系法杂交稻被列为国家重点攻关的课题。1987年,邓华凤在籼稻三系育种材料中找到并育成光敏核不育水稻安农S1,1988年[11],福建农学院杨仁崔在IR54中发现5460S不育系,这些不育系的发现为两系杂交水稻的研究提供了材料[12]。为了应对异常气温的影响,1992年,袁隆平提出以不育起点温度作为光敏不育的关键指标,并提出选育水稻光温敏不育系的技术策略。此后我国两系杂交稻育种方法逐渐形成体系,直至今日,我国两系法杂交稻技术依然领先全球。2001年后,两系杂交稻进入迅速发展时期,过审品种和推广面积大幅提升,推广面积占杂交稻的总面积由1996年的不到1%上升到2013年的33.59%[13]。截至2021年,省级以上审定的两系杂交稻品种有 2 575 个(国家水稻数据中心,https://www.ricedata.cn/variety/)。两系法杂交稻的提出在提升了杂交稻制种效率的同时,增强了杂种优势,由品种间的杂种优势利用上升到亚种间的优势利用,是我国继三系法水稻杂交育种后的又一次大突破,占据了杂交稻的半壁江山。
3.3超级稻
超级稻引起广泛关注始于1994年国际水稻研究所培育的一批新株型超高产水稻品种,随后我国农业农村部(原农业部)于1996年启动中国超级稻育种计划,力求我国水稻产量更上一层楼。我国在国际上所提出的理想株型和高产栽培技术结合培育超级稻的基础上,提出理想株型与强杂种优势结合的超级稻理念,选育高产、优质、抗逆的超级稻。超级稻计划启动后,各地因地制宜,根据不同气候特征提出了适合当地栽培的超级稻理想株型。关于理想株型,我国学者杨守仁等在19世纪70年代便开展了水稻理想株型育种研究工作,并提出东北粳稻区短枝立叶,大穗直穗株型,黄耀祥等提出东南地区丛生早长型株型,周开达等提出华南稻区重穗型株型,袁隆平提出高冠层、矮穗层、中大层理想株型,还提出了通过适当增加株高,提高茎秆壁厚度,从而增加其生物量,提高收获指数[14-18]。关于杂种优势利用,水稻杂种优势以籼粳亚种间杂交最优,增产潜力最大,但籼粳杂交有不亲和性,结实率不甚理想,经过近10年的研究,以宁波市农业科学研究院马荣荣先生为代表的育种家通过利用广亲和基因及具有混合亲缘的中间材料使亚种间杂种优势利用取得显著进展,育成一大批籼粳稻杂交组合。
我国的超级稻计划指标共分为4期:第1期(1996—2000年),产量700 kg/667 m2;第2期(2001—2005年),产量800 kg/667 m2;第3期(2006—2015年),产量900 kg/667 m2;第4期(2016—2020年),产量达1 000 kg/667 m2。4期计划指标全部如期完成,甚至在2014年就顺利突破 1 000 kg/667 m2,提前6年完成第4期指标。袁隆平接着又向农业农村部(原农业部)建议提出了第5期指标,2020年实现16 t/hm2的超高产指标[19]。2012年,超级稻就已在全国稻区无障碍推广,据农业农村部数据,截至2018年底,全国超级稻累计推广应用1亿hm2,占水稻种植面积的30%,截至2021年,全国经农业农村部认定达到推广要求的超级稻品种135个。我国超级稻研究为水稻单位面积产量的提升带来了源源动力,除超级稻外,张启发提出的绿色超级稻构想,在保障高产优质的前提下,借助分子辅助育种等手段提高品种抗性及养分利用率,做到基本不打农药,少施肥,抗旱节水,这对解决人口对资源需求增长同环境可持续发展的矛盾有重大意义[20]。
3.4水稻生物育种
生物育种是指在经典育种手段的基础上,利用遗传学、分子生物学和细胞生物学等学科,并结合现代生物工程技术等方法培育新品种的过程,水稻生物育种现阶段主要包括分子标记育种、转基因育种和水稻分子模块设计育种。随着生物育种技术的发展,在水稻育种发展史上起重要作用的基因也被发掘出来,如矮化育种的关键基因SD1,三系法关键基因细胞质雄性不育基因WA352和恢复基因Rf3、Rf4,主导两系法育种的光温敏核不育基因PMS3和TMS55[21-25]。目前我国水稻功能基因发掘的主要方法有DNA标记技术、基因定位、图位克隆等,可通过结合农艺性状QTLs的鉴定,利用基因编辑技术和转基因技术,创造优势等位基因,实现水稻的定向性状改良,水稻生物育种技术极大地提高了育种效率和育种选择方向性。
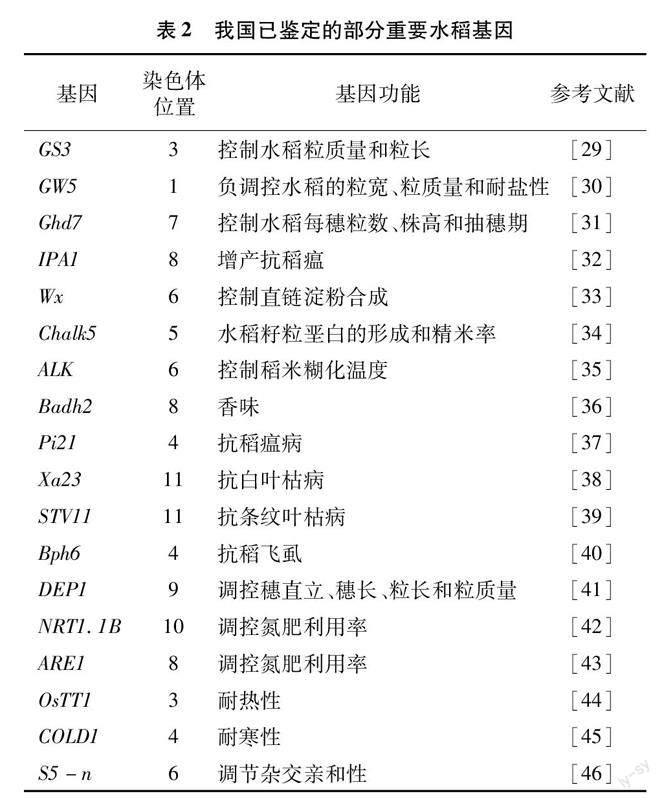
我国利用生物技术开展水稻育种起始于20世纪80年代,1990年中国科学院植物生理生态研究所便克隆了稻米品质基因Wx[26]。1995年華中农业大学张启发团队开始了转基因抗虫水稻的研发工作,1999年通过农业农村部(原农业部)成果鉴定,直到2009年抗虫转基因水稻华恢1号和Bt汕优63才获得农业农村部颁发的全国第1张转基因水稻安全证书,并批准在湖北省种植。2002年籼稻9311和粳稻日本晴全基因组测序完成,正式打开了水稻生物育种的大门[27-28]。随着更多水稻品种全基因组测序完成,以及基因编辑技术的精准化和简便化,我国各农业科研机构和院校均在生物育种工作中投入了大量精力。当前我国水稻生物育种研究如日中天,发掘并克隆了大批水稻功能基因,并在抗病虫、抗稻瘟、产量品质改良等方面均有所成就。至今,我国已发掘利用水稻重要功能基因有产量基因(GS3、GW5、Ghd7、IPA1等)、品质基因(Wx、Chalk5、ALK、Badh2等)、抗病抗虫基因(Pi21、Xa23、STV11、Bph6等)、营养高效利用基因(DEP1、NRT1.1B、ARE1等)、抗非生物胁迫基因(OsTT1、COLD1等)和籼粳杂种优势利用基因S5-n[29-46]等(表2)。除此之外,我国科学家还开发了多种基因编辑工具,2015年刘耀光课题组开发了CRISPR/Cas9多靶点编辑载体系统,2020年高彩霞课题组开发了胞嘧啶碱基编辑器,并在水稻中成功应用[47-48]。
根据funRiceGenes数据显示,截至2022年3月,已克隆的水稻基因达4 100多个,越来越多功能基因的发掘意味着水稻功能基因组学在不断完善,为水稻分子水平的研究开拓了广阔的前景。在现代生物科技的推动下,生物育种是必然趋势。
4水稻育种新技术和发展内容
基因编辑技术主要包括锌指核酸酶(ZFNs)、转录激活因子效应物核酸酶(TALENs)和成簇规律间隔短回文重复(CRISPR-Cas9)3个系统及碱基编辑技术[49]。其中锌指核酸酶系统因特异性低、操作繁琐在水稻性状改良中并未发挥显著作用,而CRISPR-Cas9系统以其简便、高效的特点成为现阶段广泛应用的手段。目前我国科学家利用基因编辑技术定向改良品种性状已经取得初步成果(表3)。如利用基因编辑技术对OsSWEET14、OsEDR1、Pi21等进行基因编辑提高水稻抗病性,对Wx、Badh2、GS3等进行基因编辑提高稻米品质,编辑BEL、OsEPSPS等基因增强水稻抗除草剂特性等[50-57]。2019年,Wang等利用CRISPR-Cas9系统,将与水稻减数分裂相关的PAIR1、REC8、OSD1和MTL 4个基因敲除后,先中断减数分裂,再诱导孤雌生殖,育成克隆种子,基因编辑技术为无融合生殖带来了曙光[58]。改良品种的关键在于创造有利变异,而以CRISPR-Cas9系统为代表的基因编辑技术便是现阶段定向且高效创造有利变异的关键手段。水稻功能基因组学的完善和基因编辑技术的创新与成熟,为创造优质种质资源带来了巨大的发展潜力。但若要实现高效率、大批量的发掘利用水稻优势基因,仅靠基因编辑技术的进步是不够的,还需要测序技术、基因组学分析、蛋白质组学分析等检测手段的辅助。此外,国家基因编辑监管政策的不断完善将推动生物育种的全面发展,为我国水稻育种事业带来新突破!
5讨论与展望
近现代我国水稻育种历程是艰辛的,纵观这一百多年的水稻育种历程,无时不提醒着我们要始终保持谦虚敬畏,要与时俱进,不能固步自封,只有站在前人已有的研究基础上,不断汲取全球最新知识,拓宽思维,勇于探索创新,才能不断突破,行稳致远。这一路我们以纯系育种和杂交育种为技术基础,降低株高实现第1次产量飞跃,三系、两系配套成功是我国稻米产量的第2次飞跃,将优质株型与强杂种优势结合培育超级稻又实现了第3次产量飞跃。水稻生物育种是实现我国第4次产量飞跃的关键,这要求我们在经典育种手段的基础上,利用现有的基因编辑、分子标记、遗传转化等手段,运用计算机、物联网、大数据、人工智能等现代高科技手段,通过分子标记辅助选择基因聚合育种,从而育成高产、优质、多抗、广适的水稻新品种。水稻生物育种的不断发展将加快新品种选育效率,加快制种速度,提高制种产量并降低制种成本,丰富种质资源,为实现我国农业现代化,全面推进乡村振兴,解决种业“卡脖子”难题,提供重要的智力支撑,让智慧育种走进现实,为国家粮食安全保驾护航。
在全球经济一体化时代,挑战与机遇并存。全球疫情与局部动荡的存在,让整个社会充满不确定性。我们应抢抓战略机遇期,更好地继承和发扬前人自力更生、敢为人先的优良传统,沿着先驱者的足迹,积极探索,作出无愧于时代的贡献。虽然我国水稻育种已经进入发展新阶段,但还存在许多亟待解决的问题,在前沿科学理论方面还欠深入,在关键功能基因挖掘鉴定和突破性育种技术上还存在不足,存在优异种质资源缺乏,育种成果滞后于市场需求、转化率低等问题。水稻育种新阶段机遇与挑战并存,这要求我们深入探究多维组学,研发更高效、更精准的新型生物技术,提高科技竞争力,加大种质资源的搜集、鉴定、评价、利用和保护力度,加快育种新技术的开发、推广和应用,大力研发顺应市场需求的突破性新品种,推动育种成果快速转化应用,加快实现民族种业的提档升级,增强核心竞争力,全力推进现代化种业强国的建设步伐,提高我国民族种业的全球市场占有率和国际话语权,通过顶层设计和自主创新,发挥体制优势,促进全国大协作,尽快跃居行业战略制高点,实现我国水稻育种事业在更高水平、更深层次、更大平台上的跨越式突破。
参考文献:
[1]夏如冰. 北洋政府时期的农政机构与农业政策(1912—1928年)[J]. 南京农业大学学报(社会科学版),2003,3(3):90-95.
[2]曹幸穗. 从引进到本土化:民国时期的农业科技[J]. 古今农业,2004(6):45-53.
[3]夏如兵. 近代中国水稻育种科技的发展历程[J]. 农业考古,2010(4):34-38,45.
[4]程式华. 中国水稻育种百年发展与展望[J]. 中国稻米,2021,27(4):1-6.
[5]咸金山. 我国近代稻作育种事业述评[J]. 中国农史,1988,7(1):54-63.
[6]袁隆平. 我在杂交水稻方面所做的工作[J]. 中国科技奖励,2001(1):14-19.
[7]李振宇,吴建利. 我国三系杂交粳稻育种研究的现状与展望[J]. 杂交水稻,1991(增刊2):13-16.
[8]石明松. 晚粳自然两用系选育及应用初报[J]. 湖北农业科学,1981,20(7):1-3.
[9]冯云庆,王长义,李全新. 湖北长日核不育水稻的研究与利用[J]. 作物学报,1985,11(4):227-234.
[10]元生朝,张自国,许传桢. 光照诱导湖北光敏感核不育水稻育性转变的敏感期及其发育階段的探讨[J]. 作物学报,1988,14(1):7-13.
[11]邓华凤,舒福北,袁定阳. 安农S-1的研究及其利用概况[J]. 杂交水稻,1999,14(3):3-5.
[12]杨仁崔,王乃元,梁康迳,等. 籼稻温敏核不育5460S的研究[J]. 福建农学院学报,1993,22(2):135-140.
[13]牟同敏. 中国两系法杂交水稻研究进展和展望[J]. 科学通报,2016,61(35):3761-3769.
[14]杨守仁,张龙步,沈钖英,等. 三十六年来籼粳稻杂交育种的研究及发展[J]. 沈阳农业大学学报,1987,18(3):3-9.
[15]徐正进,陈温福,张文忠,等. 北方粳稻新株型超高产育种研究进展[J]. 中国农业科学,2004,37(10):1407-1413.
[16]黄耀祥,林青山. 水稻超高产、特优质株型模式的构想和育种实践[J]. 广东农业科学,1994,21(4):1-6.
[17]周开达,马玉清,刘太清,等. 杂交水稻亚种间重穗型组合选育——杂交水稻超高产育种的理论与实践[J]. 四川农业大学学报,1995,13(4):403-407.
[18]袁隆平. 超级杂交水稻的现状和展望[J]. 粮食科技与经济,2003,28(1):2-3.
[19]袁隆平. 中国超级杂交稻育种技术的未来展望[J]. 中国乡村发现,2015(1):18-21.
[20]张启发. 绿色超级稻培育的设想[J]. 分子植物育种,2005,3(5):601-602.
[21]Sasaki A,Ashikari M,Ueguchi-Tanaka M,et al. Green revolution:a mutant gibberellin-synthesis gene in rice[J]. Nature,2002,416(6882):701-702.
[22]Luo D P,Xu H,Liu Z L,et al. A detrimental mitochondrial-nuclear interaction causes cytoplasmic male sterility in rice[J]. Nature Genetics,2013,45(5):573-577.
[23]Yao F,Xu C,Yu S B,et al. Mapping and genetic analysis of two fertility restorer loci in the wild-abortive cytoplasmic male sterility system of rice (Oryza sativa L.)[J]. Euphytica,1997,98:183-187.
[24]梅明华,陈亮,章志宏,等. 农垦58S光敏不育基因突变位点的确定及pms3区间的进一步作图[J]. 中国科学(C辑),1999,29(3):310-315.
[25]Wang Y G,Xing Q H,Deng Q Y,et al. Fine mapping of the rice thermo-sensitive genic male-sterile gene tms5[J]. Theoretical and Applied Genetics,2003,107(5):917-921.
[26]Wang Z Y,Wu Z L,Xing Y Y,et al. Nucleotide sequence of rice waxy gene[J]. Nucleic Acids Research,1990,18(19):5898.
[27]Yu J,Hu S N,Wang J,et al. A draft sequence of the rice genome (Oryza sativa L. ssp. indica)[J]. Science,2002,296(5565):79-92.
[28]Goff S A,Ricke D,Lan T H,et al. A draft sequence of the rice genome (Oryza sativa L. ssp. japonica)[J]. Science,2002,296(5565):92-100.
[29]Mao H L,Sun S Y,Yao J L,et al. Linking differential domain functions of the GS3 protein to natural variation of grain size in rice[J]. Proceedings of the National Academy of Sciences of the United States of America,2010,107(45):19579-19584.
[30]Weng J F,Gu S H,Wan X Y,et al. Isolation and initial characterization of GW5,a major QTL associated with rice grain width and weight[J]. Cell Research,2008,18(12):1199-1209.
[31]Xue W Y,Xing Y Z,Weng X Y,et al. Natural variation in Ghd7 is an important regulator of heading date and yield potential in rice[J]. Nature Genetics,2008,40(6):761-767.
[32]Wang S S,Wu K,Qian Q,et al. Non-canonical regulation of SPL transcription factors by a human OTUB1-like deubiquitinase defines a new plant type rice associated with higher grain yield[J]. Cell Research,2017,27(9):1142-1156.
[33]Huang L C,Li Q F,Zhang C Q,et al. Creating novel Wx alleles with fine-tuned amylose levels and improved grain quality in rice by promoter editing using CRISPR/Cas9 system[J]. Plant Biotechnology Journal,2020,18(11):2164-2166.
[34]Li Y B,Fan C C,Xing Y Z,et al. Chalk5 encodes a vacuolar H+-translocating pyrophosphatase influencing grain chalkiness in rice[J]. Nature Genetics,2014,46(4):398-404.
[35]Zhang G Y,Cheng Z J,Zhang X,et al. Double repression of soluble starch synthase genes SSⅡa and SSⅢa in rice (Oryza sativa L.) uncovers interactive effects on the physicochemical properties of starch[J]. Genome,2011,54(6):448-459.
[36]Lorieux M,Petrov M,Huang N,et al. Aroma in rice:genetic analysis of a quantitative trait[J]. Theoretical and Applied Genetics,1996,93(7):1145-1151.
[37]Fukuoka S,Okuno K.QTL analysis and mapping of pi21,a recessive gene for field resistance to rice blast in Japanese upland rice[J]. Theoretical and Applied Genetics,2001,103(2/3):185-190.
[38]Wang C L,Fan Y L,Zheng C K,et al. High-resolution genetic mapping of rice bacterial blight resistance gene Xa23[J]. Molecular Genetics and Genomics:MGG,2014,289(5):745-753.
[39]Wang Q,Liu Y Q,He J,et al. STV11 encodes a sulphotransferase and confers durable resistance to rice stripe virus[J]. Nature Communications,2014,5:4768.
[40]Guo J P,Xu C X,Wu D,et al. Bph6 encodes an exocyst-localized protein and confers broad resistance to planthoppers in rice[J]. Nature Genetics,2018,50(2):297-306.
[41]Huang X Z,Qian Q,Liu Z B,et al. Natural variation at the DEP1 locus enhances grain yield in rice[J]. Nature Genetics,2009,41(4):494-497.
[42]Zhang J Y,Liu Y X,Zhang N,et al. NRT1.1B is associated with root microbiota composition and nitrogen use in field-grown rice[J]. Nature Biotechnology,2019,37(6):676-684.
[43]Wang Q,Nian J Q,Xie X Z,et al. Genetic variations in ARE1 mediate grain yield by modulating nitrogen utilization in rice[J]. Nature Communications,2018,9(1):735.
[44]Li X M,Chao D Y,Wu Y,et al. Natural alleles of a proteasome α2 subunit gene contribute to thermotolerance and adaptation of African rice[J]. Nature Genetics,2015,47(7):827-833.
[45]Luo W,Huan Q,Xu Y Y,et al. Integrated global analysis reveals a vitamin E-vitamin K1 sub-network,downstream of COLD1,underlying rice chilling tolerance divergence[J]. Cell Reports,2021,36(3):109397.
[46]Yang J Y,Zhao X B,Cheng K,et al. A killer-protector system regulates both hybrid sterility and segregation distortion in rice[J]. Science,2012,337(6100):1336-1340.
[47]Ma X L,Zhang Q Y,Zhu Q L,et al. A robust CRISPR/Cas9 system for convenient,high-efficiency multiplex genome editing in monocot and dicot plants[J]. Molecular Plant,2015,8(8):1274-1284.
[48]Wan X Y,Weng J F,Zhai H Q,et al. Quantitative trait loci (QTL) analysis for rice grain width and fine mapping of an identified QTL allele gw-5 in a recombination hotspot region on chromosome 5[J]. Genetics,2008,179(4):2239-2252.
[49]Komor A C,Kim Y B,Packer M S,et al. Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage[J]. Nature,2016,533(7603):420-424.
[50]Li T,Liu B,Spalding M H,et al. High-efficiency TALEN-based gene editing produces disease-resistant rice[J]. Nature Biotechnology,2012,30(5):390-392.
[51]武廣珩,傅仙玉. 利用CRISPR/Cas9技术编辑水稻负调控抗病基因OsEDR1及基因功能分析[J]. 应用与环境生物学报,2019,25(6):1375-1380.
[52]王芳权,范方军,李文奇,等. 利用CRISPR/Cas9技术敲除水稻Pi21基因的效率分析[J]. 中国水稻科学,2016,30(5):469-478.
[53]Zeng D C,Liu T L,Ma X L,et al. Quantitative regulation of Waxy expression by CRISPR/Cas9-based promoter and 5′UTR-intron editing improves grain quality in rice[J]. Plant Biotechnology Journal,2020,18(12):2385-2387.
[54]邵高能,谢黎虹,焦桂爱,等. 利用CRISPR/CAS9技术编辑水稻香味基因Badh2[J]. 中国水稻科学,2017,31(2):216-222.
[55]沈兰,李健,付亚萍,等. 利用CRISPR/Cas9系统定向改良水稻粒长和穗粒数性状[J]. 中国水稻科学,2017,31(3):223-231.
[56]Xu R F,Li H,Qin R Y,et al. Gene targeting using the Agrobacterium tumefaciens-mediated CRISPR-Cas system in rice[J]. Rice,2014,7(1):5.
[57]Sun Y W,Zhang X,Wu C Y,et al. Engineering herbicide-resistant rice plants through CRISPR/Cas9-mediated homologous recombination of acetolactate synthase[J]. Molecular Plant,2016,9(4):628-631.
[58]Wang C,Liu Q,Shen Y,et al. Clonal seeds from hybrid rice by simultaneous genome engineering of meiosis and fertilization genes[J]. Nature Biotechnology,2019,37(3):283-286.
[59]Cai L L,Cao Y Y,Xu Z Y,et al. A transcription activator-like effector Tal7 of Xanthomonas oryzae pv. oryzicola activates rice gene Os09g29100 to suppress rice immunity[J]. Scientific Reports,2017,7(1):5089.
[60]Wu T,Zhang H M,Yuan B,et al. Tal2b targets and activates the expression of OsF3H03g to hijack OsUGT74H4 and synergistically interfere with rice immunity[J]. The New Phytologist,2022,233(4):1864-1880.
[61]Wang F J,Wang C L,Liu P Q,et al. Enhanced rice blast resistance by CRISPR/Cas9-targeted mutagenesis of the ERF transcription factor gene OsERF922[J]. PLoS One,2016,11(4):e0154027.
[62]Tang L,Mao B G,Li Y K,et al. Knockout of OsNramp5 using the CRISPR/Cas9 system produces low Cd-accumulating indica rice without compromising yield[J]. Scientific Reports,2017,7(1):14438.
[63]Miao J,Guo D S,Zhang J Z,et al. Targeted mutagenesis in rice using CRISPR-Cas system[J]. Cell Research,2013,23(10):1233-1236.
[64]Huang X R,Su F,Huang S,et al. Novel Wx alleles generated by base editing for improvement of rice grain quality[J]. Journal of Integrative Plant Biology,2021,63(9):1632-1638.
[65]盛夏冰,譚炎宁,孙志忠,等. 利用CRISPR/Cas9基因组编辑技术定向降低水稻落粒性[J]. 中国农业科学,2018,51(14):2631-2641.
[66]王加峰,郑才敏,刘维,等. 基于CRISPR/Cas9技术的水稻千粒重基因tgw6突变体的创建[J]. 作物学报,2016,42(8):1160-1167.
[67]Huang L Y,Zhang R,Huang G F,et al. Developing superior alleles of yield genes in rice by artificial mutagenesis using the CRISPR/Cas9 system[J]. The Crop Journal,2018,6(5):475-481.

