血清纤维蛋白原与白蛋白比值与缺血性脑血管病的相关性研究
李 波, 徐世成, 赵安容
缺血性脑血管病(ischemic cerebrovascular disease,IVD)是由脑部血管病变引发的疾病,主要病变类型包括腔隙性脑梗死(lacunar infarction,LI)、短暂性脑缺血发作(transient ischemic attack,TIA)[1],临床常见病因包括血液成分改变、血管壁病变及血流动力学变化[2]。颅内动脉粥样硬化是脑血管疾病的重要病理学基础,表现主要为脑血管弹性下降,脂质沉积等[3]。动脉粥样硬化是一种以免疫活动为特征的慢性炎性疾病[4],多种炎症细胞、炎症因子参与了动脉粥样硬化的发生发展[5]。促炎标志物在动脉粥样硬化相关疾病中的作用受到广泛关注。目前,纤维蛋白原(Fib)与白蛋白(Alb)比值(fibrinogen to albumin ratio,FAR)作为炎症和营养指标的综合性生物标志物已被证实是影响多种疾病患者生存预后的独立危险因素[6]。本研究通过分析FAR与缺血性脑血管病的关联性,为该类患者的诊断相关生物标志物的研究提供线索。
1 资料与方法
1.1 研究对象 选择2018年1月-2021年11月我院收治的226例IVD患者纳入研究,其中LI组109例,TIA组117例;男性107例,女性119例;年龄50~79岁。同时搜集同期健康体检患者33例作为对照组。纳入标准:(1)经CT或MRI检查符合腔隙性脑梗死;(2)符合TIA诊断标准(突然的、短暂的局灶性神经功能缺失发作,在24 h内完全恢复,无后遗症;常有反复发作,临床症状以运动、感觉和语言障碍为主;发作间歇期无神经系统症状和体征;头部CT或头部MRI检查查不出相应的责任病灶;发病年龄多在50岁以上,有心脏病和动脉粥样硬化,无颅内高压[7]。排除标准:合并严重肝肾功能损害、自身免疫性疾病、恶性肿瘤、长期服用抗感染药物、血栓及出血性疾病,确诊2周内患感染性疾病者。
FAR值根据公式FAR=Fib/Alb计算获得[8]。FAR的正常值为0.03~0.36,平均值为0.11,根据平均值将患者分为LI低FAR组(≤0.11,n=61)、LI高FAR组(>0.11,n=48)及TIA低FAR组(≤0.11,n=68)和TIA高FAR组(>0.11,n=49)。
1.2 研究方法 通过病历系统搜集所有研究对象的性别、年龄、吸烟史、饮酒史、身高及体重(用于计算身体质量指数:body mass index,BMI)、有无高血压或(和)糖尿病、有无合并冠状动脉粥样硬化性心脏病、Fib、Alb。
血生化检测仪(7180)购自日本日立公司,凝血功能检测(2000i)购自日本希森美康公司。
采用比色法检测血清白蛋白水平,免疫比浊法检测Fib水平。Fib和Alb的正常参考范围分别为:(2~4)g/L、(35~55)g/L。
1.3 统计学方法 采用SPSS 23.0电脑版软件进行统计分析。用描述统计方法统计患者临床病理特征,χ2检验进行组间临床病理特征比较。采用Logistic回归进行FAR对IVD影响的多因素分析,P<0.05为差异有统计学意义。采用ROC曲线评价FAR对脑血管病变常见类型(LI、TIA)的预测价值。
2 结 果
2.1 患者一般资料的相关检查的比较 LI组及TIA组中:两组患者年龄、有无高血压比较,差异有统计学意义(P<0.05);性别、吸烟史、饮酒史、BMI、有无糖尿病、有无冠心病比较,差异均无统计学意义(P>0.05)。因此,LI及TIA中高FAR组的发病年龄明显高于低FAR组,高FAR组的患高血压比例明显高于低FAR组(见表1)。
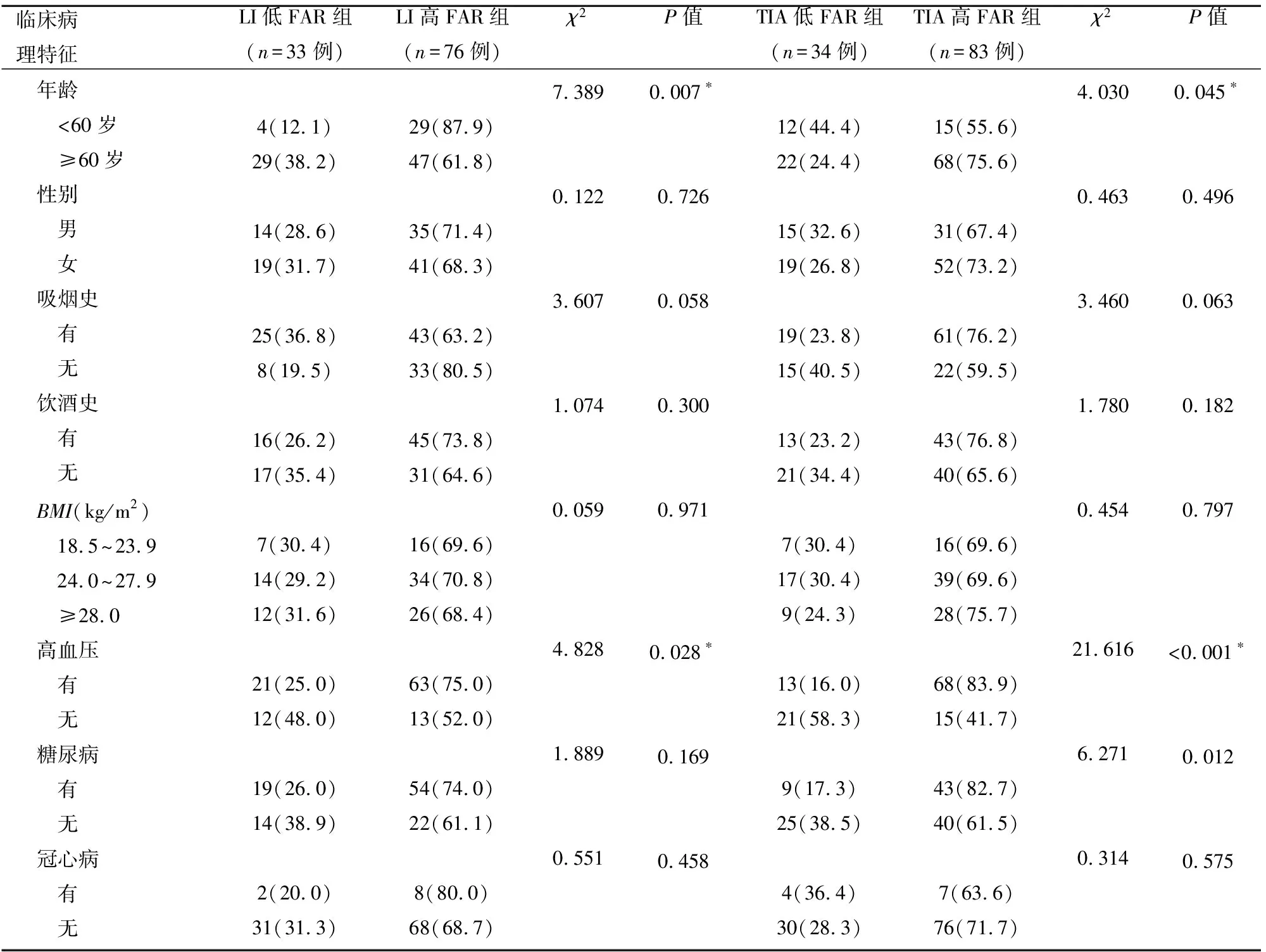
表1 一般资料的相关检查[n(%)]
2.2 LI组及TIA组与健康对照组FAR水平的比较 LI组:高FAR组中FAR较对照组及低FAR组FAR水平明显升高,差异有统计学意义(P<0.05);TIA组:高FAR组中FAR较对照组及低FAR组FAR水平明显升高,差异有统计学意义(P<0.05)(见表2)。

表2 LI组及TIA组与对照组FAR比较
*表示P<0.05有统计学意义。
2.3 LI组患者的多因素Logistic回归分析 将患者临床病理特征纳入多因素Logistic回归分析,分析显示:相比对照组:FAR、年龄(低FAR组)、有无吸烟史、BMI、有无高血压、有无糖尿病均是LI的独立危险因素(P<0.05)(见表3)。

表3 LI组患者的多因素Logistic回归分析
2.4 TIA患者的多因素Logistic回归分析 将患者临床病理特征纳入多因素Logistic回归分析,分析显示:相比对照组:年龄(高FAR组)、有无吸烟史、BMI、有无高血压、有无糖尿病均是TIA的独立危险因素(P<0.05);FAR不是TIA的独立危险因素(P>0.05)(见表4)。
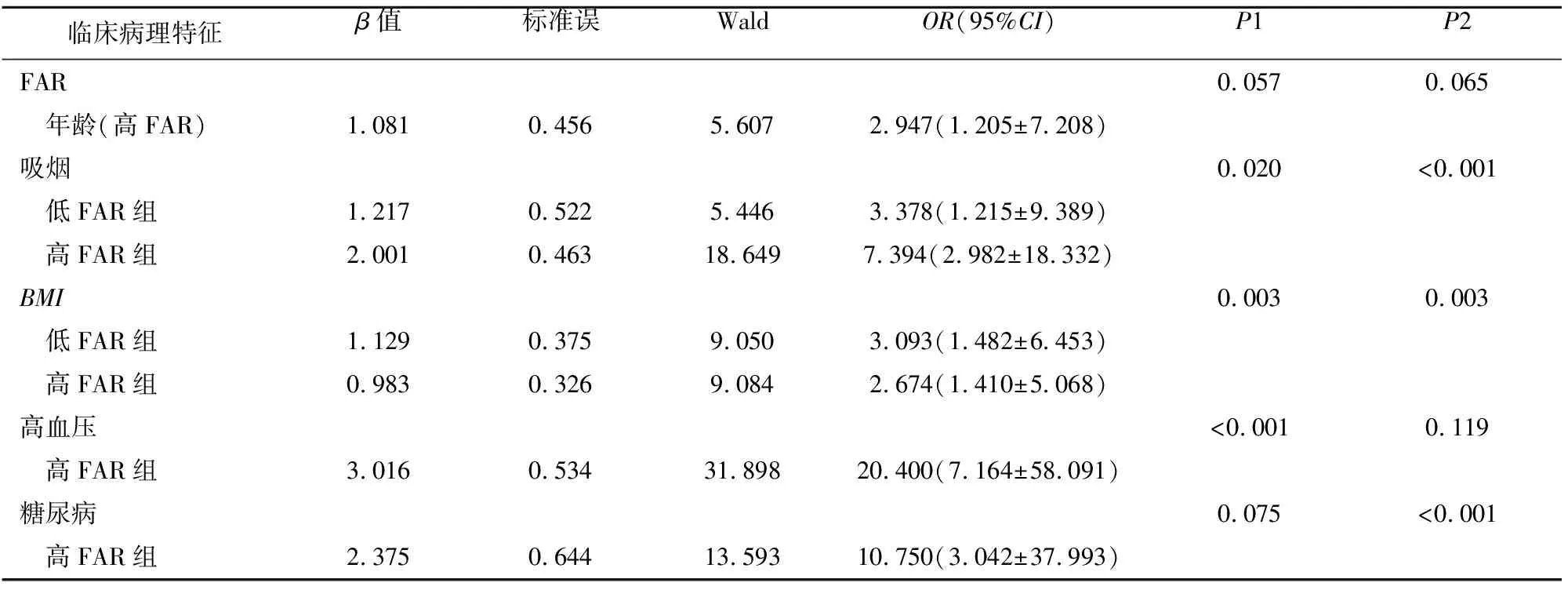
表4 TIA组患者的多因素Logistic回归分析
P1:低FAR组;P2:高FAR组。
2.5 FAR预测LI及TIA的ROC曲线 ROC曲线分析显示FAR是LI的良好预测因子,敏感性为73%,特异性为52%,曲线下面积为0.632。FAR作为TIA的预测因子预测效果差,敏感性为72%,特异性为45%,曲线下面积为0.572(见图1、表5)。


图1 FAR预测LI的ROC曲线;FAR预测TIA的ROC曲线

表5 FAR预测LI及TIA的价值
3 讨 论
我国老年人群中脑梗死的发病率、病死率均高,目前常用美国国立卫生研究院卒中量表(National Instituteof Health Stroke Scale,NIHSS) 作为评估脑梗死的重要工具。但单一指标对脑梗死的预测与评估准确率低,因此开发多种生物标志物以建立完整的评估体系评估脑梗死患者具有重要意义。目前已知炎症反应在脑梗死的发生、发展中具有重要作用[9]。患者机体持续慢性炎症可诱导外周血Fib、IL-6 和C 反应蛋白升高,而急慢性炎症又可诱导Alb 和pAlb水平的表达降低,因此Fib、Alb和pAlb都属于反应机体慢性炎症水平的重要指标[10]。一项研究表明[11],Fib水平升高则伴随着血管内皮损伤、血浆黏度增加,在脑血管中尤为突出。故Fib、Alb均与脑梗死的发生发展有关。国内外一些研究表明,FAR作为一种新型炎症标志物,与冠状动脉疾病的严重程度及强直性脊柱炎的疾病活动度相关[12,13],而FAR在脑梗死中的应用尚不明确。
本研究探索了治疗前血清纤维蛋白原与白蛋白比值与缺血性脑血管病主要类型(腔隙性脑梗死、短暂性脑缺血发作)的关系。结果显示,无论LI或TIA,高FAR组中FAR水平较对照组及低FAR组FAR水平明显升高,且差异有统计学意义(P<0.05)。排除性别、年龄、吸烟及饮酒史、BMI、高血压、糖尿病、冠心病等影响因素,FAR可作为LI的独立预测因子,且预测效果好。但在TIA中,FAR不能作为其预测因子。因此,炎性指标在预测LI中更有价值。这与Rajeshwar[14]及李伟等[15]的研究结果相似,对于LI患者,C反应蛋白(CRP)等炎性标志物水平可预测卒中风险及复发风险。一项对患者进行TOAST分型的研究指出,LI 患者同型半胱氨酸(HCY)、hsCRP、白细胞介素 6、基质金属蛋白酶 9 水平均升高,且差异有统计学意义,提示炎症反应在卒中发病机制中的重要作用[16]。国内外一系列研究表明,脑梗死发生后,血黏度增加,纤维蛋白原升高,坏死脑细胞以及周围缺血半暗带脑组织局部凝血因子水平增高,终将导致凝血和纤溶功能的失衡[17,18]。血浆纤维蛋白原可造成内皮功能损害,刺激平滑肌细胞增生迁移,使血小板发生黏附、聚集,从而形成血栓,并增强血小板的聚集性,增加血液黏稠度,且较高水平的血浆纤维蛋白原可刺激内皮细胞,直接损害血管壁。因此,Fib在脑梗死的发生发展中具有重要作用[19]。因此,本研究使用Fib/Alb作为预测、评估脑血管病变的一种指标,通过系统分析,得出科学的结论。
综上所述,FAR作为新型炎症和营养指标的综合性生物标志物可用于预测LI的发病、评估LI的严重程度及预后,具有高敏感性和高特异性。本研究局限性在于采取的是单中心、回顾性、非随机对照研究,样本量较小,所得出的结论准确性有待提高。下一步还需增加检测的时间点和延长研究的时间跨度,有必要采用多中心、不同种族的合作研究模式,以提供更可靠的LI病理学证据。

