3D打印技术在颅底肿瘤手术中的应用
刘青,杭伟
(天津市环湖医院 耳鼻咽喉科,天津 300350)
颅底解剖结构复杂,有许多重要的神经血管穿行,且位置深在,实际操作的风险较大[1-3]。近年来,内镜经鼻入路已成为颅底占位性病变手术治疗的优先选择,术前对颅底肿瘤及毗邻的血管进行准确定位十分必要,因此进行鼻内镜下微创手术不仅要求外科医生对解剖结构了解、掌握,更要有良好的手眼协调能力[4-5]。三维重建软件实现了颅底解剖的三维可视化,但是有时根据影像学数据重建的三维图像,与外科医生的实际需求存在一定差距,空间感、距离感欠佳[6-8]。随着3D打印技术在医学领域的广泛发展与应用,可根据外科医师的实际需求铸造颅底占位个性化的三维模型,如实反映病变与毗邻结构的空间关系[9-13]。本研究应用3D打印技术构建颅底瘤性病变的个体化三维立体模型,探讨其在颅底肿瘤外科手术中的应用价值。
1 资料与方法
1.1 一般资料
收集2019年5月—2021年1月天津市环湖医院诊治的15例复杂颅底肿瘤患者的临床资料,且患者均接受经鼻内镜手术治疗,临床资料详见表1。15例患者术前均经影像学检查考虑为颅底复杂占位性病变,且术后病理证实诊断。其中男8例,女7例,年龄28~66岁,平均年龄(47±11)岁。所有患者的病变均累及颅底,且均采用经内镜或内镜联合显微镜手术治疗,术后病理证实诊断。本研究所涉患者及其家属均已签定知情同意书。
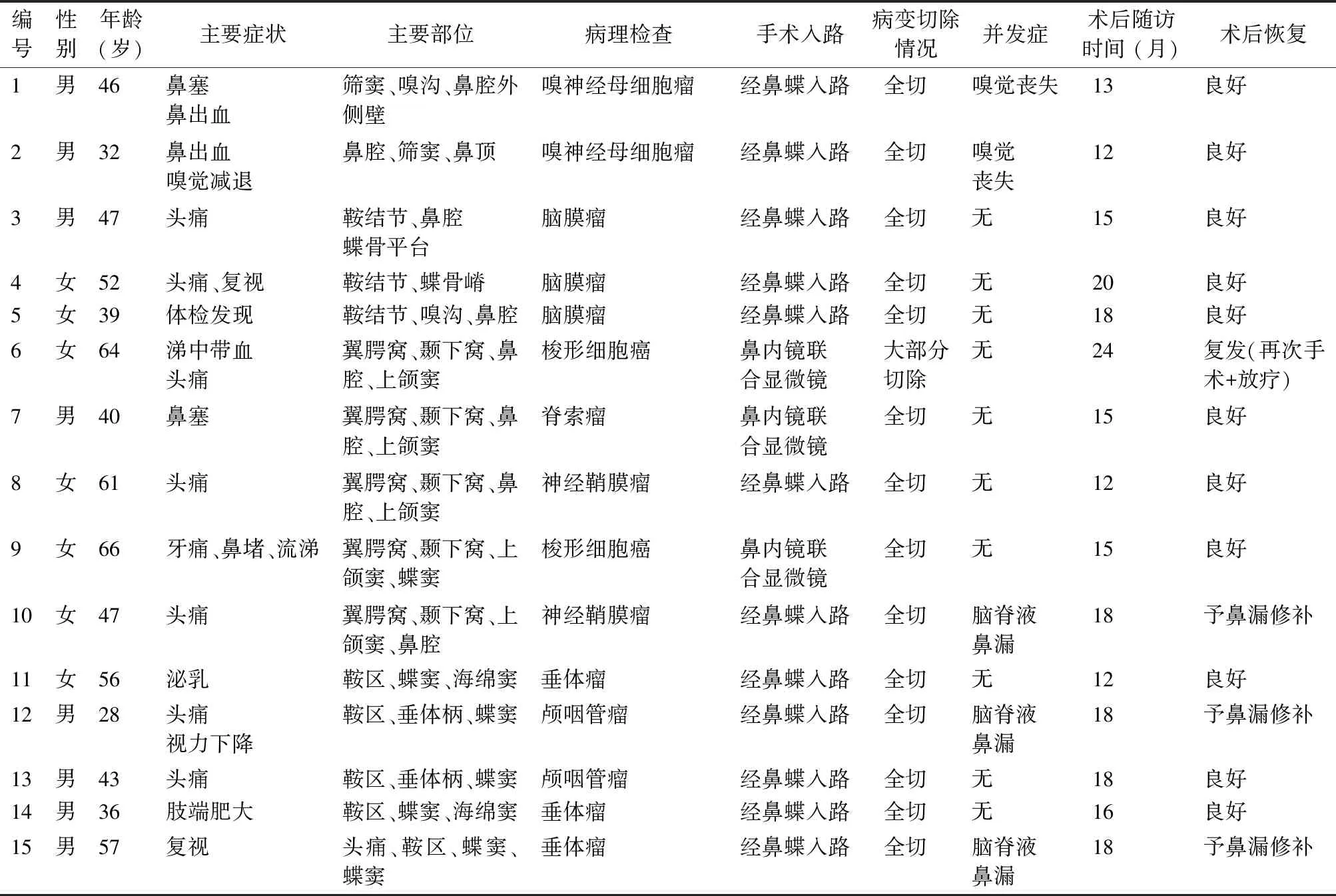
表1 15例鼻颅底肿瘤患者的基本临床资料
纳入标准:①CT、MRI等影像学检查证实其位于颅底区域的复杂瘤性病变,这些肿瘤位置深在,周围大量血管神经穿行,如颅内外沟通瘤、包绕颈内动脉的肿瘤等[14-15]。②术前及术后均有患者完整的影像学数据及病理资料。排除标准:术后复发的瘤性病变或术前曾接受过放/化疗治疗。
1.2 三维模型重建与3D打印
根据患者CT、MRI、计算机断层扫描血管造影(computed tomography angiography CTA)的原始数据,将其导入3D打印软件(“MINICS”软件),构建出颅底占位的三维虚拟模型,再利用3D打印机打印成个体化的3D树脂实体模型。
1.2.1 影像学检查及数据资料 使用LightspeedVcT64排螺旋CT扫描仪(美国,GE公司)对本组15例患者均行头颅CT薄层扫描和CTA检查[4,16]。CT扫描所采用的具体参数有:管电压120 kV,管电流300 mA,视野(field of view,FOV)24 cm×14 cm,扫描层厚32 mm×0.6 mm。CTA检查使用的对比剂是非离子型碘帕醇(100 mL,370 mg/mL),由下至上从主动脉弓水平扫描到颅顶,流速是4.5 mL/s。扫描参数为:管压120 kV,管电流150 mA,层厚1.25 mm,FOV 5 cm×18 cm,矩阵512×512。头颅扫描采用Skyra3.0T超导型MRI扫描仪(德国,Siemens公司),包括平扫和强化[15-17]。对患者进行3D T1-MPRAGE结构像的平扫,扫描序列包括DWI、T2WI、T1WI、FLAIR等常规扫描序列,强化扫描使用的对比剂是钆喷葡胺(DTPA),同CT扫描一致均经右肘静脉注入。等体素薄层扫描的具体参数包括:重复时间(repetition time,TR)1 900 ms,回波时间(echo time,TE)2.95 ms,矩阵230×230,FOV 230 mm×200 mm,反转时间(inversion time,TI)900 ms,各向异性分数(fractional anisotropy,FA) 9 degree[16-17]。
1.2.2 三维重建与虚拟模型构建 将患者的CT、MRI平扫及强化、CTA扫描生成的3组原始数据以数字医学图像通信标准(digital imaging and communication medicine,DICOM)格式保存,并导入“MINICS”软件再进行数据转换、优化处理,并进行三维影像重建。不同组织对应的像素灰度值范围的不同,分别设定不同的阈值,使用阈值分割算法将MRI中肿瘤的数据,CTA中动静脉、颅骨、软骨的数据提取出来[17]。
利用区域增长对不同组织、不同层面的图像以连续叠加的形式重建为三维虚拟模型[17-18]。
对生成的三维模型进行优化粉饰后,分别标记成不同颜色,再将CTA重建的动静脉及颅骨与核磁构建的个体化模型在3D软件上匹配、融合,构建出立体模型,随之将其导出为立体光刻法(stereo lithogarphy,STL)文件。再将导出的STL文件导入至MINICS软件,对模型进行裁割后转化为打印专用的叠片模型,并对裁切后的模型密集填充。重建后的三维模型能清楚地显示动静脉、颅骨及瘤变结构3者之间的空间位置关系。
1.2.3 3D打印及后处理 将模型裁切、填充后的STL格式文件导入3D打印软件,生成.ddt格式的文件,再将其格式文件导入专用3D打印机中进行打印。打印层厚为0.081 5 mm,利用熔融沉积成型(fused deposition modeling,FDM)技术逐层打印,按1∶1比例打印出个体化的三维立体模型,后期进行烘干、紫外线固化、抛光及着色雕刻处理,并对动脉与肿瘤分别予红色与褐色的着色粉饰。
1.3 术前评估及手术方案制定
在计算机软件上用不同的颜色标记模型的组织结构,选择性显示、缩放、旋转目标对象,便于明确颅底肿瘤的形态及与毗邻动静脉的空间位置关系。在MINICS软件上对进行术前评估,打印出3D模型后,术者可观察到模型的各个方位,根据占位累及范围及病理类型,制定个体化的手术决策,探讨不同手术入路的可行性。
1.4 术后评估
颅底肿瘤切除程度主要依据肿瘤切缘检查结果和术后影像学检查(CT、MRI平扫及强化)。肿瘤的切缘组织未见瘤性细胞,病理结果阴性且术后影像学检查显示无肿瘤病变残留为全切除;若肿瘤病变与颅骨、动静脉、神经等周围组织粘连而伴少许肿瘤残留为次全切除;若肿瘤病变残留部分≤10%为大部分切除;肿瘤病变残留组织>10%为部分切除[19]。
2 结果
2.1 3D打印出颅底肿瘤模型
本研究中的15例患者均顺利重建出颅底占位的三维虚拟模型并铸造了个体化的实物模型,清晰显示了瘤性病变与颅骨、鼻腔鼻窦、眼眶、海绵窦、上下矢状窦及毗邻动静脉血管的三维空间关系。
2.2 手术结果及病变切除情况
本研究中15例患者均按照术前规划施行内镜或内镜联合显微镜手术,手术路径与术前拟定方案一致。其中14例予全切除,1例行大部分切除(术后予放疗)。具体详见表1。3例患者术后出现脑脊液鼻漏,予卧床低钠饮食、降颅压等保守治疗1个月无效后行二次脑脊液鼻漏修补术,未出现再次脑脊液鼻漏。随访1~3年,14例患者术后恢复良好,均未出现严重并发症及死亡,1例大部分切除的患者(梭形细胞恶性肿瘤)术后复发,予再次手术+足量调强放疗的结合治疗后,头痛及涕中带血等症状缓解,术后复查MRI病变明显缩小。
3 典型病例
患者,老年,女性,主因“右侧牙痛3个月,鼻堵流涕1个月”入院。专科检查:右下鼻道可见暗红色新生物,延续至鼻咽腔,鼻咽右侧可见新生物,右侧咽隐窝及咽鼓管圆枕受压,显示欠清。右侧外耳道深处黏膜充血,鼓室积液征,鼓膜标志不清,见图1。鼻窦冠扫CT:右侧颌面部肿物,侵及周围结构,相应骨质破坏,右侧鼻咽肿物。头MRI平扫及强化示右侧咽旁间隙-颞下窝-上颌窦、筛窦及蝶窦占位性病变累及右侧海绵窦、眼眶外侧壁、眶尖、中颅窝底及斜坡;双侧筛窦及蝶窦异常信号,怀疑肿瘤性病变(图2A~D)。并完善头颈部CTA及三维重建(图2E、F)。2019年5月19日局部麻醉下鼻腔肿物活检术,病理回报:(右侧鼻腔、鼻咽侧壁)梭形细胞恶性肿瘤,结合免疫表型不除外恶性外周性神经鞘瘤。根据影像学数据,肿物与颈内动脉海绵窦段、颈外动脉的分支上颌、咽升动脉毗邻,未见明显包绕,三维重建出鼻颅底的病灶层次图(图3A~D)及虚拟模型(图3E~H)并打印出个体化实体模型(图3I)。在模型上模拟肿瘤切除范围及与周围重要血管的关系,避免术中损伤。2019年6月14日全麻下行鼻内镜联合显微镜颅底、鼻咽、咽旁肿物切除术(图4),患者术后恢复良好。术后第2天复查头部MRI示右侧颞窝及鼻咽部肿瘤术后改变(图5)。随访至今,未见肿瘤复发。
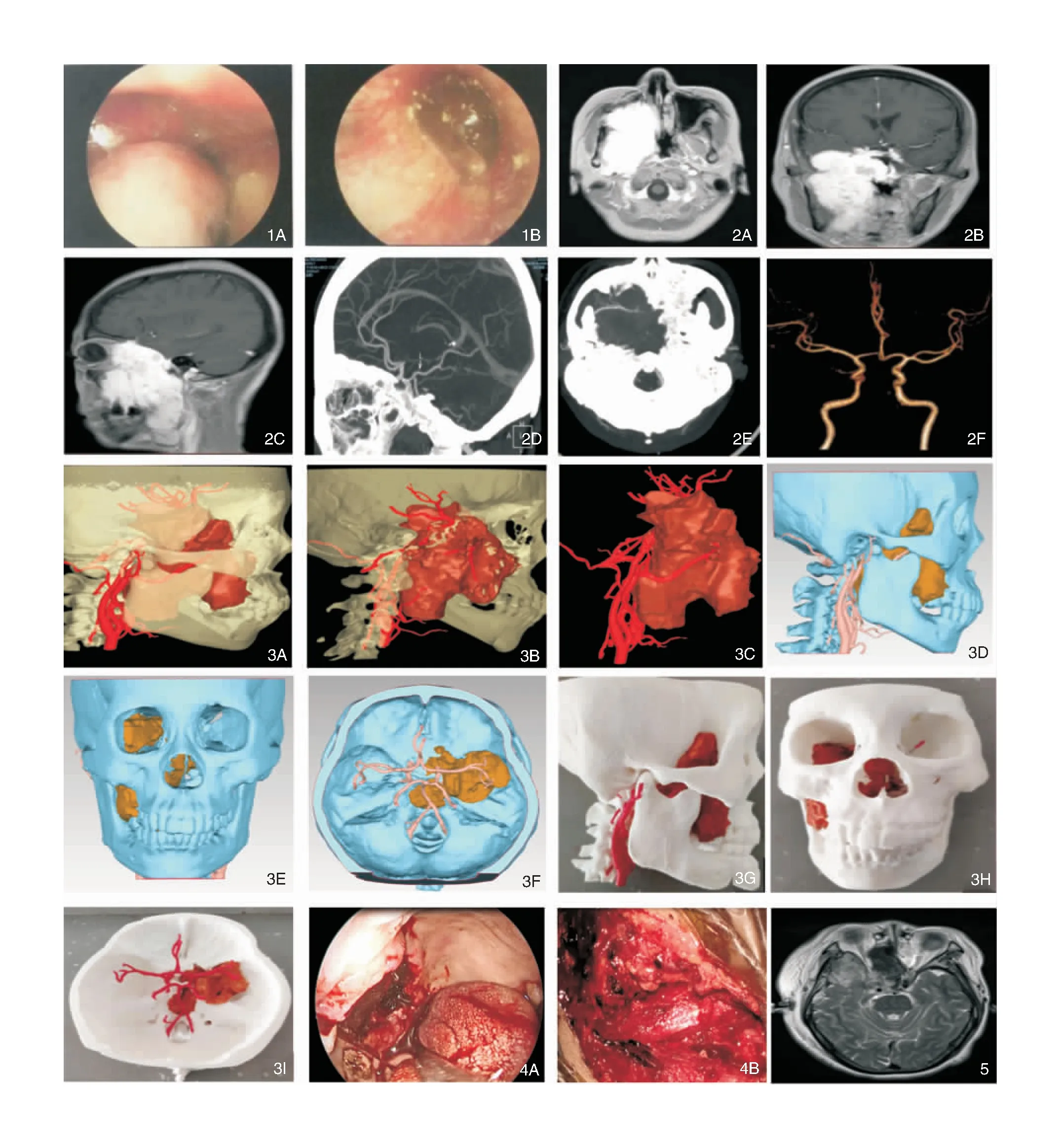
图1 鼻内镜(A)和耳内镜(B)检查 图2 术前头部MRI强化可见右侧咽旁间隙-颞下窝-上颌窦、筛窦及蝶窦占位性病变累及右侧海绵窦、眼眶外侧壁、眶尖、中颅窝底及斜坡 2A:水平位; 2B:冠状位; 2C:矢状位; 2D:三维重建矢状位; 2E:三维重建水平位; 2F:头颈部CTA可见右椎动脉V4段充盈纤细,鼻咽腔混杂密度肿块影 图3 三维重建及3D打印图 3A~C:根据影像学数据重建三维病灶层次图; 3D~F:三维重建的鼻颅底模型; 3G~I:3D打印机打印出的个体化实体模型 图4 全麻下行鼻内镜联合显微镜手术 4A:内镜下柯路氏+泪前隐窝联合入路行梭形细胞恶性肿瘤切除术; 4B:显微镜下恶性肿瘤切除术 图5 术后第2天复查头部MRI未见肿物残留
4 讨论
颅底重要神经、血管结构复杂的三维解剖和毗邻关系,使该区域成为众多研究、解剖和教学的重点[11,19]。3D打印技术于骨科及口腔颌面外科应用广泛,而在耳鼻咽喉颅底外科应用较少[19-21]。而本文主要集中在术前讨论、移植重建及临床教学3个方面进行研究。
4.1 3D打印实体模型用于术前规划与病例学术讨论
本研究建立的模型采用翻页式设计,模型切成冠状,相邻切片通过旋转轴连接,并可在3D模型上对重要血管神经进行定位或距离测量,选择并优化手术入路,预估手术难点及术后并发症,并尽可能避免其发生[22-24]。如典型病例是1例累及右侧咽旁间隙-颞下窝-鼻窦的梭形细胞癌,依靠常规二维影像学检查无法获取精确、立体的鼻窦-侧颅底的结构毗邻关系,根据3D打印模型可以评估肿瘤侵占范围及与颈内动脉、海绵窦、眶尖、椎动脉的毗邻关系。由于肿物累及范围广,因此本例选择鼻内镜联合显微镜入路鼻颅底、鼻咽、咽旁肿物切除术,手术过程与术前规划基本一致。综上所述,3D打印的实体模型有助于术前评估,尽可能减少术后并发症,这对于高度复杂或罕见的颅底肿瘤患者的手术计划有重要意义[25]。
许多颅底肿瘤周围包绕颈内动脉等大血管,案例比较复杂,可以借助于3D打印模型促进颅底肿瘤领域学术交流与发展。另一方面,在手术前我们可以借助3D打印模型与助手、麻醉医师、器械护士交代病情,告知术中注意事项及手术操作难点,使得在术中沟通更方便,并可减少或避免手术失误。本研究中15例患者均在术前进行详实的手术规划及术前案例讨论,并按照术前规划完成颅底肿瘤切除。我们在术后利用3D打印技术将手术过程复刻成三维仿真动画,在医师间进行讨论和学习。
4.2 3D打印实体模型用于移植与重建
脑脊液鼻漏可以由手术操作不当和颅底缺陷过大所引起[8,23-26]。为了防止发生,我们在完整暴露鞍底的同时,划定鞍底暴露区域。该方法有两个优点:一是减少了对周围组织的损伤,避免了因颅骨缺损过大而导致脑脊液鼻漏;其次,它为我们提供了支持数据。一旦发生脑脊液鼻漏,我们可以根据暴露区域的大小选择合适的修复材料[8,26-28]。
近年来研究表明利用生物材料打印出术区三维立体模型,制备出的个体化3D生物结构,可作为外来生物移植物,代替骨、软骨等患者自身的组织结构,移植到鼻颅底缺损部位,进行缺损修补及重建[29-30]。尽管本研究中15例患者的骨壁缺损均移植的是患者自身软骨组织,但关于3D打印实体模型用于移植及重建的研究已于耳鼻咽喉颅底外科手术中逐步发展起来[29-30],这对于指导临床彻底切除肿瘤组织、修复缺损具有重要意义。
随着3D打印技术的进步,许多中间步骤可能会被淘汰,我们将有能力直接打印医用假体和组织结构[30],甚至可以3D打印出干细胞生成组织,这些组织将用于填补病患缺损的组织器官[31-32]。
4.3 3D打印实体模型用于临床教学与操作训练
3D打印的个体化颅底模型更加精确、直观,可有效解决既往教学模型耗材多、花费大、重复利用性差的问题,也可降低直接对患者进行操作的风险,使得3D打印模型可成为一种实际、有效的外科培训方法[23,33-34]。本研究3D打印出的颅底模型可精准显现出筛泡气房、颅底动脉血管等精细结构,便于术者了解颅底的空间关系,包括翼腭窝的边界、视神经管与颈内动脉的位置关系以及它们在蝶窦壁的对应位置等。目前我们所使用的颅底仿真培训模型采用与人体骨、软骨结构相似的材料,并且附有复合纤维材料制成的软组织黏膜,保证了模型触感的真实性,显著提升了临床医师的培训效果,缩短了培训周期[33-34]。3D打印模型可成为尸头、标本等解剖训练工具的有效替代品。
总之,3D打印技术在耳鼻咽喉颅底外科未来的发展方向应侧重于颅底肿瘤术后病变受损部位的移植、重建,本文研究对象数量较少,今后应增加病例数,扩展及补充本研究的不足。

