大豆GmFLK基因的克隆及特性分析
赵胜男,高美欣,于朝杭,聂凯悦,王浩然,孟 杰,朱 虹,李 帅
(1.青岛农业大学 生命科学学院,山东 青岛 266109;2.青岛农业大学 园林与林学院,山东 青岛 266109;3.青岛农业大学 农学院,山东 青岛 266109)
大豆是一种重要的经济作物,富含植物油和蛋白质,是一种不可或缺的食用和饲用杂粮。我国超过85%的大豆依赖进口,主要原因是我国大豆产量低[1]。在耕地面积有限的情况下,提升大豆单产是促进大豆生产的有效途径。通过研究大豆功能基因,利用生物技术对大豆进行定向改造,进而提高大豆的单产水平,是提升大豆供给的重要途径[2]。随着生物技术的发展,越来越多的植物功能基因在生长发育过程中的作用得到揭示。
KH家族是一类含有KH保守结构域的核酸结合蛋白,可以结合DNA或RNA,其KH结构域含有70个保守的氨基酸残基,广泛存在于古细菌、细菌和真核生物[2-3]。人体中hnRNPK基因是人类发现的首个KH家族成员[4-5]。KH家族主要通过调控下游基因的剪接和转录,参与植物生长发育过程。在植物中,KH家族在拟南芥中已经鉴定,含有30个成员。这些拟南芥KH基因分为3个亚家族,它们分别含有6,9,15个KH成员[6]。拟南芥KH家族多个成员功能已经鉴定,主要参与RNA剪接和开花调控过程。例如,拟南芥KH家族成员AtRCF3(REGULATOR OF CBF GENE EXPRESSION 3)在特定组织中调控miRNA的生物合成,参与植物生长发育过程[7]。Atfly(FLOWERING LOCUS Y)突变体表现出开花时间提前的表型,进一步研究发现,AtFLY通过调控拟南芥MADS-box家族成员AtFLC(FLOWERING LOCUS C)的表达参与开花过程[8]。AtHEN4(HUA ENHANCER 4)通过调控AtFLC和AtMAF4(MADS AFFECTING FLOWERING 4)基因表达抑制拟南芥开花[9-10]。
AtFLK(FLOWERING LOCUS KH DOMAIN)属KH家族成员,含有3个KH保守区域,通过自主途径调控拟南芥开花时间[11-12]。AtFLK通过抑制AtFLC基因的表达调控植株开花时间。与野生型拟南芥相比较,Atflk突变体中正确剪接的AtFLC转录物高度积累,进而导致AtFT(FLOWERING LOCUS T)和AtSOC1(SUPPRESSOR OF OVEREXPRESSION OF CONSTANS 1)表达量降低,延迟拟南芥开花时间[13-14]。AtPEP(PEPPER)是AtFLK的同源基因,参与拟南芥开花时间调控,与AtFLK存在拮抗作用,Atpep突变能够回复Atflk突变体表型[15]。此外,AtFLK通过与其他蛋白相互作用,调控MADS-box家族成员AtAG(AGAMOUS)基因mRNA的加工,参与花形态的形成过程[16]。菊花CmFLK基因能够回复拟南芥Atflk突变体晚花表型,同时CmFLK基因过表达能够促进拟南芥和菊花植株开花。CmFLK蛋白通过与CmERF110蛋白互作,调控CmLHY(LATE ELONGATION HYPOCOTYL)、CmGI(GIGANTEA)、CmCO(CONSTANS)和CmTOC1(TIMING OF CAB EXPRESSION 1)等生物钟相关基因的表达,进而调控菊花开花时间[17]。
大豆开花时间对大豆生产具有很大影响,因而研究大豆开花时间相关基因功能对于大豆定向改良具有重要意义。FLK基因在植物开花过程中具有重要作用,然而大豆GmFLK基因信息尚不清楚。本研究利用同源比对和聚类分析,克隆大豆GmFLK基因,并对其进行亚细胞定位和表达模式分析。该研究的开展将为后续解析大豆GmFLK参与开花期调控作用机制提供理论基础,同时也为大豆定向遗传改良提供基因资源。
1 材料和方法
1.1 试验材料及生长条件
试验过程中选取的材料为大豆Williams 82(用于基因克隆及表达分析)和本氏烟草(用于亚细胞定位分析)。本氏烟草在培养室中培养,光照时长16 h,黑暗时长8 h;光照时的温度为22 ℃,黑暗时的温度为20 ℃,湿度60%。大豆长日照生长条件为:光照时长16 h,黑暗时长8 h;光照时的温度为25 ℃,黑暗时的温度为25 ℃;短日照生长条件为:光照时长8 h,黑暗时长16 h,光照时的温度为25 ℃,黑暗时的温度为25 ℃。取生长20 d的Williams 82为试验材料,从光照开启后开始取样,每隔4 h取1次,共取6次,每次取3个生物学重复,用于基因表达分析。利用在山东青岛大田中生长50 d的大豆植株,取花、叶、根、种子和茎等组织,用于分析目的基因表达,每个样品取3个生物学重复。
1.2 GmFLK基因生物信息学分析
利用拟南芥AtFLK(At3g04610)蛋白氨基酸序列,在Phytozome13(https://phytozome-next.jgi.doe.gov/)网站上查找其同源关系最近的大豆基因,即GmFLK基因。从Phytozome13网站获得GmFLK基因非编码区、外显子和内含子序列,利用GSDS软件(http://gsds.gao-lab.org/)分析GmFLK基因结构[18]。为鉴定大豆GmFLK蛋白理化性质,利用ExPASy(https://web.expasy.org/protparam/)中ProtScale和ProtParam工具分析GmFLK蛋白氨基酸的理化性质。利用NCBI(National Center for Biotechnology Information,https://www.ncbi.nlm.nih.gov/)中的Conserved Domains,选择CD Search,输入GmFLK氨基酸序列预测GmFLK蛋白的保守结构域。为研究GmFLK蛋白结构,分别利用PSIPRED软件和AIphaFold2软件(https://alphafold.ebi.ac.uk/)预测GmFLK蛋白的二级结构和三维结构[19-21]。
1.3 启动子区域顺式作用元件分析
为鉴定大豆GmFLK基因启动子区域顺式作用元件,从Phytozome13网站获得GmFLK基因起始密码子ATG上游2 000 bp区域碱基序列;然后利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)软件对启动子区域碱基序列进行分析[22];最后根据其种类、位置、数量、序列和功能将其分别列出。
1.4 进化树分析
在NCBI数据库中输入拟南芥AtFLK氨基酸序列,查询其在拟南芥、水稻、苜蓿、大豆、花生等植物中的同源蛋白,下载氨基酸序列。在分析亲缘关系过程中,利用MEGA 7.0 软件分析这些同源基因氨基酸序列,根据邻接法(Neighbor-joining method)及默认参数构建系统进化树[23]。
1.5 大豆GmFLK基因克隆及载体构建
根据GmFLK基因CDS序列,设计无缝组装引物用于扩增目的基因(表1)。以大豆叶片cDNA为模板,构建30 μL PCR扩增体系,克隆GmFLK基因。PCR所用的高保真酶为擎科生物的2×T5 SUPER PCR MIX(COLONY),PCR扩增程序如下:预变性95 ℃ 3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸1 min,共32个循环;72 ℃延伸5 min。通过电泳得到扩增的GmFLK基因片段,然后进行产物纯化。利用SacⅠ和BamHⅠ切割pCAMBIA1300(GFP)载体,得到线性载体。将纯化的GmFLK基因片段和载体片段进行无缝组装,体系如下:取GmFLK基因片段1 μL,pCAMBIA1300线性载体4 μL,擎科生物-TreliefTMSoSoo Clonking Kit Ver 5 μL,后转化大肠杆菌。用涂布器将大肠杆菌涂布在LB培养基上(含卡那霉素),在37 ℃下培养15 h左右。挑取单菌落,在37 ℃摇床上培养。5 h后进行菌液PCR鉴定,将阳性克隆进行测序,测序成功后提取质粒并转入农杆菌GV3101。步骤简述如下:取1 μL质粒加入50 μL感受态细胞中,慢慢混合,低温处理 5 min后液氮速冻5 min,迅速转入37 ℃水浴5 min,然后加入1 mL YEP液体培养基,在28 ℃下轻轻摇动5 h,5 000 r/min离心2 min,倒去大部分上清液,重悬菌体,涂布在YEP固体培养基上,28 ℃倒置培养48 h后挑取单菌落,28 ℃振荡培养5 h后利用菌液进行PCR,将阳性克隆用于后续试验。
1.6 GmFLK蛋白亚细胞定位分析
利用含有表达载体农杆菌菌液,注射生长28 d的本氏烟草,在烟草中进行GmFLK蛋白亚细胞定位分析[24]。过程简述如下:取YEP固体培养基中3个直径约2 mm的菌落接种到含有10 mL AB medium液体培养基中(含100 μm 乙酰丁香酮),28 ℃过夜培养,4 000 r/min离心15 min收集菌体。用10 mL 1/2 MS基础培养基(含100 μm乙酰丁香酮)重悬清洗,重复2次,最后将菌液OD600值调整至0.8左右。将菌液装入5 mL注射器内,从烟草下表皮进行注射,以pCAMBIA1300空载体代替GmFLK表达载体的菌液作为对照。黑暗培养48 h后,利用激光共聚焦显微镜观察GFP荧光在烟草叶片细胞中的分布情况。
1.7 大豆GmFLK基因表达分析
提取在不同光周期条件下生长大豆叶片以及大田中收获的大豆不同组织的RNA,经反转录后,进行实时荧光定量PCR,具体步骤如下:将取好的样品放入预冷的研钵内磨为粉末状,加入裂解液进行离心。向裂解液中添加无水乙醇,转移至Plant RNA Mini Column后离心,弃滤液。再依次添加600 μL Buffer RWA 、750 μL Buffer RWB,12 000 r/min离心后去除滤液。重复添加750 μL Buffer RWB,12 000 r/min离心1 min后弃滤液,将Plant RNA Mini Column的吸附柱转移于2 mL Collection Tube上,12 000 r/min离心2 min后将Plant RNA Mini Column放置在新的RNase Free Tube,加入RNase Free Water静置5 min后离心得到RNA,去除基因组DNA,得到反应液。构建20 μL反转录体系,反应液10 μL,5×EvoM-MLV RT Reaction Mix 4 μL,RNase free water 6 μL。以反转录得到的cDNA,进行实时荧光定量PCR反应。运用荧光定量PCR仪器(QuantStudioTM5 System)进行定量PCR反应。构建10 μL的反应体系,ZXSYBR®Green Pro TaqHS Premix(ROX Plus)5 μL,大豆Williams 82不同时间段的cDNA 0.5 μL,上下游引物分别为0.5 μL,RNase free water 3.5 μL。扩增程序为:保温阶段温度设定为95 ℃,时间为30 s,PCR阶段温度设定为95 ℃,5 s和60 ℃,30 s,共40个循环。最后利用大豆基因GmCons4作为内参[25],采用2-ΔΔCt计算GmFLK基因表达量。实时荧光定量PCR引物见表1。
2 结果与分析
2.1 GmFLK生物信息学分析
为克隆大豆GmFLK基因,利用拟南芥AtFLK氨基酸序列,在Phytozome13网站上通过同源比对查询大豆同源蛋白,获得AtFLK同源基因Glyma.19g246200,将其命名为GmFLK。GmFLK属于KH-I亚家族,含有保守的KH domain(图1-A)。GmFLK基因全长6 806 bp,编码区域为1 341 bp,含有6个外显子,5个内含子(图1-B)。编码446个氨基酸,分子量大小为47.031 ku,等电点为5.46,为酸性蛋白。GmFLK蛋白不稳定系数为43.87,其分子式为C2072H3258N580O645S13,蛋白质脂溶性指数为78.09。利用ProtScale软件分析GmFLK氨基酸序列,结果表明,GmFLK蛋白为亲水性蛋白,其第9个位点亲水性最好,数值为-2.222,第340个位点疏水性最好,数值为1.611。为进一步了解GmFLK蛋白结构,对其二级和三维结构分别进行预测。结果表明,GmFLK蛋白主要由3种结构组成:α-螺旋、β-折叠和无规则卷曲(图2-A),它们在GmFLK蛋白中所占比例分别为:24.44%,14.80%和60.76%。利用AlphaFold2软件预测蛋白质三维结构,结果表明,GmFLK蛋白的三维结构所含α-螺旋、β-折叠和无规则卷曲数量与二级结构吻合(图2-B)。

图1 GmFLK基因保守结构域和基因结构分析

图2 GmFLK蛋白二级结构和三维结构预测
2.2 GmFLK亲缘关系分析
为鉴定GmFLK亲缘关系,利用拟南芥AtFLK氨基酸序列查询水稻、苜蓿、花生和玉米等植物中同源蛋白,获得其亲缘关系较近蛋白用于进化树分析,分别为:拟南芥At3g04610、At4g26000、At5g15270、At1g51580,大豆Glyma.03g248200、Glyma.19g162000、Glyma.10g033900,水稻Os03g42900、Os12g40560、Os10g41440、Os10g27470,苜蓿Medtr1g070380、Medtr7g115340、Medtr4g127380、Medtr2g038020,花生ArahyUPVY9X、ArahyQL2VNI、ArahyNIEN0T、Arahy-E4TWYF,玉米Zm00001d013712T009、Zm00001-d013712T004、Zm00001d030968T006。利用MEGA 7.0软件分析这些蛋白的氨基酸序列,构建系统进化树(图3)。由系统进化树可以看出,与大豆GmFLK同源关系最相近的是大豆Glyma.03g248200,且Glyma.03g248200与拟南芥AtFLK氨基酸序列相似性为51.51%。其次为苜蓿Medtr7g115340和花生ArahyUPVY9X、ArahyQL2VNI(图3)。为鉴定GmFLK与其同源蛋白的相似性,将GmFLK与其同源关系较近的蛋白进行比对分析,包括拟南芥At3g04610、大豆Glyma.03g248200、苜蓿Medtr7g115340和花生ArahyUPVY9X、ArahyQL2VNI,结果显示,它们的相似性分别为52.22%,96.41%,80.89%,75.81%和76.63%(图4)。

图3 GmFLK系统进化树分析

图4 GmFLK蛋白及其同源蛋白序列比对
2.3 GmFLK启动子顺式作用元件分析
为解析GmFLK基因的潜在功能,对其启动子区域顺式作用元件进行分析。共发现10类顺式作用元件,分别为ARE、TGACG-motif、CAAT-box、TATA-box、Box 4、GATA-motif、GT1-motif、I-box、Sp1、circadian(表2)。这些顺式作用元件按照其功能,主要可以分为3大类,分别为逆境相关元件(对厌氧诱导顺式作用元件、参与MeJA响应的顺式作用调控元件)、启动子基本元件(启动子和增强子区域常见的顺式作用元件、核心启动子元素在转录开始的-30左右)、光反应相关元件(参与光响应的保守DNA模块的一部分、光响应元件的一部分、光敏元件、参与昼夜节律控制的顺式作用调节元件)。这三类元件含有的数量分别为3,42,10个(表2)。在上述10类顺式作用元件中,有6类与光反应有关,分别为Box 4、GATA-motif、GT1-motif、I-box、Sp1和circadian,因而推测GmFLK基因可能参与生物钟或光反应相关途径。

表2 GmFLK启动子区域顺式作用元件分析
2.4 GmFLK基因表达分析
为研究GmFLK基因表达模式,利用实时荧光定量PCR分析GmFLK基因在不同组织表达(图5-A)。结果表明,GmFLK基因在花、叶、根、种子、茎组织中均有表达,但表达量有所不同。GmFLK基因在大豆叶和种子中表达量相对较高,在花中表达量相对较低。因而推测GmFLK可能在不同组织中具有不同的功能。由于GmFLK启动子区域含有多个光反应元件,因而对GmFLK基因在不同光周期条件下一天不同时间点的表达进行分析。对生长在长短日照的大豆叶片进行分析,发现GmFLK基因在长日照和短日照条件下表达没有明显差异,表现出相似的表达模式。然而GmFLK在一天中不同时间点表达量不完全相同,在光照4 h表达量最低,在光照0,12 h时表达量较高,因而推测GmFLK可能参与生物钟相关功能途径(图5-B)。
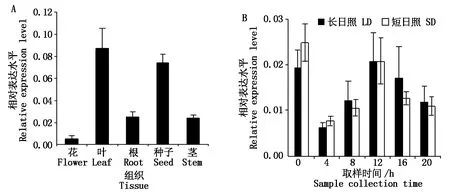
A.GmFLK基因在不同组织表达分析;B.GmFLK基因在不同光周期条件下表达分析:0~20为光照开启后取样时间,LD.长日照,SD.短日照。A.The expression of GmFLK gene in different tissues;B.The expression of GmFLK gene throughout the day under different photoperiod conditions:0—20 indicate the time after lights on,LD.Long day condition,SD.Short day condition.
2.5 GmFLK亚细胞定位分析
为分析GmFLK亚细胞定位,利用GmFLK基因序列设计引物,以大豆Williams 82材料cDNA为模板,扩增GmFLK基因,并利用琼脂糖凝胶电泳进行检测(表1、图6-A)。扩增片段测序后与大豆基因组数据库中GmFLK的CDS序列进行比对,序列完全一致,利用该片段进行后续载体构建。为构建35S∷GmFLK∶GFP载体,利用限制性内切酶切割目的载体(图6-B),然后与GmFLK片段连接。转入大肠杆菌,并进行菌液PCR鉴定和双酶切鉴定(图6-C、D),经测序后确认载体构建成功(图7)。
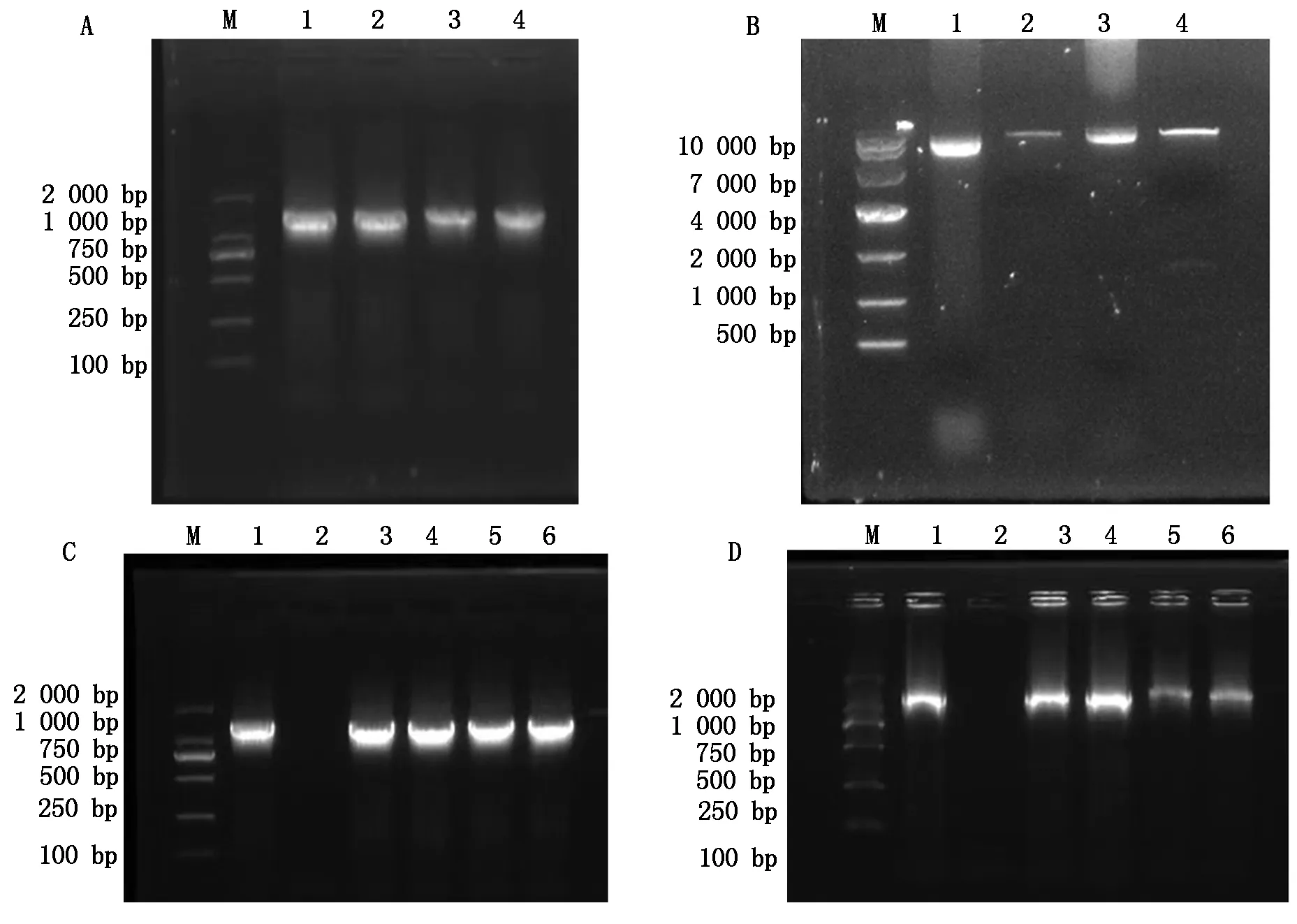
A.GmFLK基因PCR扩增电泳图:M.DL2000 Marker,1—4.GmFLK基因CDS片段扩增,约1 300 bp;B.pCAMBIA1300空载体和GmFLK表达载体经Sac Ⅰ和BamH Ⅰ双酶切:M.DL10000 Marker,1.pCAMBIA1300未酶切质粒,2.pCAMBIA1300经Sac Ⅰ和BamH Ⅰ双酶切后的线性质粒,3.GmFLK表达载体未酶切质粒,4.GmFLK表达载体经Sac Ⅰ和BamH Ⅰ双酶切后的线性质粒;C.GmFLK表达载体转化大肠杆菌:M.DL2000 Marker,1.阳性对照,2.阴性对照,3—6.单克隆菌液PCR;D.GmFLK表达载体转化农杆菌:M.DL2000 Marker,1.阳性对照,2.阴性对照,3—6.单克隆菌液PCR。A.Amplification of GmFLK gene:M.DL2000 Marker,1—4.Amplification of GmFLK CDS fragment,approximately 1 300 bp;B.pCAMBIA1300 and GmFLK expression vector plasmid digested using SacⅠand BamHⅠ:M.DL10000 Marker,1.pCAMBIA1300 plasmid,2.pCAMBIA1300 plasmid digested using SacⅠand BamHⅠ,3.GmFLK expression vector,4.GmFLK expression vector digested using SacⅠ and BamHⅠ;C.Transformation of GmFLK gene into Escherichia coli:M.DL2000 Marker,1.Positive control,2.Negative control,3—6.PCR of clones;D.Transformation of GmFLK gene into Agrobacterium tumefaciens:M.DL2000 Marker,1.Positive control,2.Negative control,3—6.PCR of clones.

图7 GmFLK基因亚细胞定位载体模式图
将测序正确的GmFLK基因表达载体转化农杆菌感受态细胞GV3101,进行菌液PCR(图6-D),结果表明,GmFLK基因已成功转化农杆菌。为检测GmFLK蛋白亚细胞定位情况,将其注入本氏烟叶片中,以pCAMBIA1300空载体作为对照。使用激光共聚焦显微镜观察绿色荧光在烟草细胞中的分布情况。结果表明,pCAMBIA1300空载体的绿色荧光信号在烟草细胞各个部位都有表达,包括细胞核、细胞质和细胞膜。在注射 pCAMBIA1300-GmFLK载体叶片细胞中,绿色荧光的分布于空载体十分相似,因而推测GmFLK蛋白也在细胞核、细胞质和细胞膜中均有表达(图8)。
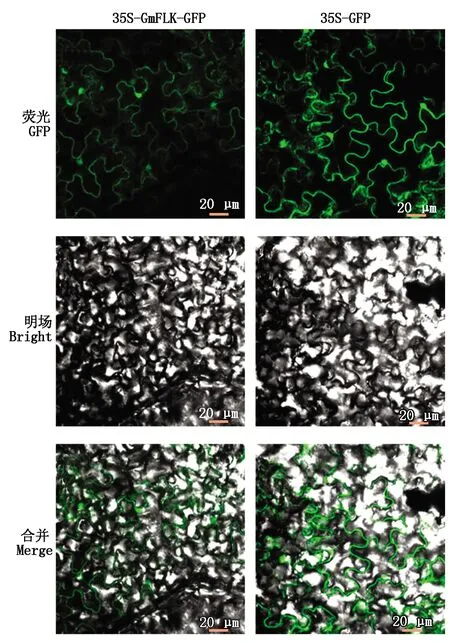
图8 GmFLK蛋白亚细胞定位分析
3 结论与讨论
大豆基因组在进化过程中经历了2次全基因组复制,产生多个复制基因,其功能在植物生长发育过程可能具有冗余[26-27]。进化树分析显示,GmFLK、Glyma.03g248200与拟南芥AtFLK位于同一进化分枝,均为拟南芥AtFLK同源蛋白,且GmFLK、Glyma.03g248200与拟南芥AtFLK氨基酸序列相似性分别为52.22%,51.51%。因而大豆GmFLK、Glyma.03g248200可能与拟南芥AtFLK基因具有相似的功能,参与植物开花调控过程。大豆GmFLK与Glyma.03g248200相似性为96.41%,且在大豆中同源关系最近,因而GmFLK与Glyma.03g248200可能来源于同一个祖先,在功能上具有一定的冗余。
蛋白亚细胞定位对蛋白功能具有重要的作用。FLK蛋白主要参与转录后调控,如细胞核中的转录、剪接调控,同时也能参与细胞质中少量RNA的修饰调控作用[11,17]。前人研究结果显示,拟南芥AtFLK和菊花CmFLK蛋白也是主要定位在细胞核中,同时在细胞质内也有表达,可能与其功能存在密切关系[11-12,17]。研究发现,GmFLK蛋白主要在细胞核中表达,但是细胞质和细胞膜中也有表达。表明大豆GmFLK蛋白与其他物种中的FLK蛋白的定位结果相似,推测它们可能具有相类似的功能。
顺式作用元件是转录因子结合的关键位点,在植物基因表达过程中具有非常重要的作用[28]。此外,基因表达除受顺式作用元件调控外,还会受到表观遗传学等多种因素调控[29]。菊花CmFLK能够促进拟南芥和菊花植株开花,并且生物钟相关基因在CmFLK转基因植株中表达发生改变,因而CmFLK在生物钟反应过程中具有重要的作用[17]。拟南芥AtFLK基因在拟南芥中调控途径逐渐解析,其主要通过2个途径调控AtFLC基因表达。首先拟南芥AtFLK基因可能通过结合AtFLC基因mRNA调控AtFLC的表达,参与自主途径调控开花时间;其次AtFLK可能通过促进AtTGA7(TGACG-binding family 7)调控AtFLC基因表达[14,30-31]。GmFLK启动子区域含有多种生物钟和光反应相关作用元件,并且GmFLK基因在不同时间点表达不同,因而GmFLK基因在生物钟反应过程中具有重要的作用。与拟南芥类似,大豆中GmFLK基因也可能通过调控GmFLC和GmTAG7等基因的表达,参与大豆自主途径调控开花时间。然而GmFLK基因在长日照和短日照条件下表达相似,因而GmFLK可能不参与光周期反应过程。此外,拟南芥AtFLK除参与调控开花时间外,还参与抗病过程。拟南芥Atflk突变体表现为对细菌病原体丁香假单胞菌抗性降低,对坏死性真菌病原体灰霉病的抗性增加[32]。GmFLK启动子区域除生物钟、光反应和启动子固有元件外还含有逆境相关元件,因此,GmFLK是否还具有其他功能需要进一步研究。
植物功能基因在生长发育过程中具有重要的作用,鉴定和解析植物功能基因作用机制,对于定向改造植物具有重要意义。本研究从大豆中克隆了一个KH家族成员编码基因。亚细胞定位结果显示,该蛋白在细胞核、细胞质和细胞膜中具有表达。进化分析表明,GmFLK为拟南芥AtFLK的同源蛋白,推测它们可能具有类似的功能。启动子元件分析发现,GmFLK基因启动子中包含了多种与光反应相关的顺式作用元件。表达分析结果显示,GmFLK在不同组织器官中具有表达,但表达水平有差异。同时GmFLK基因在长日照和短日照条件下表达模式相似,但在一天中不同时间点表达量不完全相同。由此推测,该基因可能参与生物钟反应过程。本研究为深入研究GmFLK基因调控开花期相关功能奠定了基础。

