水稻Osp39基因的组织表达和亚细胞定位分析
腾海艳
(宜春学院 化学与生物工程学院,江西 宜春 336000)
P39蛋白又称SP2(Suppressor of ppi1 locus 2)蛋白[1]或OEP80(Outer envelope protein 80),属于OMP85(Outer membrane protein of 85 ku)蛋白家族[2],该家族成员定位于叶绿体、线粒体膜或细菌细胞膜,参与蛋白质跨膜转运或膜上定位[2-3]。大部分OMP85蛋白由C端β-桶状跨膜结构域和N端多肽转运结合(Polypeptide transport associated,POTRA)结构域组成,β-桶状跨膜结构域是蛋白质通道,POTRA结构域的作用类似分子伴侣,能够结合被转运的蛋白质并将其传递到内膜[4],但是P39蛋白及其同源蛋白P36缺少POTRA结构域[3]。在拟南芥中,P39蛋白定位于叶绿体外膜[3],Hsueh等[5]发现,P39蛋白影响成熟拟南芥的代谢稳态,p39基因突变后,拟南芥成熟植株的光合活性和类囊体结构均发生改变,多条代谢途径出现异常。根据Ling等[1]的报道,拟南芥通过SP1蛋白、P39蛋白和CDC48(Cell division cycle 48)蛋白协作,促进叶绿体外膜转运蛋白的泛肽化和降解,从而控制外源蛋白质向叶绿体的输入,此过程称为叶绿体相关蛋白降解(Chloroplast-associated protein degradation,CHLORAD)机制,该机制不仅参与叶绿体蛋白的输入调控和氧化胁迫响应[1],在番茄中,还参与番茄有色体的发育,从而影响果实的成熟过程[6]。
蛋白质的输入调控影响着质体的功能和植物的光合效率,在农作物中,叶绿体和有色体的蛋白质输入调控还将影响到作物的产量、抗逆性及农产品品质[6-8]。在前期工作中,已经对CHLORAD机制中的sp1基因在水稻中的同源基因OsSP1(登录号:Os07g0647800)进行了研究,并发现该基因的CRISPR/Cas9基因编辑水稻植株具有严重的生长抑制表型,显示了叶绿体蛋白输入调控途径对水稻生长发育的重要影响[9-10]。为继续探究水稻的CHLORAD机制,本研究选择p39基因在水稻中的同源基因Osp39作为研究对象,通过生物信息学手段以及转录分析、原生质体瞬时表达等方法,确定该基因及其编码蛋白的结构和性质特征、组织表达情况及亚细胞定位情况,为深入研究Osp39基因的功能,进而为阐明水稻叶绿体蛋白质输入调控机制提供基础。
1 材料和方法
1.1 试验材料及生长条件
本研究使用的水稻(OryzasativaL.)为粳稻品种中花11,亚细胞定位、组织表达使用的土培和水培试验材料均种植于宜春学院苗圃,4—7月份自然温度和光照条件下生长,水培材料每3 d更换1次木村B营养液,常规管理。
1.2 主要试剂
RNA提取试剂盒和DNA回收试剂盒购自Magen公司,反转录试剂和DNA聚合酶购自诺唯赞公司,2×SYBR mix、EcoR Ⅰ和HindⅢ限制性内切酶、T4DNA连接酶均购自TaKaRa公司,原生质体制备使用的纤维素酶和离析酶购自Yakult公司,其他木村B营养液配制、凝胶电泳、原生质体制备、转化等试剂均为国产分析纯。
1.3 Osp39基因及其蛋白产物的生物信息学分析
基于拟南芥p39基因的mRNA序列及AtP39蛋白的氨基酸序列,在NCBI(https://www.ncbi.nlm.nih.gov/)网站通过Blast工具搜索水稻中的同源基因Osp39的mRNA序列和完整基因序列,以及水稻、玉米、大豆等共12 种植物的P39蛋白质序列。PLACE数据库和PlantCARE数据库进行启动子顺式作用元件分析,DNAMAN软件进行蛋白质氨基酸序列同源性分析,MEGA软件构建系统进化树,Expasy-ProtParam数据库进行蛋白质理化性质分析,SignalP数据库进行蛋白质信号肽预测,TMHMM数据库进行蛋白质跨膜区位置预测,SOPMA数据库进行二级结构元件分析,SWISS-MODEL数据库进行蛋白质空间结构预测,STRING数据库进行蛋白质互作分析,PredictProtein数据库进行亚细胞定位预测。
1.4 RNA提取和定量PCR分析
苗期水稻样品取自木村B营养液培养14 d的水稻苗,分别取根(叶鞘下约5 cm长)、叶鞘和由上至下第2 片叶片,扬花期水稻取自土培的扬花期水稻植株,分别取旗叶中段、茎和花(包括雌蕊、雄蕊和颖壳),每种样品均平行取样3 份,混合,快速放入液氮中,经试剂盒提取总RNA,反转录获得cDNA后,以cDNA作为模板,进行Osp39基因和内参基因OsActin1(登录号:Os03g07181000)的定量PCR扩增。定量PCR反应程序:95 ℃,3 min;95 ℃,15 s,60 ℃,30 s,40次循环。定量PCR反应体系:2×SYBR mix 5.0 μL;F、R引物(10 μmol/L)各0.5 μL;cDNA 1.0 μL;双蒸水补至10.0 μL。PCR结果用2-ΔΔCt法[11]进行计算,SPSS软件进行显著性分析。定量PCR引物序列见表1。
1.5 Osp39-gfp瞬时表达载体的构建
以1.4中获得的cDNA作为模板,扩增不含终止密码子的Osp39编码序列,PCR产物经凝胶电泳检测,DNA试剂盒回收后,采用酶切、连接法将酶切产物克隆到pOX载体的gfp序列上游的多克隆位点,构建OsP39蛋白与GFP蛋白的融合表达载体并转化大肠杆菌TOP10菌株。PCR扩增引物见表1。
1.6 亚细胞定位分析
一叶期土培水稻幼苗,取约5 cm长的叶鞘部分制备水稻原生质体[12],将OsP39蛋白与GFP蛋白的融合表达载体质粒转入原生质体,同时转化GFP蛋白的载体质粒作为对照,室温避光孵育过夜后,激光共聚焦显微镜(Carl Zeiss,LSM7 DUO)观察绿色荧光蛋白GFP在细胞内的定位情况。
2 结果与分析
2.1 Osp39基因的结构
在NCBI数据库通过Blast功能获得水稻Osp39基因序列,结果显示,Osp39基因位于水稻5号染色体,基因登录号为Os05g0510200,基因编码区共有11个短外显子,L6 loop区保守序列的编码区位于第9外显子上,转录产物无可变剪切方式(图1),成熟mRNA的编码区长1 086 bp,使用该编码区序列进行Blast,在水稻基因组中未找到其他功能相关的同源序列。
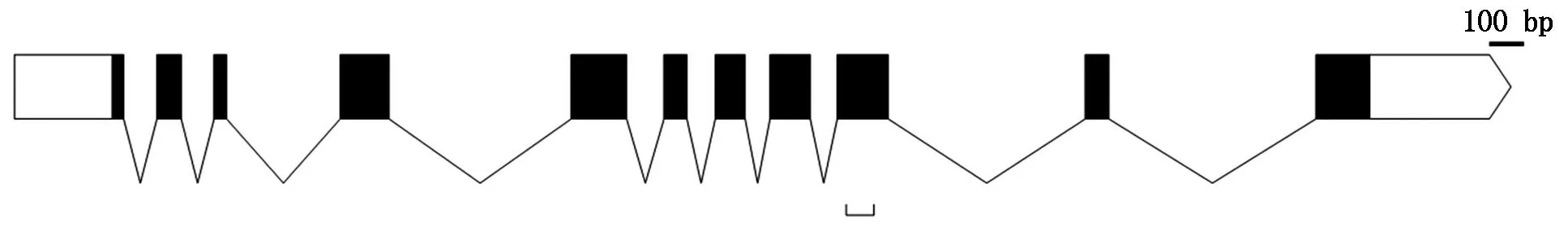
下括号位置为 L6 loop区编码位点。
2.2 Osp39启动子的上游元件
从Osp39基因起始密码子ATG前面截取长度为2 200 bp的上游启动子序列,使用PLACE数据库和PlantCARE数据库进行启动子顺式作用元件分析,结果显示,Osp39启动子中含有I box、ATCT-motif、CPBCSPOR等多个光响应元件和叶绿体调控位点,此外还有TGACG-motif等多个激素响应元件,多个MYB转录因子识别和结合位点及ARE、LTR等厌氧和低温响应元件(表2),这些上游元件调节不同生长状态和环境条件下基因的转录水平,是基因表达调控的重要元件。
2.3 P39蛋白的同源进化分析
目前,有研究报道的P39蛋白仅拟南芥AtP39一种[1-3,5-8],本研究选择了水稻、玉米、大豆等13 种常见的单、双子叶农作物和经济作物,通过Blast搜索获得这些植物的P39同源蛋白序列(蛋白质登录号见图2)。采用DNAMAN进行序列比对,结果显示,13 种植物的P39蛋白均与AtP39蛋白具有较高的序列相似性(图3)。此外,AtP39蛋白含有一个高度保守的由27个氨基酸残基组成的L6 loop区,位于第245—271 氨基酸残基处,其功能可能是参与蛋白质构象转变的调节[3],参与比对的12种P39蛋白也均在相同位置存在L6 loop区,其中,水稻OsP39的L6 loop区与AtP39仅相差一个氨基酸残基(图3)。采用MEGA软件,选择最大可能性法[13],对P39蛋白进行序列比对和进化树构建,结果显示,水稻OsP39蛋白序列与高粱SbP39的遗传距离最近,为0.086 8(图2)。
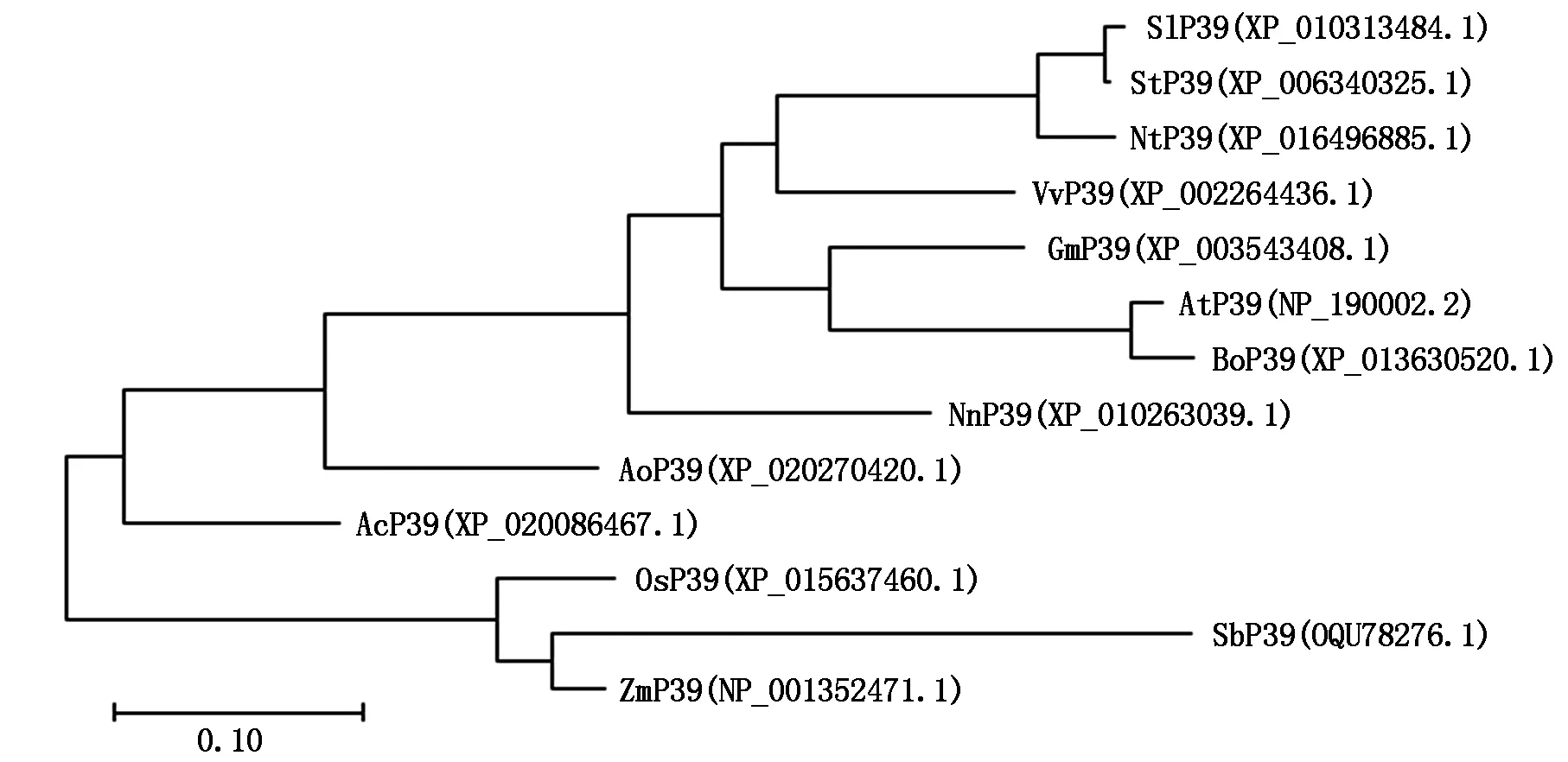
At.拟南芥;Os.水稻;Sb.高粱;Zm.玉米;Ac.菠萝;Ao.芦笋;Bo.甘蓝;Gm.大豆;Nn.荷花;Nt.烟草;Sl.番茄;St.马铃薯;Vv.葡萄。图3同。At.Arabidopsis thalianan;Os.Oryza sativa;Sb.Sorghum bicolor;Zm.Zea mays;Ac.Ananas comosus;Ao.Asparagus officinalis;Bo.Brassica oleracea var.Oleracea;Gm.Glycine max;Nn.Nelumbo nucifera;Nt.Nicotiana tabacum;Sl.Solanum lycopersicum;St.Solanum tuberosum;Vv.Vitis vinifera.The same as Fig.3.
2.4 OsP39蛋白的理化性质
利用Expasy-ProtParam数据库进行蛋白质性质分析,结果显示,OsP39蛋白含361 个氨基酸残基,包含了全部20 种蛋白质氨基酸,其中甘氨酸含量最高,为44 个,占总数12.2%,其次为亮氨酸和丝氨酸,分别为33,32 个,色氨酸数量最少,为2 个,生理条件下带负电荷氨基酸(谷氨酸+天冬氨酸)总数29 个,带正电荷氨基酸(赖氨酸+精氨酸)总数33 个。蛋白质分子量38.7 ku,理论等电点pH值8.64,不稳定指数32.6,小于40,稳定性较好[14],脂肪指数83.71,热稳定性高,属于耐热型蛋白[15],平均疏水性-0.103,偏向亲水。
2.5 OsP39蛋白信号肽和跨膜螺旋区预测
通过SignalP进行信号肽分析,在OsP39蛋白中未识别到氨基端信号肽序列(图4),利用TMHMM数据库分析蛋白质的跨膜螺旋区,未预测到跨膜螺旋结构(图5)。
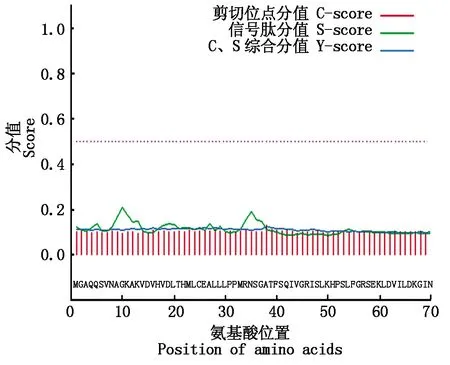
图4 OsP39蛋白的信号肽分析Fig.4 Analysis of signal peptide of OsP39 protein
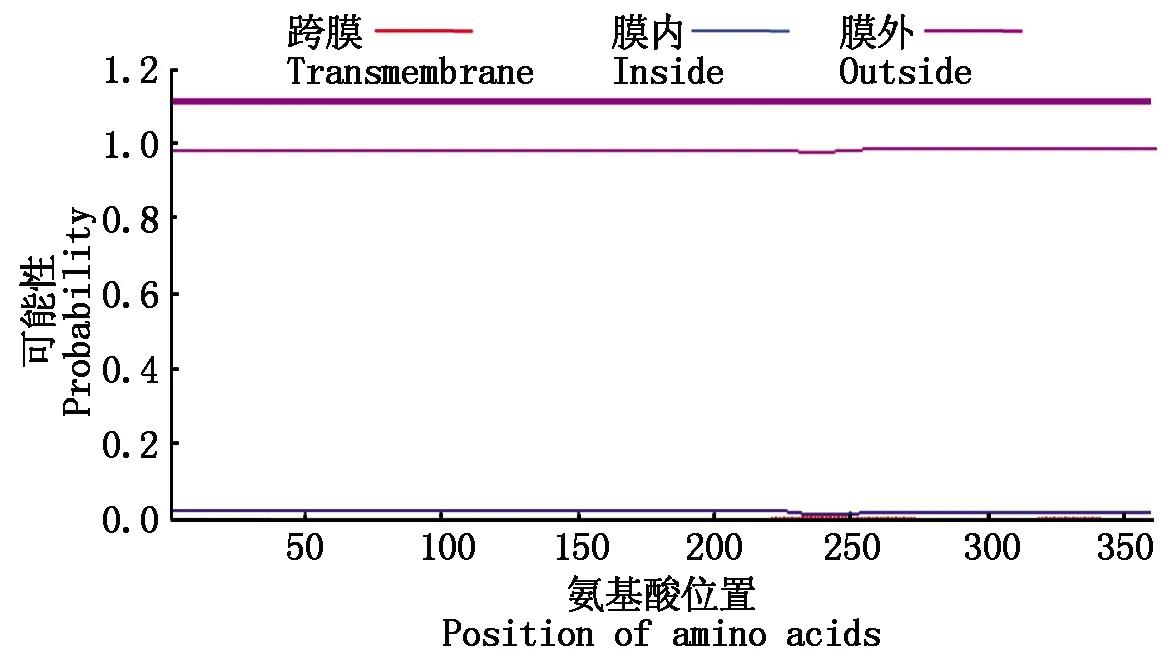
图5 OsP39蛋白的跨膜螺旋区分析Fig.5 Analysis of transmembrane helical region of OsP39 protein
2.6 OsP39蛋白的空间结构
二级结构预测显示,OsP39蛋白的二级结构元件以无规卷曲和伸展肽链(β折叠片)为主,其中无规卷曲比例最高,占50.97%,其次为伸展肽链,占30.57%,α螺旋和β转角分别占12.74%,5.54%,不含310螺旋、π螺旋等元件(图6)。
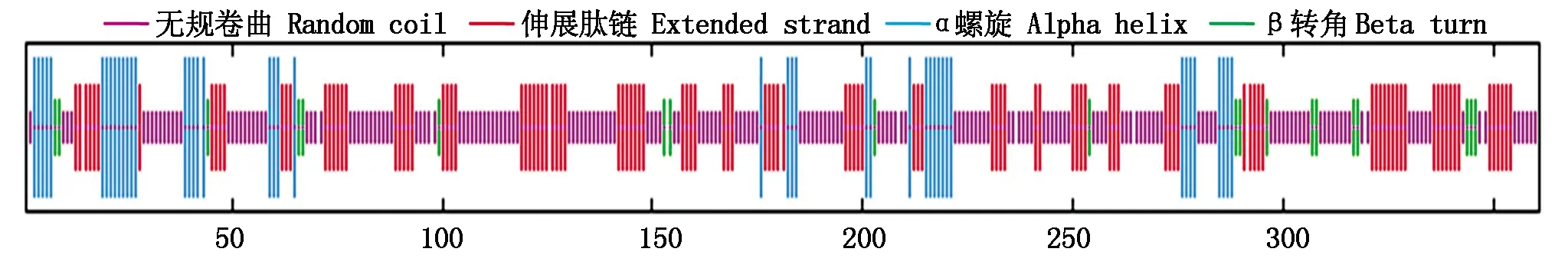
图6 OsP39蛋白的二级结构元件Fig.6 Secondary structure elements of OsP39 protein
通过SWISS-MODEL数据库进行三级结构预测显示,OsP39的空间结构与拟南芥AtP39蛋白几乎相同,都为含多个β折叠片的β-桶状膜蛋白(图7),桶状结构主体部分插入膜内,L6 loop区形成松散的环状结构,位于通道入口处(图7)。
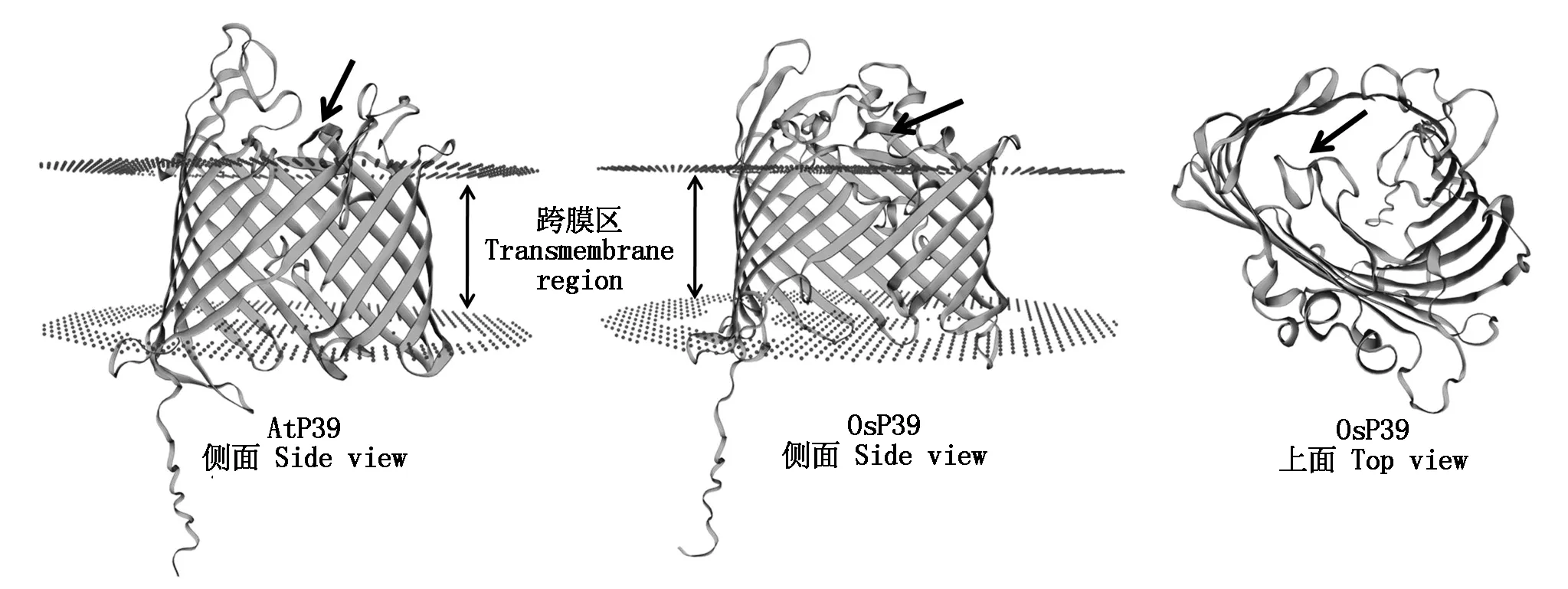
黑色箭头指示L6 loop区。Black arrows indicate the L6 loop region.
2.7 OsP39蛋白的蛋白质互作和亚细胞定位预测
通过STRING数据库进行蛋白质互作分析显示,目前有证据支持的与OsP39蛋白(转录产物ID:OS05T0510200-01)存在互作关系的水稻基因有10 个(图8),其中可信度最高的是谷胱甘肽硫转移酶(OS06T0168000-01),其次为OsDVB1蛋白(OS03T0840900-01),该蛋白与植物发育有关,以及OS06T0111600-01(含有依赖AMP的合成酶/连接酶结构域的蛋白质),其他可能与OsP39存在互作关系的蛋白质分别为OsJ_04947(ABC转运蛋白亚基)、OS12T0422971-00(NADH脱氢酶亚基9类似蛋白)、OsJ_20876(果糖/塔格糖二磷酸醛缩酶)、OsJ_10671(类ISP42蛋白)、OsJ_05254(未知功能蛋白)、OS02T0496900-01(线粒体输入受体TOM9-2亚基)、OS01T0276200-00(线粒体输入受体亚基TOM40类似蛋白)。上述可能的互作蛋白在水稻中多数未被深入研究,其中的类ISP42蛋白、OS02T0496900-01等蛋白与线粒体蛋白质输入有关。通过PredictProtein数据库进行亚细胞定位预测则显示,OsP39蛋白定位于叶绿体膜(图9)。

直线的粗细程度表示可信程度。The thickness of the straight line indicates the degree of confidence.

图9 OsP39蛋白的亚细胞定位预测Fig.9 Prediction of subcellular localization of OsP39 protein
2.8 OsP39蛋白的亚细胞定位
尽管通过SignalP未预测到信号肽序列,但空间结构预测结果显示,OsP39蛋白为膜蛋白,亚细胞定位预测也显示,该蛋白为叶绿体膜定位蛋白。为确定OsP39蛋白在水稻细胞内的定位情况,以绿色荧光蛋白GFP作为报告蛋白,使用酶切、连接法构建了Osp39编码序列与gfp序列融合的瞬时表达载体。用带有Osp39-gfp融合表达框的质粒转化原生质体后,发现OsP39-GFP融合蛋白主要出现在叶绿体区域,且GFP荧光与叶绿素自发荧光叠加后并未混合为黄光,因此,可以确定OsP39-GFP融合蛋白没有出现在叶绿体基质,而是定位在叶绿体膜(图10),表明OsP39是与水稻叶绿体膜功能相关的蛋白质。另外,少量OsP39-GFP融合蛋白积累在细胞质,推测为蛋白质表达过量导致。作为对照的gfp质粒转化原生质体后,GFP蛋白则全部定位于细胞质(图10)。
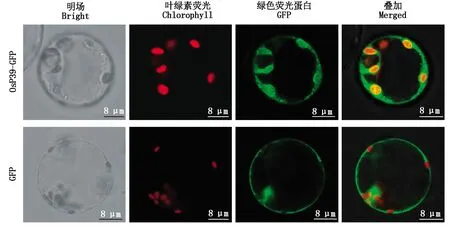
图10 OsP39-GFP融合蛋白和GFP在水稻原生质体中的定位Fig.10 Subcellular localization of OsP39-GFP fusion protein and GFP in rice protoplasts
2.9 Osp39基因的组织表达
为明确Osp39基因在水稻中的组织表达情况,采用定量PCR进行了基因在不同时期和不同组织中的转录水平分析。结果显示,在苗期,Osp39在水稻叶片中表达水平最高,其次为叶鞘,而在根中最低。在开花期,Osp39在水稻旗叶中表达水平最高,其次为茎,在花(包括雄蕊、雌蕊和颖壳)中表达量最低。在不同时期和不同组织中,Osp39基因的表达水平不同,但在叶和叶鞘等绿色组织中的表达水平极显著高于根和花等组织(图11)。
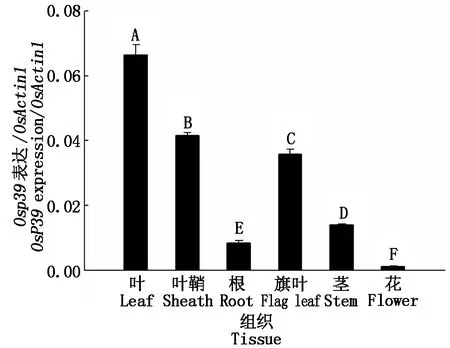
叶、叶鞘和根取自14 d水稻苗;旗叶、茎和花取自扬花期水稻。不同的大写字母表示差异的极显著性(P<0.01)。Leaves,leaf sheaths and roots were taken from 14-day rice seedlings;flag leaves,stems and flowers were taken from flowering rice.Different capital letters indicate extremely significant differences(P<0.01).
3 结论与讨论
叶绿体中含有约3 000种蛋白质,其中绝大多数由核基因组编码,在细胞质中翻译后,输入到叶绿体[16]。拟南芥通过CHLORAD机制调节叶绿体等质体蛋白质的输入,AtP39蛋白是该机制中的一个重要作用因子,参与泛肽化蛋白由叶绿体外膜转运回细胞质的过程[1]。本研究采用生物信息学手段及转录分析、瞬时表达等方法,确定了水稻Osp39基因的序列特征、组织表达情况以及OsP39蛋白的性质、结构和亚细胞定位情况,确定OsP39与拟南芥AtP39蛋白具有高度相似性。
由于目前尚未在β-桶状膜蛋白中发现规律性的信号肽序列[17-18],因此,本研究利用SignalP数据库对OsP39蛋白进行信号肽分析时,未能预测到信号肽序列。Gross等[19]研究表明,β-桶状膜蛋白的定位信息存在于蛋白质N端的6个β-折叠片中,定位过程还涉及叶绿体外膜TOC蛋白等蛋白质的参与,其详细定位机制尚不清楚。但此类蛋白确实可以进行正确的膜定位,拟南芥AtP39蛋白的叶绿体膜定位[3],以及本研究中OsP39蛋白的亚细胞定位结果,均反映了这一事实,也证实了OsP39是一种在叶绿体膜上发挥功能的蛋白质,与Osp39基因的启动子上游元件分析结果和组织表达结果相符合。
Osp39基因启动子中含有多个光响应、叶绿体调节和激素响应顺式作用元件,组织表达分析也显示,Osp39基因的表达具有明显的组织特异性,在苗期和开花期,其在叶中均具有最高表达水平,而在非绿色组织根和花中的表达水平最低,这种表达模式与P39蛋白参与叶绿体调节的功能相对应。在拟南芥中已经确定AtP39蛋白与SP1蛋白和CDC48蛋白均具有互作关系[1],但由于水稻OsP39蛋白和OsSP1蛋白的研究报道较少,缺乏文献等支持,因此,在蛋白质互作预测中未能预测到OsP39与水稻OsSP1蛋白和OsCDC48蛋白的互作关系。本研究的组织表达结果显示,Osp39基因在叶片、叶鞘和根中的表达水平和变化趋势均与水稻OsSP1基因接近[9],并且OsSP1蛋白也定位于叶绿体[9],反映了二者在功能上的关联性。
本研究在前期工作中发现,水稻的OsSP1基因编辑植株具有严重的生长发育障碍,且结实率极低[10],Huang等[20-21]的研究显示,Oscdc48基因突变后水稻也出现早衰、叶片黄化、褐斑、结实率下降、早亡等表型,表明参与CHLORAD机制的基因对水稻的生长发育具有重要调控作用,Osp39基因在水稻生长发育、胁迫响应过程中的作用有待于进一步研究,本研究分析结果为Osp39基因功能的深入研究提供了基础,也为水稻叶绿体蛋白的输入调控研究提供了新的线索。

