外排泵抑制剂CCCP对阿奇霉素外排阳性耐药痤疮丙酸杆菌的影响
毛海婵,杨丽玲,曾文军,李明,郑武娟,陈剑钊,袁绍辉,阮建波
痤疮丙酸杆菌(Cutibacteriumacnes,C.acnes)是痤疮的重要致病因素之一,它通过激活炎症因子及受体来激活先天性免疫促进痤疮的发生[1]。临床上广泛应用抗生素抑制或杀灭C.acnes达到治疗效果,但近年来C.acnes的耐药现象日益增加,尤以大环内酯类抗生素耐药更为显著[2]。耐药性的出现及加重不仅增加治疗难度,且会导致耐药性以及耐药基因在不同细菌中转移[3]。细菌存在外排泵是导致对抗生素耐药的重要原因[4]。外排泵是细菌对大环内酯类抗生素耐药的重要机制之一[5],此前尚未见耐药C.acnes与外排泵相关报道,笔者前期研究发现耐阿奇霉素C.acnes中存在外排泵阳性现象[6],本研究对阿奇霉素外排阳性的耐药C.acnes进行外排泵抑制剂羰基氰氯苯腙(Carbonyl cyanide-3-chlorophenylhydrazone,CCCP)处理、转录组测序(RNA-Seq),挖掘CCCP处理前后的菌株转录本差异,加深对C.acnes外排泵基因表达的理解,进一步深入研究C.acnes耐药机制,从而指导临床治疗。
1 材料与方法
1.1菌株 标准菌株1株:ATCC6919痤疮丙酸杆菌,购于广东省微生物菌种保藏中心。临床分离对阿奇霉素耐药的痤疮丙酸杆菌1株:编号64(沿用前期标本收集编号),来源于暨南大学附属东莞医院皮肤科门诊痤疮患者。课题组前期已对64号菌进行了药敏试验,药敏结果显示阿奇霉素MIC值>256 μg/mL,并且基因检测结果显示该菌株携带ermX基因,但不含23S rRNA点突变[7-8]。
1.2试剂、仪器 阿奇霉素,中国食品药品检定研究院。CCCP,美国洛杉矶PANPHY化学公司。厌氧血琼脂平板、布氏血琼脂培养基,江门市凯林贸易有限公司。VITEK MS-CHCA基质液,法国生物梅里埃公司。革兰氏染色液,珠海贝索生物技术有限公司。VITEK MS plus质谱检测系统,法国生物梅里埃公司。厌氧培养罐AJ9050型,广州市尤德生物科技有限公司。多功能微生物培养系统Multi-Purpose Incubator型,广州市尤德生物科技有限公司。标准混合气体装置(CO210%,H210%,N280%),大连大特气体有限公司。
1.3方法
1.3.1筛选外排泵阳性菌株 将前期临床分离的64号C.acnes进行复苏、培养、革兰染色镜检初步确认为革兰阳性杆菌,对菌株进行纯化培养,纯化培养后进行质谱鉴定,质谱鉴定参考文献[9],评分大于2.0,确定为C.acnes,再对菌株进行药敏试验和外排泵抑制试验。药敏试验:按照琼脂稀释法,阿奇霉素药物浓度分别设置为0.062 5、0.125、0.25、0.5、1、2、4、8、16、32、64、128、256 μg/mL,外排泵抑制试验:CCCP+阿奇霉素,CCCP采用10 μg/mL,阿奇霉素浓度同上,当加入CCCP后抗菌药物的MIC值降低≥4倍时,判定为外排泵表型阳性[4]。64号菌株阿奇霉素MIC值>256 μg/mL,加入CCCP后,MIC值降至<0.062 5 μg/mL,确定为阿奇霉素外排泵表型阳性。
1.3.2转录组测序样品的制备、测序及数据分析 对外排泵阳性的64号菌株,建立实验组(加10 μg/mL的CCCP处理)和对照组(空白对照)分别设置三个生物重复。菌株的转录组测序样品的制备、测序及数据分析工作委托广州市巡循生物医药科技有限公司,采用Illumina平台进行测序。
①质量控制:实验菌株原始序列(raw reads)进行质控得到高质量序列(clean reads),以参考基因组(ATCC6919痤疮丙酸杆菌)为参考序列,获得基因基本信息。②基因表达水平及差异基因分析:使用FPKM值(标准化的基因表达量)为1作为判断基因是否表达的阈值。筛选差异表达基因条件为:表达差异倍数log2|Fold Change|>1,P<0.05,其中log2FC>1的基因为上调差异基因,log2FC<-1的基因为下调差异基因。绘制差异表达基因的火山图、双向聚类分析图。③差异基因功能富集分析:将差异基因进行基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)生物富集和通路富集分析,以P<0.05作为筛选标准,筛选出差异基因显著富集的条目(GO term)和通路(KEGG pathway),并绘制注释图。通过富集因子(Rich factor)、P值校正值(FDR值)和富集的基因个数来衡量富集程度绘制气泡图(个数越多,气泡越大)。其中,Rich factor指该GO term或pathway中富集到的差异基因个数与注释到的差异基因个数的比值。Rich factor越大,表示富集的程度越大。FDR值一般取值范围为0~1,越接近0,表示富集越显著(图中点的颜色越红)。
2 结果
2.1转录组测序质量评估 测序数据质量合格,见表1。另外,碱基质量分布、GC含量分布、reads平均质量分布、基因覆盖均一度数据合格,可用于后续转录组分析。
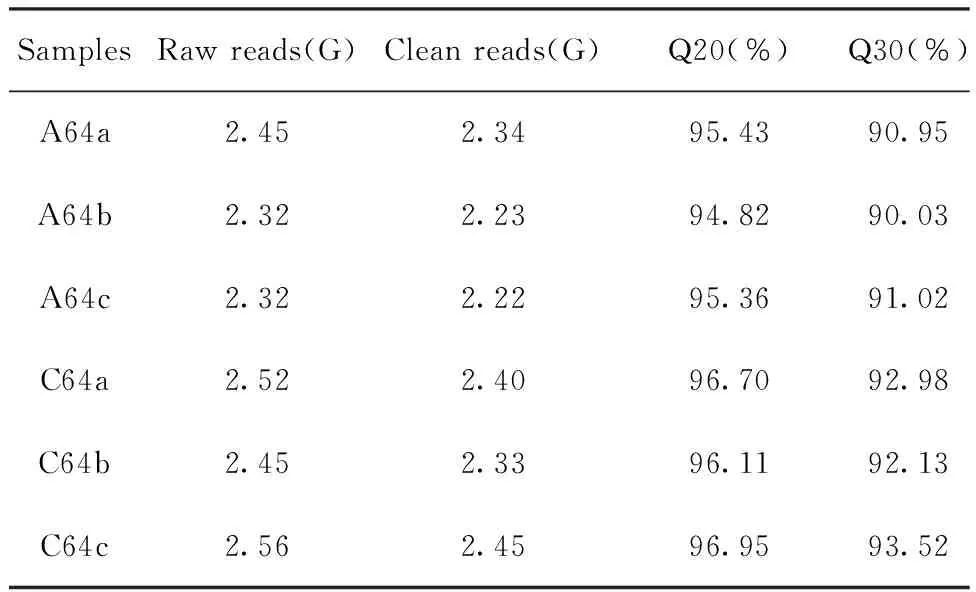
表1 测序质量控制统计信息Tab.1 Sequencing quality control statistics
由热图(图1)可知RNA-Seq数据良好,CCCP处理前后的C.acnes基因表达差异明显,可进行后续基因注释分析。

图1 CCCP处理前后C.acnes差异表达基因热图Fig.1 Heat map of differentially expressed genes (DEGs) in C.acnes before and after CCCP treatment
2.2差异表达基因(DEGs)分析 由火山图(图2)可知,与使用外排泵抑制剂CCCP处理前相比,CCCP处理后的外排泵阳性阿奇霉素耐药C.acnes中共发现755条差异表达基因。其中下调表达427条,占差异表达基因的56.56%,上调表达的基因有328条,占差异表达基因的43.44%。下调表达差异倍数范围为1.00~5.59,差异倍数均值为1.79,上调表达差异倍数范围为1.00~4.94,差异倍数均值为1.65。下调表达基因长度范围为114~4 624 bp,平均长度为861 bp,上调表达基因长度范围为105~4 671 bp,平均长度为1 000 bp。在427个下调表达的基因中,在GO数据库中注释到250个,在KEGG数据库中注释到182个,在328个上调表达的基因中,在GO数据库中注释到266个,在KEGG数据库中注释到236个。
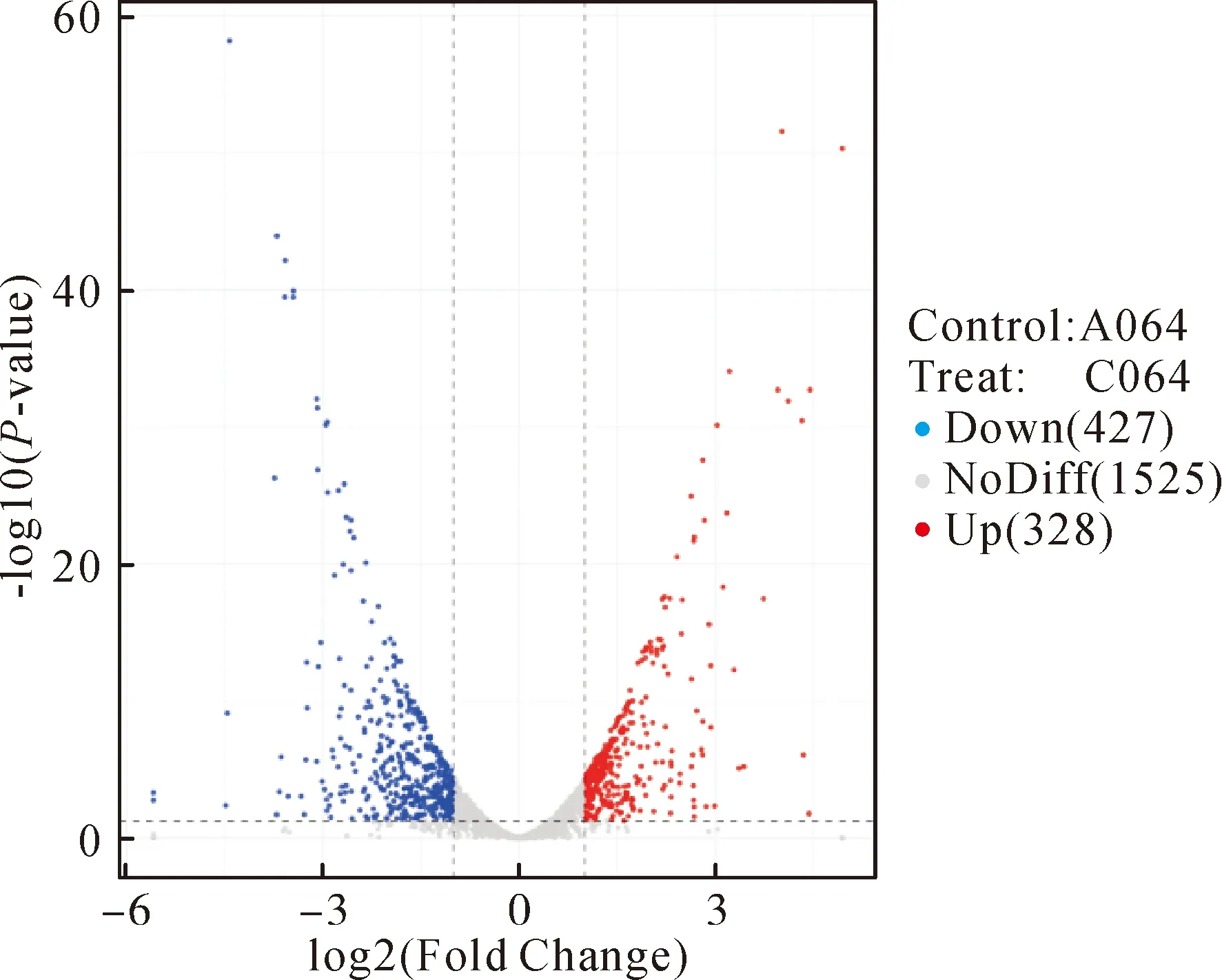
Note:Red dots indicate up-regulated DEGs(adjust P<0.05 and log2FC> 1); blue dots indicate down-regulated DEGs (adjust P<0.05 and log2FC<-1).图2 CCCP处理前后C.acnes差异表达基因火山图Fig.2 Volcano plot of DEGs in C.acnes before and after CCCP treatment
2.3差异表达基因的GO功能分类及富集分析 将筛选得到的差异表达基因注释到GO数据库,有助于对基因功能进行挖掘。GO功能分类将差异表达基因分为细胞组分(cellular component)、分子功能(molecular function)和生物过程(biological process),此为GO功能分类的一级分类。挑选P值最小即富集最显著的前10个GO term进行展示(此为二级分类),见图3。细胞组分中核糖体、非膜细胞器、细胞内非膜细胞器、细胞器、细胞内细胞器、核糖体亚基、核糖体小亚基、核糖核蛋白复合体、蛋白组成复合体、核糖体大亚基是富集较多的种类。分子功能中结构性分子活动、核糖体结构性组成、rRNA结合、氧化还原酶活性[作为NAD(P)H、醌或类似化合物的受体]、NADH脱氢酶(醌)活性、NADH脱氢酶活性、NADH脱氢酶(泛素)活性、RNA结合、氧化还原酶活性[作用于NAD(P)H]、醌结合是富集较多的种类。生物过程中翻译、肽代谢过程、肽生物合成过程、酰胺生物合成过程、细胞酰胺代谢过程、细胞蛋白代谢过程、蛋白代谢过程、细胞大分子、生物合成过程、基因表达、大分子生物合成过程是富集较多的种类。
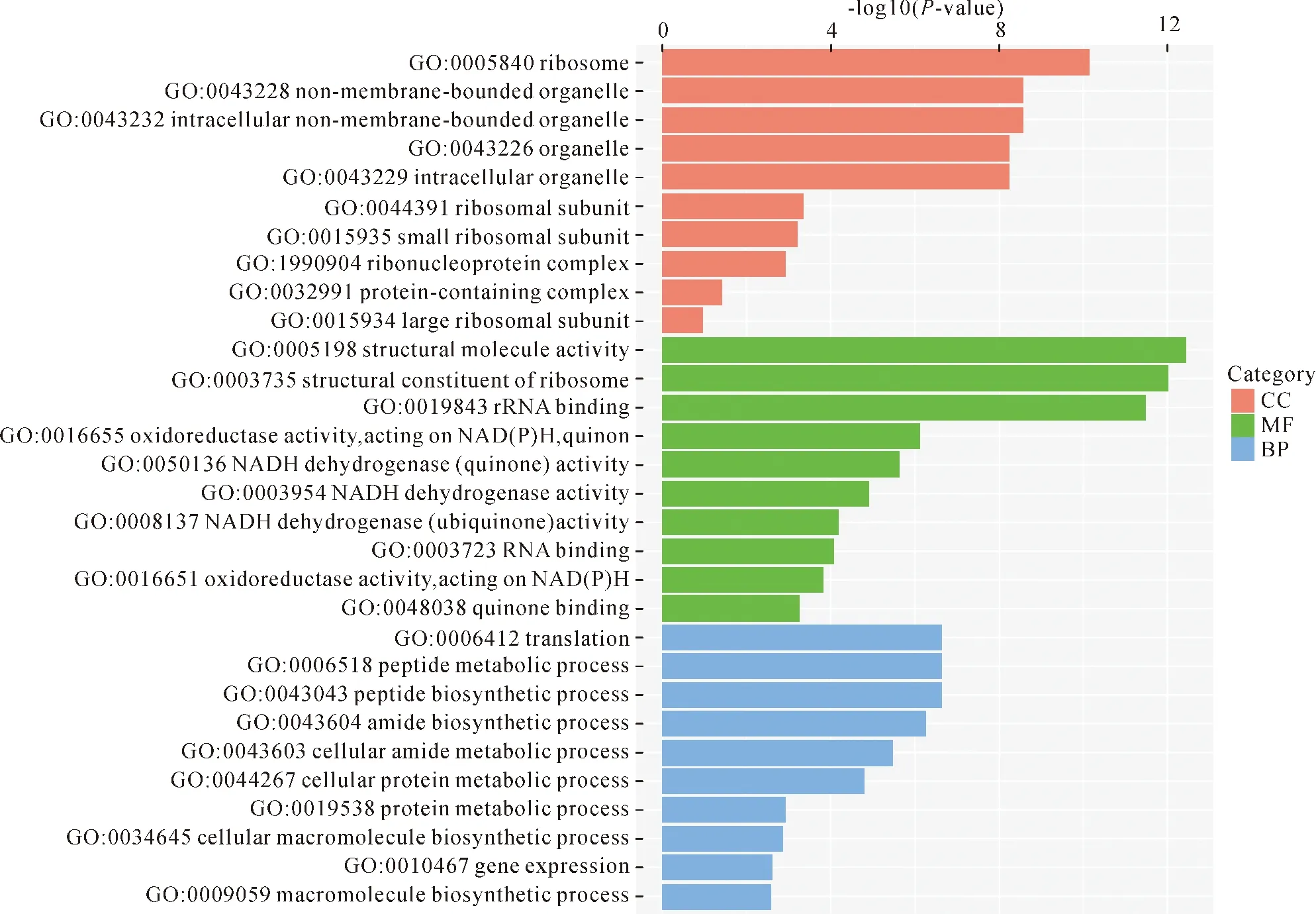
Note:The abscissa represents the second-level GO terms; the ordinate represents-log10 (P-value) enriched in each term.图3 差异表达基因的GO功能分类及富集分析柱状图Fig.3 Histogram of GO functional classification and enrichment analysis of DEGs
挑选FDR值最小的即富集最显著的前20个GO term通过气泡图进行展示,结果如图4,包括氧化还原酶活性[作用于NAD(P)H]、RNA结合、NADH脱氢酶(泛素)活性、细胞蛋白代谢过程、NADH脱氢酶活性、细胞酰胺代谢过程、NADH脱氢酶(醌)活性、氧化还原酶活性[作为NAD(P)H、醌或类似化合物的受体]、酰胺生物合成过程、多肽生物合成过程、多肽代谢过程、翻译、胞内细胞器、细胞器、胞内非膜界细胞器、非膜界细胞器、核糖体、rRNA结合、结构组成的核糖体、结构分子活性。
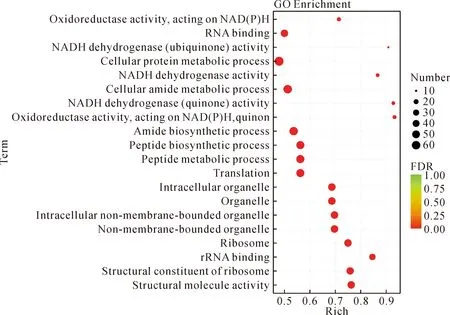
Note:The size and color of bubble represent the amount of enriched genes and enrichment significance, respectively.图4 差异表达基因的GO功能分类及富集分析气泡图Fig.4 Bubble diagram of GO functional classification and enrichment analysis of DEGs
2.4下调差异表达基因的GO功能分类及富集分析 在427个下调表达的基因中,在GO数据库中注释到250个,根据GO功能分类不同,挑选P值最小即富集最显著的前10个GO term,细胞组分中包括膜整体组分、膜的固有成分、细胞膜、细胞外膜、外膜、外部组装结构、三羧酸循环酶复合体、ATP结合盒(ABC)运输复合体、细胞、复制叉;分子功能中包括DNA结合转录因子活性、转录调节活性、氧化还原酶活性(作用于硫基团)、σ因子活动、氧化还原酶活性、乙醇脱氢酶(NAD+)活性、乙醇脱氢酶[NAD(P)+]活性、肌醇2-脱氢酶活性、氧化还原酶活性(作为醛或氧基团、NAD或NADP的受体)、硫胺素-磷酸酯二硫酸酶活动;生物过程中包括对氧化应激的反应、转运、定位、定位建立、DNA模板转录与启动、DNA模板转录的调控、RNA代谢过程的调控、核酸模板转录的调控、RNA生物合成过程的调控、氧化还原过程。
在下调表达差异基因中,挑选出FDR值最小的即富集最显著的前20个GO term条目分别包括:调控核酸模板转录、调控RNA代谢过程、调控转录,DNA模板、氧化还原酶活性(作为醛或氧基团、NAD或NADP的受体)、肌醇2-脱氢酶活性、乙醇脱氢酶[NAD(P)+]活性、乙醇脱氢酶(NAD+)活性、DNA模板转录与启动、氧化还原酶活性、σ因子活性、氧化还原酶活性(作用于硫基团)、转录调节活性、DNA结合转录因子活性、定位建立、定位、转运、细胞膜、对氧化应激的反应、膜的固有成分、膜整体组分等条目。
2.5差异基因的KEGG功能分类与分析 KEGG数据库将差异表达基因分为细胞过程(cellular processe)、环境信息处理(environmental information processing)、遗传信息处理(genetic information processing)、人类疾病(human diseases)、代谢(metabolism)和生物体系统(organismal systems)。
根据差异表达基因的KEGG富集分析结果,挑选P值最小即富集最显著的前20个pathway通过柱状图进行展示,结果见图5。其中富集最显著的前三个pathway分别为遗传信息处理中的核糖体通路、代谢中的氧化磷酸化通路、环境信息处理的ABC转运蛋白通路。
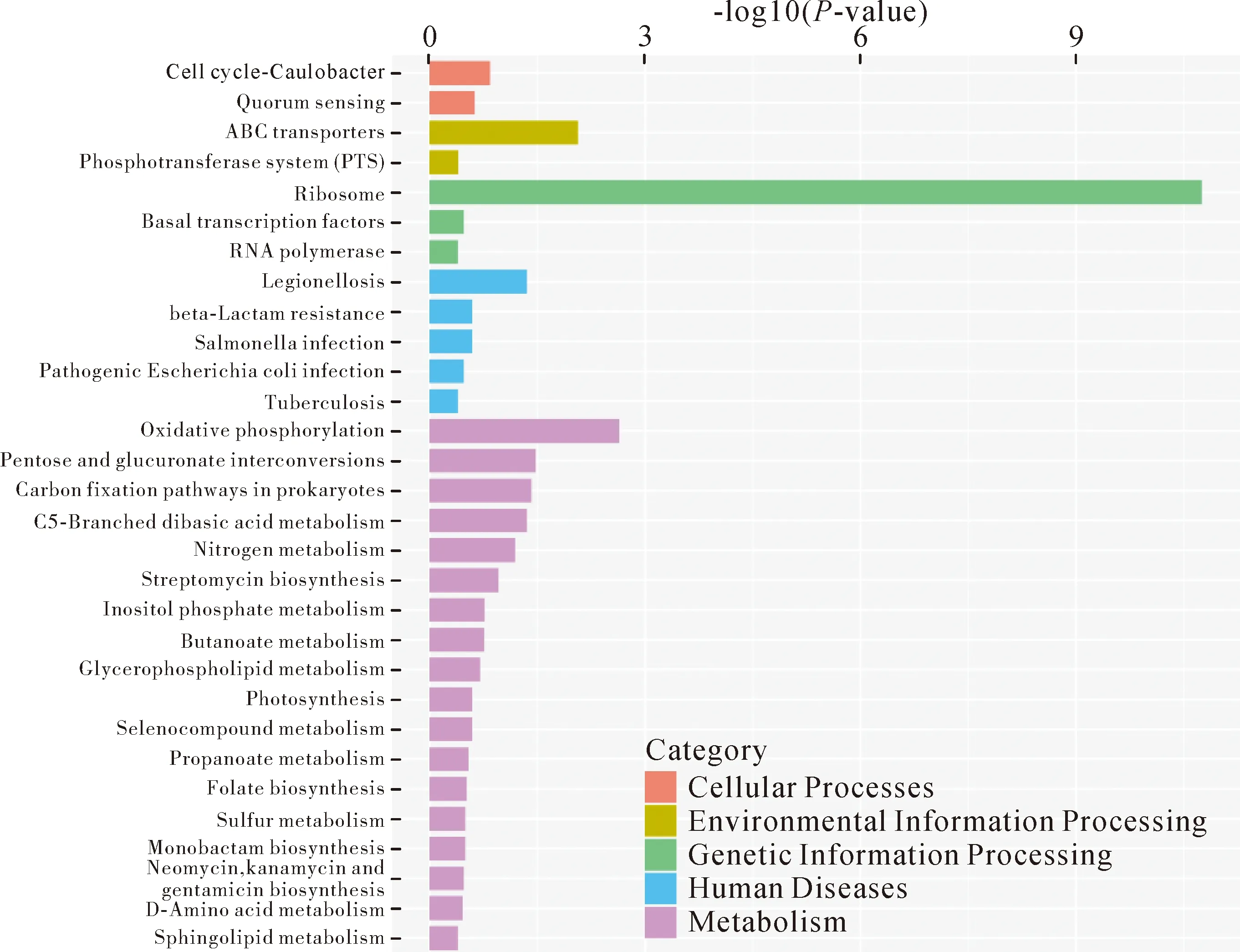
Note:The abscissa represents the second-level category of KEGG; the ordinate represents-log10 (P-value) enriched in each term.图5 差异基因的KEGG功能分类与分析柱状图Fig.5 KEGG functional classification and analysis bar chart of differential genes
挑选FDR值最小即富集最显著的前20个KEGG pathway通过气泡图进行展示,见图6,富集最显著且差异基因个数最多的前三个通路是核糖体、氧化磷酸化、ABC转运蛋白。
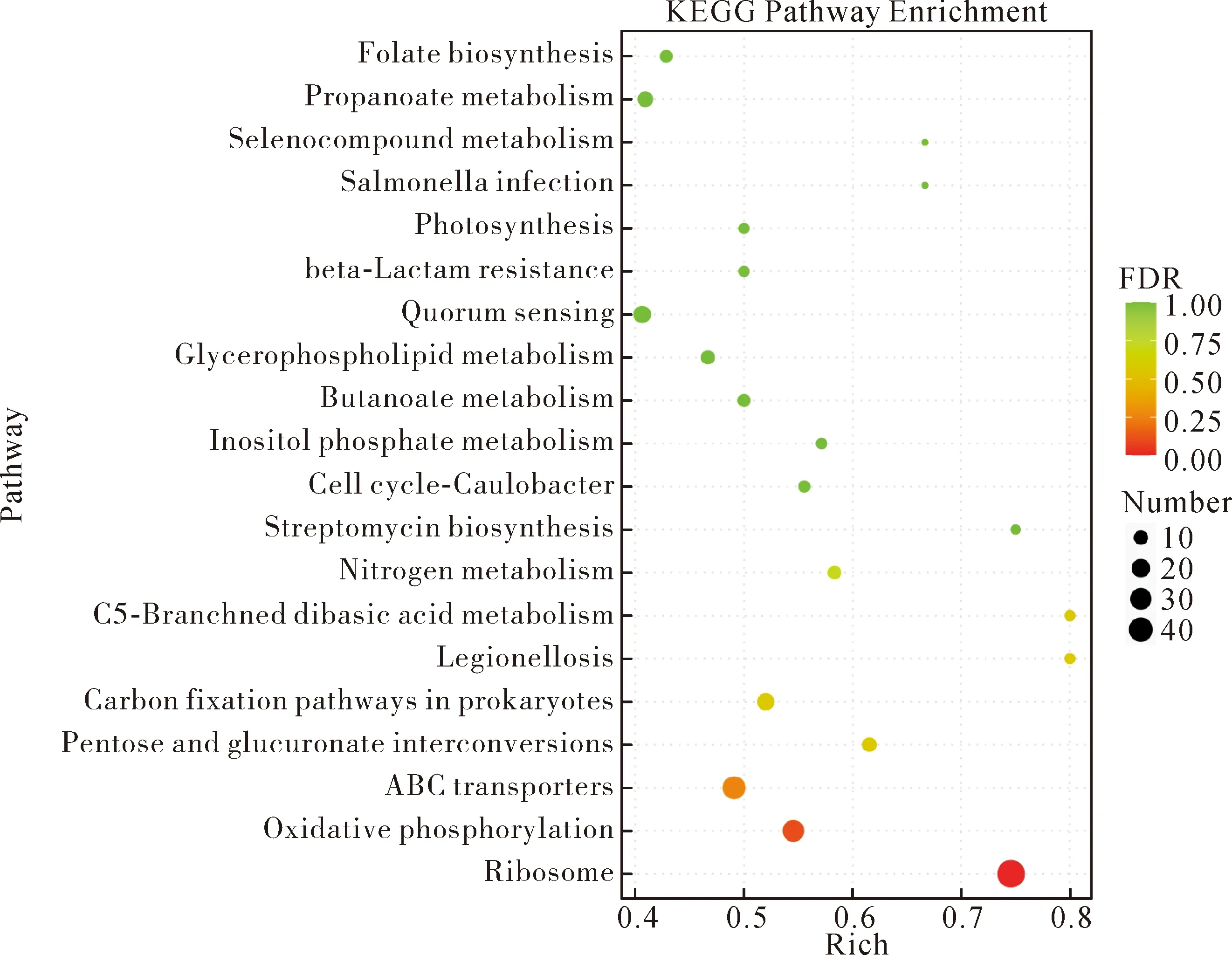
Note:The size and color of bubble represent the amount of enriched genes and enrichment significance, respectively.图6 差异基因的KEGG功能分类与分析气泡图Fig.6 Bubble diagram of KEGG functional classification and enrichment analysis of DEGs
2.6下调差异基因的KEGG代谢通路分析 在427个下调表达的基因中,在KEGG数据库中注释到182个。对下调表达基因挑选P值最小即富集最显著的前30个pathway通过柱状图进行展示,见图7。细胞过程有2个通路、环境信息处理2个通路、遗传信息处理2个通路、人类疾病3个通路、代谢10个通路和生物体系统1个通路。其中下调表达基因富集最显著的pathway为环境信息处理(一级通路)中与跨膜转运(二级通路)相关的ABC transporters(三级通路),即ABC转运蛋白通路。
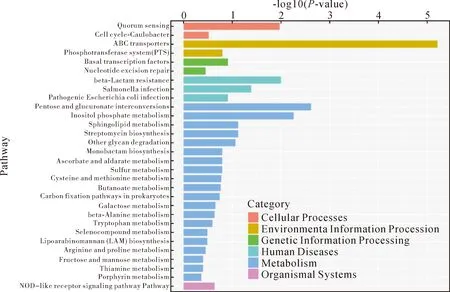
Note:The abscissa represents the second-level category of KEGG pathway; the ordinate represents-log10 (P-value) enriched in each term.图7 下调差异基因的KEGG代谢通路分析柱状图Fig.7 Histogram of KEGG metabolic pathway analysis of down-regulated DEGs
KEGG分析中,下调表达富集最显著且基因数量最多的前五个通路是ABC转运蛋白、戊糖和葡萄糖醛酸盐的相互转化、磷酸肌醇代谢、β-内酰胺耐药、群体感应,见图8。在KEGG分析发现ABC 转运蛋白通路,共55个基因,其中差异表达基因含有27个,差异基因中有19个基因下调表达,下调的前十个基因包括gtsC、ngcF、cycB、cebF、ngcE、gtsB、gtsA、oppB、oppA、ecfT。oppB和oppA基因还参与群体感应信号通路。
3 讨论
C.acnes耐药性问题日益严峻,C.acnes抗生素耐药除了与染色体突变或由质粒、转座子或噬菌体介导的耐药基因的转移有关外[7],还与菌株类型、细菌生物膜的形成有关[3]。C.acnes生物膜形成在耐药性的产生中扮演了重要角色。细菌生物膜的存在使得细菌相互嵌入形成菌落,并在表面形成保护性的外骨架起到物理性屏障作用,影响、阻止各种抗菌药物的治疗[10]。转录组学主要从mRNA水平上研究基因的表达,可以在整体水平上探索细菌中所有基因转录及调控规律,是研究药物干预作用相关靶基因和其分子调控机制的重要手段[11]。
CCCP是目前国内外使用较多且较为广谱的外排泵抑制剂,它是一种抑制质子转运的强解偶联剂,可以在细胞膜两侧自由扩散,破坏质子跨膜电化学梯度,阻断转运蛋白的能量供应,导致外排转运系统的主动外排作用受限,使药物在细菌内蓄积量增加,从而达到提高细菌对抗生素敏感性的作用[4]。
本研究发现,CCCP可使对阿奇霉素外排阳性耐药C.acnes(64号菌株)MIC值由>256 μg/mL降至<0.062 5 μg/mL,通过RNA-Seq技术,对CCCP处理前后的转录本差异表达基因进行GO和KEGG分析,发现CCCP处理后转录组水平发生显著变化,共筛选出755个显著差异表达基因,其中下调表达427个(56.56%),上调表达的基因有328个(43.44%)。表明CCCP对阿奇霉素外排阳性耐药C.acnes的影响主要表现为下调基因表达为主。
差异表达基因的GO功能分类的富集分析柱状图中可知,分子功能、细胞组分、生物过程中均有较多显著差异表达的基因,结果表明阿奇霉素外排泵阳性耐药C.acnes对CCCP的响应由较多信号通路共同参与。差异表达基因的GO富集分析气泡图中,富集程度前四的均与能量代谢相关,考虑CCCP在一定程度上通过影响耐药C.acnes的能量代谢来抑制阿奇霉素外排泵活性,与CCCP是一种抑制质子转运的强解偶联剂的性质相关。
差异表达基因的KEGG富集分析中,富集最显著且差异基因个数最多的前三个通路包括ABC转运蛋白通路,且下调表达差异基因富集最显著的通路也为ABC转运蛋白通路,该通路差异表达基因共27个,其中下调的前十个基因包括gtsC、ngcF、cycB、cebF、ngcE、gtsB、gtsA、oppB、oppA、ecfT。这些下调的基因均参与编码ABC转运蛋白,且在这些下调的基因中oppB和oppA基因还参与群体感应信号通路。另外,下调表达富集最显著且基因数量最多的前五个通路也包括群体感应。ABC转运蛋白是生物界广泛存在的一类利用ATP水解提供能量促使底物跨膜转运的膜整合蛋白,在细菌耐药中起重要作用[5]。群体感应通过产生多种信号分子、质粒接合转移以及与生物膜协同作用促进细菌耐药性的发生,而在生物膜中的细菌则可利用群体感应机制激活毒力因子并产生抗生素耐药性[12]。因此,根据本研究的分析结果表明,C.acnes主要通过ABC转运蛋白外排阿奇霉素而产生耐药,且ABC转运蛋白通路与群体感应信号通路在导致痤疮丙酸杆菌阿奇霉素耐药中存在协同作用。但仍尚不能确定此协同效应是否通过协同群体感应机制激活毒力因子诱导生物膜形成而诱导耐药。
细菌的ABC转运蛋白很少被关注,其涉及抗生素外排的描述是导致细菌多重耐药的重要机制之一,尽管如此,近年来在分子生物学和细菌基因分析方面的发现与进展[13],提供了对细菌外排过程的一个更好的认识。越来越多的ABC转运蛋白被鉴定,也证明其在抗生素耐药方面发挥着不可忽视的作用[5],与对照组相比,使用CCCP处理后的外排泵阳性C.acnes在转录组测序的KEGG分析中发现差异表达基因中的ABC转运蛋白通路和群体感应信号通路显著下调。提示ABC转运蛋白是抵抗阿奇霉素外排阳性耐药C.acnes新的潜在靶点。由此,推测CCCP外排泵抑制剂主要通过抑制外排泵转运蛋白通路和群体感应信号通路逆转C.acnes对阿奇霉素的耐药性,为后续研究C.acnes对阿奇霉素耐药的外排泵机制提供参考。

