mRNA疫苗
——一种新的疫苗策略
王佳敏,时小双,杜寿文,李乐天,李 昌*,金宁一*
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319;2.中国农业科学院 长春兽医研究所,吉林 长春 130122)
1990年,WOLFF等[1]将通过体外转录获得的mRNA,注射到小鼠体内,检测后发现,mRNA在小鼠体内具有表达活性,能够产生相关蛋白且具有剂量依赖性。通过直接注射mRNA可以使机体表达特定蛋白,从而产生相应的免疫反应,由此mRNA疗法进入到人们的视线中。
在随后十多年的研究中,研究人员通过动物试验验证了mRNA可以发挥类似疫苗的作用,从而达到治疗目的[2-4]。但受限于当时不成熟的技术,mRNA稳定性、药物递送、安全性等方面的进一步研究陷入了瓶颈,大多数研究者认为mRNA疫苗技术是“科学上的一潭死水”,将目光转向DNA和替代蛋白领域,mRNA技术逐渐淡出主流。
随着生物技术的发展,mRNA合成、修饰和递送技术也随之进步,一些研究团队看到了这项技术的巨大潜力,组建了专门开发基于mRNA疫苗的生物技术公司。2019年,新冠疫情暴发后,Moderna、BioNTech等公司便开始用这一技术快速研制新冠肺炎疫苗。与传统疫苗相比,mRNA疫苗具有更高的安全性,不向宿主细胞中插入基因,可以被正常细胞降解,且通过调节mRNA的修饰和递送载体可以延长其半衰期[5-8]。更重要的是,传统疫苗在应对新发传染病时存在缺陷,也无法治疗癌症。而mRNA 疫苗利用目的蛋白的核酸序列编码信使 RNA,再经由特定的递送系统使细胞摄取并表达编码的目的蛋白,从而激活机体的体液和细胞介导的免疫反应,可以迅速研发疫苗并投入使用。
1 mRNA类型与体外转录
mRNA疫苗中的mRNA通常以含有目的蛋白开放阅读框(open reading frame,ORF)的质粒DNA或其他DNA片段为模板,通过体外转录技术合成获得[9]。在mRNA疫苗中,体外转录(invitrotranscribed,IVT)mRNA通过编码抗原蛋白诱导宿主的体液免疫反应和细胞免疫反应。IVT mRNA的结构同真核细胞自有的内源性mRNA结构相似[10],尽管线性mRNA是IVT mRNA的代表性结构,但基于不同的目的蛋白表达模式还设计了新类型的mRNA结构,包括:自扩增型mRNA(self-amplifying mRNA,SAM)和环状mRNA(circ mRNA)[11-12]。
线性IVT mRNA结构类似于内源性mRNA,由5′端帽子结构、5′端非翻译区(5′UTR)、开放阅读框(ORF)、3′端非翻译区(3′UTR)和3′端的Poly A尾结构组成。在mRNA的5′端有1个5′帽子结构,天然内源性mRNA有1个7-甲基鸟苷帽结构,与5′-三磷酸桥相连。5′帽子结构对翻译起始至关重要,因为真核翻译起始因子4E(eIF4E)与mRNA的5′帽子结合。mRNA衰变酶如DCP1、DCP2和DCPS也与5′端结合,以调节mRNA衰变。Poly A尾调节mRNA的稳定性和翻译效率[13]。此外,在真核生物中,许多高表达的基因被发现有1个短的Poly A尾,这似乎与mRNA的尾部修剪有关,以形成闭环[14]。有趣的是,1个5′端帽子和1个Poly A尾协同工作,形成闭环RNA结构。在闭环RNA模型中,mRNA的两端通过转录起始因子和聚A结合蛋白(PABP)相互作用。因此,可以保护mRNA免受酶降解,并促进核糖体的重新进入[15]。
自扩增mRNA(SAM)包括α病毒的RNA复制机制,能够以较低的mRNA疫苗剂量实现高水平的抗原蛋白表达[16]。SAM与线性IVT mRNA之间的主要区别在于插入了非结构基因以产生RNA依赖性RNA聚合酶,通常使用甲病毒的非结构基因(nsP1-4)[17-18]。当机体注射SAM时,SAM可以在细胞中自我扩增并诱导高水平的靶蛋白表达,且不会产生病毒结构蛋白。因此即使接种剂量低于传统线性mRNA,理论上SAM也可以产生相当的免疫反应[19]。此外,自扩增mRNA由于其固有的佐剂作用,特别适合用于mRNA疫苗开发。 在细胞自我扩增的过程中,会形成1个短暂的双链 mRNA (dsRNA) 结构,触发模式识别受体 (PRR)。 这会在宿主体内产生强烈的抗原特异性免疫反应[10,20]。过去,利用病毒载体合成自扩增型mRNA 作为疫苗[21-22]。后来,科学家们使用脂质纳米颗粒 (LNP) 进行自扩增型mRNA 的非病毒递送[23-24]。最近,用于SARS-CoV-2疫苗的自扩增型mRNA已研发成功,在小鼠的免疫中显示可诱导高抗体水平[25]。自扩增型mRNA 可以像线性IVT mRNA一样用于 mRNA 疫苗生产,许多临床和临床前自扩增型mRNA疫苗研究目前正在进行中[16,26]。然而,人们一直担心自扩增型mRNA的安全性问题。由于其固有的佐剂作用,难以控制自扩型mRNA的免疫调节特性,需要进一步地研究通过PRR所触发的先天免疫反应。使用反式扩增RNA (taRNA)的二分载体系统可能会提供解决这些问题的方案[27]。
环状RNA是一种天然内源性RNA,其翻译的蛋白质在动物体内发挥重要的生命作用。环状mRNA由于缺乏可以被外切酶识别的自由端,其在细胞中存活的时间比线性mRNA要长得多[28-29]。因此,研究人员开发了一种环状IVT mRNA,提高mRNA的稳定性,解决线性IVT mRNA半衰期短的问题[12]。通常使用自剪接内含子的核酶实现外援IVT mRNA的环化[30]。在置换内含子-外显子 (PIE) 中存在的外显子片段 E1 和 E2 之间插入内部核糖体进入位点 (IRES) 和目的蛋白的基因序列[12]。与线性mRNA相比,环状mRNA在更长的时间内表现出稳定的蛋白质表达水平,证实其稳定性增强[12]。然而,环状mRNA的产量较低,仍需要对其进行进一步的研究。
2 mRNA疫苗制备过程
开发mRNA疫苗包括两个部分,一是制备IVT mRNA;二是选择合适的mRNA疫苗递送系统。制备IVT mRNA的一般过程包括:抗原选择、线性DNA模板合成、体外转录和mRNA纯化这4个步骤。在对病原体的基因组进行测序后选择目标抗原时,将其插入质粒 DNA 模板中。生产 DNA 模板应包含抗原序列、5′和3′ UTR以及5′UTR上游的T7启动子。 体外转录过程需要 DNA 模板、修饰或未修饰的核苷和 T7 RNA 聚合酶。 对于DNA模板,通常使用线性化的质粒DNA或PCR产物。对于体外转录,主要使用T7 RNA聚合酶。 然而,一些研究也使用了T3或SP6 RNA聚合酶。 T7 RNA聚合酶识别DNA 模板的T7启动子并启动 mRNA 的转录。IVT mRNA的5′帽子可以通过两种方式产生。一种是在体外转录过程中通过加帽类似物一步制备;另一种是在mRNA体外转录后通过酶促反应加帽反应合成。同样,IVT mRNA的Poly A尾可以通过两种不同的方法合成。 使用多聚A聚合酶的酶促加尾方法已被广泛用于产生Poly A尾。然而,这种方法的缺点是poly A尾的长度在产生的IVT mRNA中不均匀[10,15]。
在体外转录后,必须进行纯化以获得全长的 IVT mRNA。DNA 模板通过DNase去除,如果需要,可以去除未加帽mRNA的免疫原性5′ ppp并通过磷酸酶转化为5′-OH mRNA[31]。此外,通过高效液相色谱 (HPLC) 去除dsRNA,这些dsRNA是在体外转录过程中产生的,它们具有高度的免疫刺激性。因此,用 HPLC去除dsRNA会增加抗原蛋白的整体表达并减少过度的免疫反应[32]。然而,用HPLC纯化的问题是使用有机溶剂,如乙腈,而且工艺成本高。使用HPLC纯化IVT mRNA需要花费大量时间,最终产率仅为50%左右。到目前为止,大规模生产IVT mRNA的最大问题是纯化步骤[33]。
mRNA疫苗只有穿过带负电荷的细胞膜并进入到细胞质中才能发挥作用, 而mRNA分子较大且带负电荷,不能通过被动扩散进入到细胞质中,需要借助载体系统才能进入到细胞内,因此递送载体对于mRNA疫苗非常重要,理想的递送载体要保护mRNA免受酶的降解,可以被靶细胞特异性识别并摄取,进入细胞质后能够及时从内体中释放出来。mRNA疫苗的递送载体包括病毒载体和非病毒载体两种:病毒载体以慢病毒、腺病毒相关病毒[34]和仙台病毒[35]等为主,病毒载体在进行核酸递送的同时也可能会引起免疫反应,从而影响疫苗的效果[36];非病毒载体主要包括脂质体、树突状细胞(dendritic cell,DC)、无机纳米粒子、阳离子细胞穿膜肽等[37-38]。另外有研究机构最近报道了lipopolyplex(LPP)纳米递送技术[39],脂质体运载技术和聚合物运载技术[40]。脂质载体是目前应用最广的非病毒载体,其易与受体细胞融合、转染效率高、能够抵御核酸酶的作用、且不受宿主限制[41-42]。纳米脂球(LNP)是目前唯一工业化使用的核酸递送技术[43],广泛应用于基于mRNA技术的癌症免疫治疗和预防病毒感染的疫苗等领域。Moderna、辉瑞/BioNTech等均已将LNPs 用于新冠的mRNA疫苗研发。
3 mRNA疫苗作用机制
早在20世纪90年代,研究人员就提出并研究了mRNA疫苗。mRNA疫苗经过理论、技术和经济投入不断完善。科学家们越来越多地阐明了它们的潜在机制,并更好地理解了它们。作用机制的突破使作为第三代疫苗技术的新型冠状病毒mRNA疫苗在这次大流行中发挥了重要作用[44]。
mRNA疫苗不仅能像灭活疫苗一样激活CD4+T细胞的外源性免疫途径,而且还能激活大量涉及CD8+T细胞的内源性免疫反应途径,从而激活效应性和记忆CD8+T细胞(图1)[45]。此外,mRNA疫苗还可以激活抗原递呈细胞(APC),mRNA进入APC细胞质后可以翻译许多目的蛋白片段,从而激活MHCⅠ类分子的内源性抗原加工递呈途径。mRNA疫苗可以在人体内合成,因此具有两个独特的优点:一是可以减少直接注射病毒蛋白的不良反应;二是mRNA疫苗可通过聚合酶链式反应(PCR)快速扩增,在体内而不是在体外诱导目的抗原,从而节省疫苗研发的时间和资金。
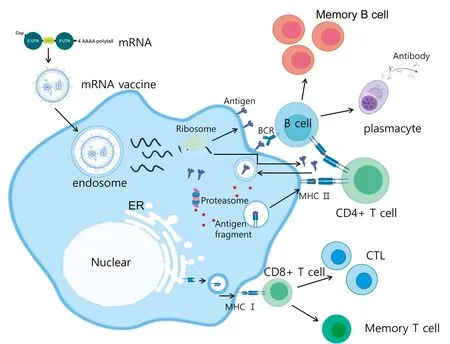
图1 mRNA疫苗的作用机制
mRNA疫苗的外源性免疫反应途径如下: mRNA疫苗在人体注射后被肌肉细胞摄取。肌肉细胞翻译许多目的抗原蛋白片段并在短时间内将其运输出细胞,这使它们能够与不同类型的APC结合,例如巨噬细胞和树突状细胞 (DC),以激活人体的免疫力。未成熟的DC细胞吞噬目的抗原蛋白片段并激活成熟的DC细胞。同时,巨噬细胞可以处理合成的蛋白质抗原信息,分泌细胞因子,促进DC细胞成熟。成熟的DC细胞剪接目的抗原蛋白片段,并将其呈递给CD4+T细胞,通过MHCⅡ类分子进行识别和结合[46]。CD4+T细胞通过直接结合和分泌细胞因子激活B细胞,产生浆细胞和记忆B细胞,从而产生一系列以抗体为主的体液免疫效应。mRNA疫苗还可以激活内源性免疫应答途径:APC细胞和其他有核组织细胞都可以剪接mRNA疫苗中的目的抗原蛋白,然后通过膜表面的MHC Ⅰ类分子将其呈现给CD8+T细胞,从而激活CD8+T细胞,产生记忆和效应性T细胞。当再次感染时,细胞免疫和体液免疫同时被激活[47-49]。身体产生的记忆免疫细胞,如记忆B细胞和抗原特异性细胞毒性T细胞,可以快速识别病毒,产生额外抗体,准确杀死感染细胞,消灭病毒,防止感染继续。
4 mRNA疫苗研究进展
mRNA疫苗的mRNA不会与宿主基因组混合,是一种安全的、迅速表达的信息载体。与其他常规疫苗相比,mRNA可以快速设计和制造。mRNA的这种快速制备潜力为开发用于传染病的疫苗提供了广泛的灵活性。因为mRNA疫苗在治疗效果、安全性、经济性和大规模生产方面更具优势,基于mRNA的疫苗在临床上的应用越来越广泛,这些优势使mRNA疫苗有望成为传统疫苗的替代品。自从1990年首次突破使用IVT mRNA在小鼠中表达外源蛋白[50-53]以来,由于mRNA的多功能性,各种预防和治疗领域已经广泛应用mRNA。迄今为止,已采用和开发了不同的策略来传递mRNA来治疗传染病和癌症[54]。
mRNA疗法是目前预防传染病的新兴技术。在2019 年,针对传染病开发了 15 种基于mRNA的疫苗,但不幸的是,没有一种进入Ⅲ期试验。因此,人们认为基于mRNA的疫苗技术可能还需要5到6年才能进入市场。但机缘巧合的是,COVID-19疫情在全球的肆虐为mRNA疫苗首次在人类身上进行终期测试奠定了基础。截至2021年底,约有200种候选疫苗处于临床前试验阶段。此外,已有100多种候选疫苗处于临床试验阶段,其中约20种候选疫苗是基于mRNA的疫苗,只有两个获得了美国食品和药物管理局(US FDA)的紧急批准。这两种基于mRNA的疫苗BNT162b2和mRNA-1273已获准在全球范围内用于人类的大规模接种[55]。
BNT162b2mRNA COVID-19疫苗由辉瑞和BioNTech共同开发[56],该mRNA疫苗在恒河猴的动物试验结果中显示,可以使机体产生高水平的中和抗体,并且可以激活CD4+T细胞和CD8+T细胞活性[57]。类似地,另一种基于mRNA的COVID-19疫苗,称为mRNA-1273,由Moderna与美国国家卫生研究所下属的国家过敏和传染病研究所和生物医学高级研究与发展局合作开发。mRNA-1273还使用包含可电离脂质SM-102的LNP,其中封装了N1-甲基假尿苷修饰的mRNA[58]。
与SARS-CoV-2相比,1918年的流感大流行在全球造成4 000万人死亡。 已经开发了几种流感疫苗,包括减毒活疫苗、灭活疫苗和重组血凝素 (HA),这些疫苗针对的是负责病毒进入宿主的血凝素 (HA) 蛋白。 然而,由于流感病毒具有快速且持续的突变,其仍会导致严重的呼吸道疾病,尤其是在冬季[59-60]。各种流感mRNA疫苗正在进行临床试验,例如修饰的mRNA可编码全长VAL-506440,VAL-506440是一种H10N8流感毒株和H7N9流感毒株中分离出来的膜结合形式的HA糖蛋白[61-62]。该疫苗接种后,在接种疫苗的志愿者体内检测到高滴度水平的中和抗体,表明候选流感mRNA疫苗在预防流感病毒感染方面具有很大的前景[62-63]。
除此之外,还有多种处于临床试验阶段或研究阶段的mRNA疫苗表现出良好的预防效果。针对狂犬病的CV7201和CV7202 mRNA疫苗在德国开展了Ⅰ期临床试验[64-66];编码埃博拉病毒包膜糖蛋白 (EBOV GP) 的mRNA疫苗在两组豚鼠上进行了测试,以检测中和抗体水平,结果显示,在治疗后 21,42 d后诱导 EBOV GP 滴度增加[67]。此外,爱泼斯坦-巴尔病毒 (EBV)[68]、呼吸道合胞病毒(RSV)[69-70]、寨卡病毒 (ZIKV)[71-72]、人类免疫缺陷病毒 (HIV)[73]、肩突硬蜱[74]以及某些抗癌、抗肿瘤[75-76]的mRNA疫苗也处于研发中,正处于动物试验或临床试验阶段。
5 讨论
mRNA疫苗技术在过去30年间经过科学家的不断探索和持续努力,使得其可以应用在人类身上。病毒是具有高度变异性的病原体,基于mRNA的疫苗技术可以迅速地对目的蛋白基于进行修改并实现快速且大量的制造生产,对于病毒性疾病感染的预防具有积极的作用。COVID-19为基于mRNA的疫苗和其他主要疾病的mRNA疫苗预防方法打开了大门,推广基于mRNA的疫苗技术的影响和意义可能远远超出预防 COVID-19本身。
与传统疫苗相比,mRNA 疫苗在一些方面更具优势:1)抗原选择范围广;2)具备自我佐剂特点,有更强的免疫原性;3)安全性更高,不进入细胞核内部,只在细胞质内表达抗原;4)存在多种修饰方法,能够使mRNA疫苗更加稳定,翻译效率更高。纳米脂质体递送技术使mRNA疫苗能够快速递送到细胞内从而表达出目的蛋白,发挥相应的功能;5)不依赖于细胞或鸡胚培养技术,疫苗的构建更为快速。mRNA的体外转录技术能够进行快速、廉价、大规模地生产mRNA疫苗,与传统活疫苗 5~6个月的生产周期相比,只需病毒的基因序列,mRNA疫苗在40 d内即可完成疫苗样品的生产制备;且在不同区域进行疫苗毒株运送时,不需要通过运输生产疫苗所用的细胞或鸡胚,通过计算机就可以发送相应的基因序列,能更快地对突发传染病疫情做出响应;6)通过生物化学技术即可合成,生产过程无病毒感染风险。
但是,mRNA疫苗的未来发展还有很多难题亟待攻克。与传统疫苗相比,IVT mRNA的制造更安全快速,但目前研究过程中所使用的材料较为昂贵。此外,疫苗的下游加工需要改进,IVT可以实现疫苗的小规模生产,但对于大规模生产却无法达到所需的产量。尽管mRNA疫苗在多个国家都获批,但mRNA疫苗的大规模推广还是存在难题。以辉瑞/BioNTech 的新冠疫苗为例,该疫苗必须在-70℃以下的温度进行运输和储存。在标准冷藏温度(2~8℃)下,它最多只能存储 5 d。建立完整的疫苗冷链体系,包括疫苗的储存和配送,具备一定的难度。此外,如果要实现疫苗的大批量供应,需要有相应的灌装能力,仅通过1个国家完成灌装,是难以供应全球所需的。最后,对于mRNA疫苗的效果评价,应当有适当的监管指南,在COVID-19 mRNA疫苗接种后就已发现副作用和不良反应,如心肌炎和心包炎[77],出现气短、胸痛、心悸的症状[78]。
总的来说,尽管目前mRNA疫苗技术还存在许多缺陷,但随着研究人员的进一步探索,随着大家对于mRNA疫苗的作用更清楚地认识,相信在技术的进步和监管体系的不断完善下,可以开发出更多更安全有效的针对病毒、细菌、寄生虫以及癌症的mRNA疫苗,这些疫苗在疾病的预防和治疗领域可以发挥更大的作用,更好地保护人类健康。

