CEF来源NDV Ex通过影响IFN-α、IFN-β、IL-1β、IL-6与iNOS促进NDV体内增殖
黄天鸿,邹映雪,冯嘉轩,李金斗,丁佳欣,张 頔,于喜冰,陈铭桦,丁 壮
(吉林大学 动物医学学院 人兽共患病研究教育部重点实验室,吉林 长春 130062)
新城疫(Newcastle disease,ND)是由新城疫病毒(NDV)引起禽的一种急性、热性、败血性和高度接触性传染病,临床上以高热、呼吸困难、下痢、神经紊乱、黏膜和浆膜出血为特征。该病对易感家禽的致死率高达100%,给世界养禽业和贸易往来带来了严重的经济损失。NDV只有1种血清型,存在多种基因型。病毒基因组编码6种结构蛋白(NP、P、M、F、HN和L蛋白)和2种非结构蛋白(V、W蛋白)。NDV基因组较小,不能编码病毒复制所需的所有蛋白,在宿主体内进行高效复制和感染通常需要与宿主进行紧密的相互作用,并利用宿主蛋白实现自身的复制[1]。近年来有研究表明,外泌体(exosome,Exo)及其组分与病毒感染以及免疫反应有着密切的联系。因此,外泌体在病毒感染过程中的作用研究对病毒的防制有着十分重要的意义。
外泌体是一类由细胞主动分泌释放到胞外的小囊泡,直径30~150 nm[2]。它在细胞间的蛋白、核糖核酸(ribonucleic acid,RNA)和脂类等生物活性物质的传递与细胞间通讯中发挥着关键作用。越来越多的研究表明外泌体与体内病毒感染以及宿主抗病毒免疫反应关系密切,有些病毒甚至可以通过外泌体携带感染性病毒粒子或病毒组分在病毒感染进程中发挥作用[3]。HCV感染的人肝癌细胞外泌体含有病毒基因组及病毒蛋白,被证明具有传染性,是该病毒在细胞间传播的主要途径[4]。含有病毒抗原的外泌体在与受体结合后,可在表面诱导信号级联,以控制细胞的免疫应答。前期体外试验发现,NDV刺激鸡胚成纤维细胞(CEF)产生的外泌体(NDV Ex)无感染性,但可以影响病毒在多种体外培养的细胞系中的感染与复制,具有促进NDV增殖的作用[5-6],但在动物体内NDV Ex对NDV感染的作用却并不清楚。成纤维细胞是鸡体内中最常见且功能活动旺盛的细胞[7],本实验室已经建立并完善了CEF源NDV Ex的大量提取纯化方法。
本研究以易感NDV的SPF雏鸡为研究对象,将荧光染色后NDV Ex经翅下静脉注射SPF雏鸡,通过体内成像研究NDV Ex的主要蓄积组织器官;将主要蓄积组织器官研磨提取RNA后,qPCR检测肺脏、脾脏、肝脏病毒载量变化与Ⅰ型干扰素表达量的变化;分离肺泡巨噬细胞后通过流式细胞术及荧光定量检测细胞吞噬能力及IL-6、IL-1β、iNOS变化。试验结果表明CEF来源NDV Ex在机体内通过影响IFN-α、IFN-β、IL-1β、IL-6与iNOS的表达量来促进NDV增殖,为丰富外泌体相关的病毒感染机理以及NDV感染机制的理解与ND防控策略打下基础。
1 材料与方法
1.1 病毒、动物及主要试剂NDV强毒NA-1株(GenBank:DQ659677)由本实验室分离保存;红细胞裂解液购自北京全式金生物技术有限公司;鸡淋巴细胞分离液购自深圳达科为公司;DiR荧光染料购自德国Merck公司;胎牛血清购自BI公司;FITC-dextran购自美国Ebioscience公司;外泌体洗脱柱购自美国Invitrogen公司;protein A/G磁珠购自MCE公司;小动物活体成像系统购自美国Kodak公司;CD63抗体由本实验室分离保存;鼠TSG101抗体、PE标记的鼠抗鸡MHC Ⅱ抗体购自Abcam公司;AF488标记的鼠抗鸡Monocyte/Macrophage Marker (KUL01)单克隆抗体购自Abcam公司;7日龄SPF鸡购自哈尔滨兽医研究所。所有动物试验均按照吉林大学动物福利研究伦理委员会批准的实验操作规范操作(批准文号:2017060815-2)。
1.2 细胞培养与外泌体的分离鉴定解剖9日龄SPF鸡胚获取CEF,将细胞培养于含10% FBS DMEM的75 cm2培养瓶中,待细胞覆盖率达到90%时,用PBS冲洗3遍,换为不含FBS的DMEM,加入NA-1(MOI=0.5)后3 h弃去培养基,用PBS冲洗3遍,再次加入无FBS DMEM以除去未感染细胞的细胞外病毒颗粒,48 h后收取上清,使用0.22 μm滤器过滤,100 000 ×g4℃离心1 h。使用实验室前期建立的外泌体纯化方法除去病毒颗粒[8],将产物与鸡CD63抗体在室温下静置孵育30 min。将混合物与protein A/G磁珠在旋转条件下温育30 min。用PBS洗涤磁珠3次后用洗脱缓冲液(150 mol/L甘氨酸,pH2.7)洗脱,用中和缓冲液中和后储存于-80℃备用,使用Western blot和电子显微镜进行鉴定。
1.3 外泌体荧光染色制备荧光标记外泌体需全程避光。将制备好的外泌体从-80℃冰箱取出,用DiR荧光染料以1∶100体积比加入外泌体,放入37℃摇床1 h,使其染色充分。利用外泌体洗脱柱,800×g室温离心3 min,收集离心后液体,铝箔纸包裹,避光保存[9]。
1.4 外泌体体内分布检测将经荧光染色后的200 μg NDV Ex通过翅下静脉分别注射至3只7日龄SPF鸡体内,在注入荧光外泌体后的3,12,24 h,使用小动物活体成像仪进行活体成像,活体成像前排空尿液,使用75%酒精打湿雏鸡腹部毛发,异氟烷麻醉雏鸡,使用880 nm滤片,功率为3.5 W,在暗场下观察雏鸡体内发出的荧光,记录400 ms曝光时间下的荧光强度,使用ImageJ软件比较平均荧光强度,观测NDV Ex在雏鸡体内的分布情况。
1.5 器官中外泌体分布检测注射外泌体后24 h处死雏鸡,取心脏、肝脏、脾脏、肺脏、肾脏、大脑、肠于10 cm2培养皿中,再次用活体成像仪进行图像采集,用于比较各脏器内外泌体的含量。
1.6 NDV Ex对NDV体内增殖的影响以200 μg NDV Ex或PBS接种7日龄SPF雏鸡,2 h后通过滴鼻方式接种105TCID50NA-1,接毒后分别在3,6,12,24,36,48 h,通过Eastep Super Total RNA Extraction Kit提取空白对照组、NDV组和NDV+Ex组雏鸡上述各时间点的肺脏、脾脏和肝脏总RNA,随后使用M-MLV逆转录酶、oligo-dT和随机引物的混合物(1∶1)对所得RNA进行反转录。cDNA经无菌蒸馏水稀释作为qPCR的模板或在-40℃ 保存备用。FastStart Universal SYBR Green Master试剂盒通过qPCR检测病毒NP、IFN-α和IFN-β mRNA表达水平变化情况,并使用GAPDH的表达水平进行数据标准化,以基因的相对表达量2-△△Ct计算表达水平。
1.7 肺泡巨噬细胞免疫相关细胞因子转录水平与吞噬功能检测
1.7.1肺泡巨噬细胞分离与表型检测 颈椎脱臼处死鸡,固定后剪开颈部皮肤,分离出气管,用1 mL 注射器吸取1 mL PBS缓冲液沿向心方向穿刺进入气管,缓慢推入肺部,静置2 min再缓慢回抽,将回收的液体注入洁净的离心管中。重复灌洗9~10次,将灌洗液500 ×g离心10 min,弃上清,加入红细胞裂解液,混匀细胞,作用3~5 min裂解红细胞,500 ×g离心10 min,弃上清,用RPMI 1640培养液重悬细胞沉淀,铺板,用光学显微镜观察细胞形态,48 h后弃去上清并用PBS冲洗3遍,用0.25%胰酶消化贴壁细胞,2 000 r/min离心5 min,弃上清,细胞计数,并用PBS调整细胞浓度为1×106个/mL。取 100 μL 细胞悬液于1.5 mL EP管中,加入1 μL KUL01单克隆抗体,4℃孵育1 h。用PBS洗2次,2 000 r/min离心3 min,以300 μm滤膜过滤后用流式细胞仪检测细胞表型。
1.7.2肺泡巨噬细胞吞噬功能相关细胞因子检测 分离3,6,12,24,36,48 h NDV和NDV+Ex组、空白对照组肺泡巨噬细胞,使用qPCR检测鸡肺泡巨噬细胞IL-1β、IL-6和iNOS mRNA表达水平。用于RT-PCR的引物见表1。

表1 荧光定量PCR引物信息
1.7.3NDV Ex对肺泡巨噬细胞吞噬能力的影响 分别分离空白组、6 h NDV组、12 h NDV组、6 h NDV Ex组、12 h NDV Ex组的鸡肺脏巨噬细胞,用PBS调整细胞浓度为1×106个/mL。取 100 μL 细胞悬液于1.5 mL EP管中,加入1 μL FITC-dextran,37℃孵育2 h。用PBS洗2次,2 000 r/min离心 3 min,300 μm滤膜过滤后用流式细胞仪进行检测。
2 结果
2.1 NDV Ex的分离鉴定所分离出的NDV Ex样本经Western blot检测出标志蛋白TSG101(图1A)。分离的外泌体经SDS-PAGE检测,显示纯度很高且无杂带(图1B)。透射电镜下可观察到外泌体呈经典“茶杯托”形态,直径约为100 nm(图1C)。

A.NDV Ex的分离纯化鉴定(M.蛋白Marker;1.protein A/G磁珠联合CD63抗体纯化的NDV Ex;2.经典超速离心法纯化的NDV Ex);B.NDV Ex的SDS-PAGE分析(M.蛋白Marker;1.protein A/G磁珠联合CD63抗体纯化的NDV Ex);C.透射电镜下负染色的NDV Ex
2.2 NDV Ex的体内迁移研究
2.2.1外泌体大体分布 经活体成像检测,可见DiR-Ex和 DiR均可在鸡体内富集(图2A),其富集位置集中在腹部。在相同拍照条件下,各时间点的DiR-Ex组平均荧光强度全部高于DiR组(图2B),且荧光强度在24 h 内维持稳定(图2C)。

A.外泌体大体分布活体成像;B.注射后不同时间荧光强度检测结果;C.注射后不同时间荧光强度变化。ns.示无显著性差异;*.示P<0.05;***.示P<0.01。下同
2.2.2外泌体的器官分布 试验组与对照组肝脏和脾脏上有较强荧光,但无显著性差异;但试验组肺组织可见较强荧光信号,而对照组无荧光信号(图3A)。另外,试验组与对照组的肝脏都有荧光,试验组显著高于对照组(图3B)。

A.注射外泌体24 h后,各脏器内外泌体含量检测;B.肺脏、脾脏、肝脏外泌体荧光强度检测
2.3 NDV Ex对NDV体内增殖的影响
2.3.1NDV Ex对NDV体内病毒载量的影响 从整体上分析肺脏、脾脏和肝脏各个时间点的病毒载量,NDV+Ex组几乎全部多于或等于NDV组(图4),显示出NDV Ex对病毒在体内增殖的促进作用。各个器官病毒载量的变化又有一定的区别,脾脏在24 h时NDV+Ex组病毒载量低于NDV组,而后略高于NDV组(图4B);肝脏则在12 h NDV+Ex组的病毒载量便接近NDV组,而后略高于NDV组且两者都没有较大波动(图4C)。而肺脏则有所不同,NDV+Ex组在24 h病毒载量接近NDV组,而后又有较大增加,在48 h再次降低接近NDV组(图4A)。
2.3.2NDV感染后NDV Ex对肺脏、脾脏和肝脏IFN-α、IFN-β转录水平变化的影响 肺脏NDV组的IFN-α、IFN-β在12 h前全部高于NDV+Ex组,且在6 h两者差异最大,12~36 h NDV组与NDV+Ex组基本持平,而48 h NDV组又再次高于NDV+Ex组(图5A,D),对肺脏进行检测发现,和NDV组相比,NDV+Ex在48 h内均发挥了抑制IFN-α、IFN-β转录水平的作用。脾脏NDV组的IFN-α、IFN-β在12 h之前全部高于NDV+Ex组,且在6 h两者差异最大,而在12~24 h时,NDV组与NDV+Ex组基本持平,与肺脏表现不同的是,在24~48 h时,NDV+Ex组略高于NDV组且差距逐渐增大(图5B,E)。肝脏NDV组的IFN-α、IFN-β在3 h 略低于NDV+Ex组,6~24 h显著高于NDV+Ex组,在12 h两者差异最大,而在24~48 h时,NDV+Ex组明显高于NDV组且差距逐渐增大(图5C,F)。
2.4 NDV感染后肺泡巨噬细胞免疫相关细胞因子转录水平与吞噬能力检测
2.4.1贴壁不同时间肺泡巨噬细胞的形态观察 光学显微镜下可见,鸡肺泡巨噬细胞在贴壁培养6~12 h时,细胞量较多细胞杂乱。培养24~36 h时,杂细胞变少,细胞呈圆形、梭形和不规则形等形态,符合巨噬细胞的形态特征。培养48 h后细胞量开始变少,轮廓模糊不清。由此可见,最佳分离条件为贴壁培养24 h(图6)。
图6 肺泡巨噬细胞贴壁不同时间的形态观察(200×)
2.4.2流式细胞术检测细胞表型 结果显示,成功分离出了肺脏巨噬细胞,分离效率约为82.26%(图7)。
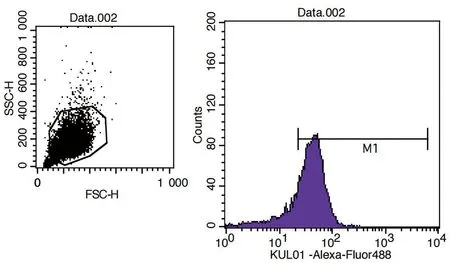
图7 流式细胞术检测细胞表型
2.4.3肺泡巨噬细胞免疫相关细胞因子检测 使用RT-PCR检测肺泡巨噬细胞免疫相关细胞因子,结果显示在所有时间段NDV组的IL-1β、IL-6和iNOS mRNA的表达水平均明显高于NDV+Ex组(图8),而在不同时间点三者表现稍有不同。IL-1β在6 h时NDV与NDV+Ex组均达到了一个顶点,12~36 h时NDV组含量降低,两者差距逐渐缩小,在36 h后NDV组再次高于NDV+Ex组(图8A);IL-6则是在12 h时NDV与NDV+Ex组均到达第一个顶点,而后NDV组含量降低两者差距逐渐缩小,直到48 h时NDV组再次高于NDV+Ex组(图8B); iNOS在3 h和6 h时间点NDV组与NDV+Ex组两者含量都在同步增加,在6 h后NDV组含量开始超过NDV+Ex组,并在24 h到达第一个顶点,而NDV+Ex组则与NDV组相反,在24 h到达低点,而后两者逐渐接近,在36 h时趋同,在48 h NDV组又再次高于NDV+Ex组(图8C)。

图8 肺巨噬细胞免疫相关细胞因子检测
2.4.4NDV Ex对肺泡巨噬细胞吞噬能力的影响 从前面结果来看在NDV感染进程中NDV Ex会在6 h和12 h对病毒载量与细胞因子产生影响,因此我们使用流式细胞术研究6 h和12 h NDV组和NDV+Ex组肺泡巨噬细胞吞噬能力的变化。结果显示,在6 h NDV组与NDV+Ex组吞噬能力均弱于PBS组,NDV+Ex组明显弱于NDV组;在12 h NDV组与NDV+Ex组吞噬能力较6 h更为减弱,且NDV+Ex组下降更为明显并显著弱于NDV组(图9)。试验表明NDV Ex在NDV 感染过程中影响了肺泡巨噬细胞的吞噬能力。

图9 NDV感染后NDV Ex对肺泡巨噬细胞的影响
3 讨论
外泌体被释放到细胞外之前会包裹一系列蛋白质及核酸,外泌体较为稳定的磷脂双分子层结构可以保护外泌体内容物不被外界降解[10-11]。外泌体也具有良好的生物活性,得益于外泌体表面的CD47,它能够阻止外泌体在血液循环系统中被单核细胞清除,因此外泌体具有足够时长的循环半衰期和免疫逃逸能力[12-13]。由于病原体感染会导致细胞代谢活性发生改变,而且多种病毒可以利用外泌体释放完成自身的复制与释放,因此多种病原体感染会改变外泌体的释放,并且外泌体可以在病毒的感染进程中发挥重要作用[14-15]。早在2003年就有学者提出,逆转录病毒可以利用外泌体形成与分泌的途径合成新的感染性病毒粒子[16-18];2013年发表在《Nature》上的一项研究报道显示,甲型肝炎病毒(hepatitis A virus,HAV)本身不具有囊膜结构,但它可以在复制时通过类似途径合成具有膜结构的病毒颗粒——“囊膜的HAV(enveloped HAV,eHAV)[19-21]。本实验室前期研究发现,NDV Ex不能在受体细胞中建立感染,但可以促进NDV在体外细胞系DF-1中的复制,但NDV在雏鸡体内感染进程中NDV Ex所发挥的作用并不清楚。
在对NDV Ex在雏鸡体内迁移分布情况的研究中,我们发现NDV Ex能迁移分布到雏鸡的肺脏、脾脏和肝脏,其中肺脏聚集最多;在24 h内也有良好的蓄积效果,且其他组织对NDV Ex没有明显的摄取作用,提示NDV Ex可能靶向于这些器官。在研究NDV Ex对NDV增殖的影响时,发现NDV Ex会促进NDV在体内的复制。在研究NDV Ex对Ⅰ型干扰素表达量的影响时,实验室前期研究发现在强毒NDV刺激下,IFN-α、IFN-β表达量逐渐升高并在48 h达到峰值后下降[22]。本试验中,24 h之前NDV Ex组的IFN-α、IFN-β含量受到抑制,后期接近于NDV组;而24 h后NDV组和NDV Ex组IFN-α、IFN-β表达量有所差异,可能是由于NDV Ex在不同组织器官中蓄积时间及蓄积量的不同导致。为了进一步探究NDV感染过程中NDV Ex所发挥的作用,选取了在体内迁移研究中NDV Ex含量最高的肺脏进行试验,结果表明NDV Ex显著抑制了肺泡巨噬细胞吞噬相关细胞因子IL-1β、IL-6和iNOS mRNA表达水平,从细胞因子水平上说明在NDV感染过程中NDV Ex干扰了肺泡巨噬细胞的吞噬能力。总体来看,NDV组与NDV Ex组在6 h和12 h时两组病毒载量与细胞因子产生了较大变化,也在此时段最先发生变化,因此本试验使用流式细胞术研究6 h和12 h时NDV组和NDV Ex组肺泡巨噬细胞吞噬能力变化,结果表明,两个时间点NDV Ex组吞噬功能明显弱于NDV组,且12 h时NDV Ex组与NDV组的吞噬功能差异更显著,NDV Ex降低了肺泡巨噬细胞的吞噬功能。
本研究通过雏鸡体内试验探究了NDV Ex在NDV体内感染进程中所发挥的作用。结果表明NDV Ex可以在雏鸡体内蓄积,并在NDV感染进程中抑制了体内的干扰素水平、肺泡巨噬细胞吞噬活性相关细胞因子水平。可能是这些因素导致NDV Ex促进了NDV的体内增殖。有研究显示,外泌体可以引起巨噬细胞的极化功能改变[23-24],因此下一步试验将针对此方面做进一步的研究。本试验主要探究了NDV Ex在NDV体内感染中的表现,为阐明NDV在机体内的致病机制奠定了基础,为抗击病毒感染提供了新的思路。

