骨形成蛋白7在ESCC中的表达及功能初步探究
孙梦菲,黄红芳,董宇航,张华坤,周紫茹,孙 琦,管文燕,赵琳玥,崔晓宾, 陈云昭,李 锋
骨形态发生蛋白(bone morphogenetics protein,BMP)原为一种诱导骨组织形成的生长因子,它的亚型除BMP1是金属蛋白酶家族外,其余如BMP7等均隶属转录生长因子β(TGF-β)超家族且具有典型的半胱氨酸结构域[1]。近些年,有研究[2]表明BMP7与肿瘤高度相关,该分子在小细胞肺癌、结直肠癌、胃癌、胰腺癌、卵巢癌、肝癌、食管癌等病理生理机制中起着重要价值。食管癌作为全球病死率排在第6位的恶性肿瘤, 其中约一半是病理亚型为食管鳞癌(esophageal squamous cell carcinoma, ESCC)的中国人[2]。从正常食管到ESCC转化过程中, 不只癌细胞本身发生了改变, 周围免疫微环境也发生了变化, BMP7可以通过抑制巨噬细胞和CD4+T细胞来调节微环境中的促炎反应。但是BMP7在ESCC中研究较少且不一致亟待进一步探讨,该研究从组织、细胞、生物信息学3个层次观察BMP7在ESCC的表达与临床病理指标和生存的关系,免疫细胞的相关性,通路富集分析等探寻BMP7与ESCC产生的分子机制[3-4]。
1 材料与方法
1.1 主要材料EC9706(ESCC细胞系)来源于中国科学院细胞库;DAB染色液试剂盒(北京中杉金桥生物技术有限公司);10%胎牛血清(上海酶研生物科技有限公司);1%青-链霉素(大连美仑生物技术有限公司); RPMI-1640(德国制药企业勃林格殷格翰);Lipofectamine2000 转染试剂(赛默飞世尔科技中国区有限公司);pcDNA3.1BMP7 质粒(南京晶百生物科技有限公司);Young PAGE预制胶(南京金斯瑞生物科技有限公司);Loading Buffer(上海碧云天生物技术有限公司);转膜液(苏州新赛美生物科技有限公司);蛋白酶封闭液(上海雅酶生物医药科技有限公司);羊抗兔二抗等抗体(武汉三鹰生物技术有限公司); ECL 化学发光底物(广州硕谱生物科技有限公司);0.1%结晶紫(北京索莱宝科技有限公司)。
1.2 组织样本收集整理2000—2021年食管鳞状细胞癌石蜡包埋组织样本共 516 例,其中,有274例为癌组织,242例为正常组织。所收集的病例均得到患者的同意并签署医学伦理委员会的知情同意书,通过电话和随访信等进行随访(截止时间: 2021 年9 月)。
1.3 免疫组化染色使用DAB染色液试剂盒,免疫组化操作程序:脱蜡和水化,抗原修复, 阻断内源性过氧化物酶,滴加一抗,滴加酶标羊抗鼠/兔IgG聚合物,DAB显色、复染、脱水、透明、封片、阅片。2位有相应资质的病理医师遵循2019版WHO 消化系统标准对染色效果进行判读。依据棕黄色为阳性,细胞着色强度和肿瘤细胞阳性百分比分数评分的具体细节(无着色=0,黄色=1,棕黄色=2,棕色=3;肿瘤细胞阳性百分比<5%=0,6%~25%=1,26%~50%=2,51%~75%=3,75%~100%=4),其免疫组化评分等于细胞着色强度分数与肿瘤细胞阳性百分比分数的乘积(免疫组化评分≤8为低表达,评分>8为高表达)。
1.4 细胞培养EC9706(ESCC细胞系)细胞培养与转染 EC9706培养于含 10%胎牛血清、1%青-链霉素的 RPMI-1640 细胞培养基中,并置于 37 ℃,5% CO2恒温培养箱中。
1.5 细胞学实验当细胞密度约85%开展实验处理;铺板6孔板每孔计数60万个细胞,过夜细胞贴壁后,EP管各加入100 μl RPMI-1640培养基,再分别添加7.5 μl Lipofectamine2000转染试剂和2.5 μg pcDNA3.1BMP7 质粒。① Western blot 实验应用YoungPAGE预制胶,将转染 48 h后的细胞用 PBS 清洗 3 遍,蛋白提取全程在冰上进行,加入5× Loading Buffer 100 ℃煮沸 10 min,电泳后采用快速转膜液湿转法400 mA 30 min转膜,无蛋白酶封闭液封闭10~15 min,敷一抗4 ℃过夜(BMP7 1 ∶500; GAPDH 1 ∶50 000),1×TBST 清洗,4 ℃孵二抗孵育2 h(羊抗兔二抗 1 ∶10 000)(BMP7、GAPDH、羊抗兔二抗等抗体),1×TBST 清洗, 使用 ECL 化学发光底物显色。② CCK-8与Clone实验将转染细胞在 96 孔板中每孔接种约2 000 个,每组每个时间点设置3复孔,每个时间点至少留1个无细胞孔作为调零孔,96孔板旁边一圈要加无菌PBS防蒸发,测6 d共6个时间点,取3 次的均值。平板克隆每孔 1 000 个细胞接种于6 孔板中,培养10 d左右显示肉眼可见的克隆后PBS 清洗3次,4%多聚甲醛于 4 ℃固定 20 min,重复清洗,0.1%结晶紫4 ℃染色, 20 min后 PBS 再次清洗3次。Image J软件计算细胞克隆数。Transwell 迁移实验将转染48 h 后的细胞密度约为 1×105个/ml加入上室 200 μl,下室加入 500 μl 含 20% FBS 培养基于培养箱中培养24 h 后取出,吸去上室培养基,10%甲醇溶液固定细胞30 s,0.1%结晶紫染色20 min,自来水中清洗至背景清晰。
1.6 生物信息学分析生物信息学使用TCGA数据库和limma、reshape2、ggpubr、vioplot、ggExtra等包绘制免疫浸润图,同时用gridExtra、ggplot2等包画GSEA图。
1.7 统计学处理采用SPSS 26.0 软件统计分析,BMP7于正常食管鳞状上皮与鳞癌组织之间以及高低表达BMP7两组样本临床信息之间比较均采用χ2,预后生存曲线分析使用Kaplan-Meier 法,ESCC预后的单因素和多因素分析运用cox法,P<0.05表示差异有统计学意义。细胞学实验每组数据重复3次,计量资料符合独立正态分布方差齐时组间比较用t检验,不符合时用非参数检验。
2 结果
2.1 组织学验证BMP7表达与临床信息的关系
2.1.1BMP7蛋白在ESCC组织的表达 正常食管鳞状上皮及ESCC组织免疫组化染色显示(图 1),BMP7主要富集在胞核,染色具有显著差异,在ESCC组织中的蛋白表达水平显著低于癌旁正常食管组织(P<0.05)(表1)。

表1 低、高表达BMP7的两组样本的比较[n(%)]
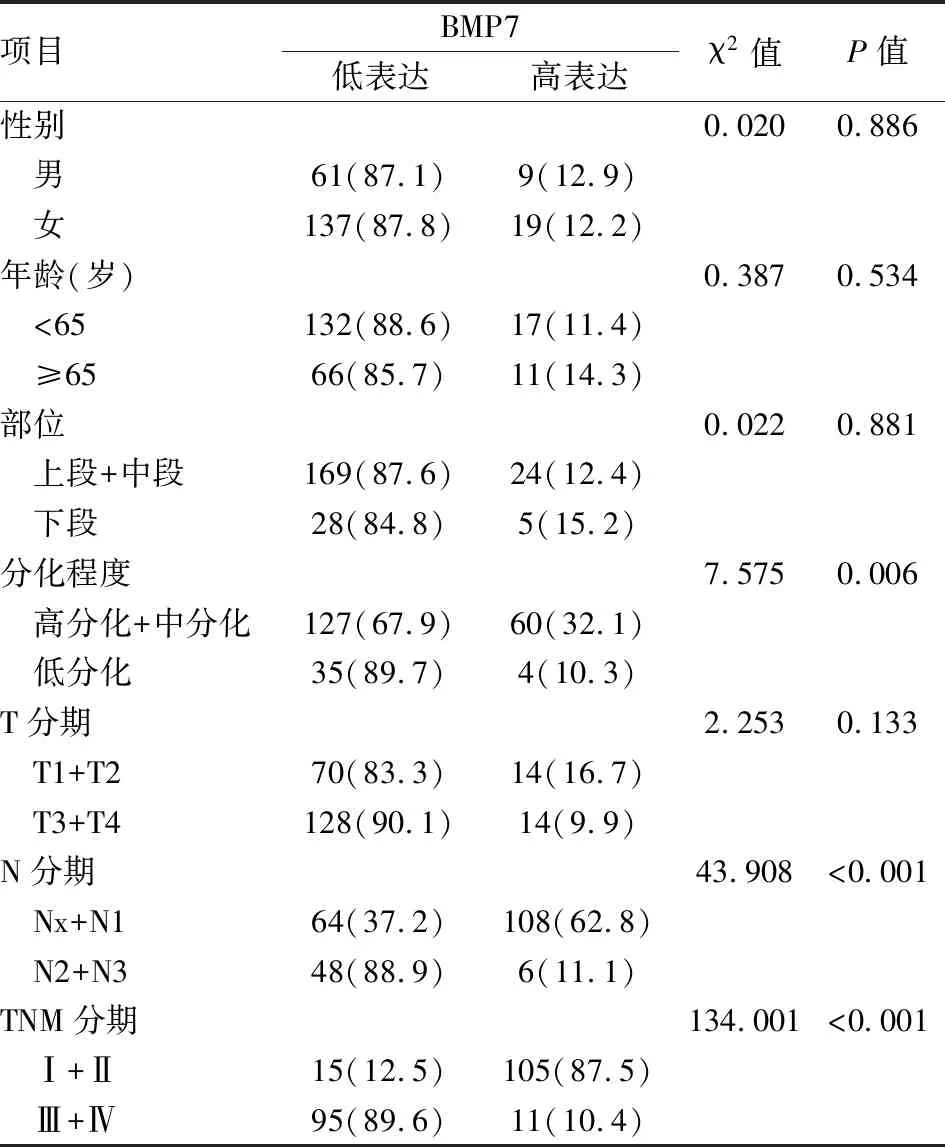
表2 BMP7 表达与临床特点[n(%),n=226]
2.1.2BMP7表达差异与临床特征的关系 具有临床病理数据的226例依据免疫组化总分(IRS)进行分组(表 2), 分值<8 分为低表达, 分值≥8分为高表达, 其中BMP7的表达差异与不同级别分化程度(P=0.006)、N分期(P<0.001)、 TNM分期(P<0.001)之间差异有统计学意义。
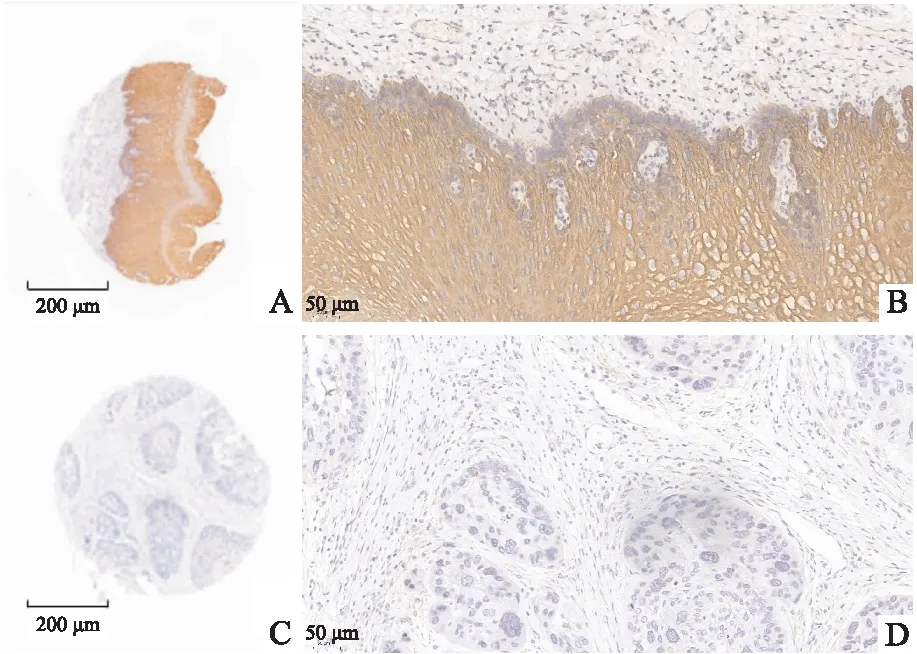
图1 正常组织与ESCC组织中BMP7蛋白表达

图2 ESCC中BMP7蛋白表达差异与生存预后
2.1.3BMP7与ESCC患者生存预后和预后影响因素 有137例ESCC患者通过电话、信件随访、病案记录等方式获得完整的随访信息,通过Kaplan-Meier 生存分析 ESCC患者BMP7蛋白表达水平与生存时间的关系,BMP7低表达组的生存时间低于高表达者(P=0.041)(图 2)。单因素分析后把所有因素使用更严格的多因素计算,TNM分期差异有统计学意义(P<0.001),cox多因素回归分析显示TNM分期是影响ESCC预后的独立因素(表3)。
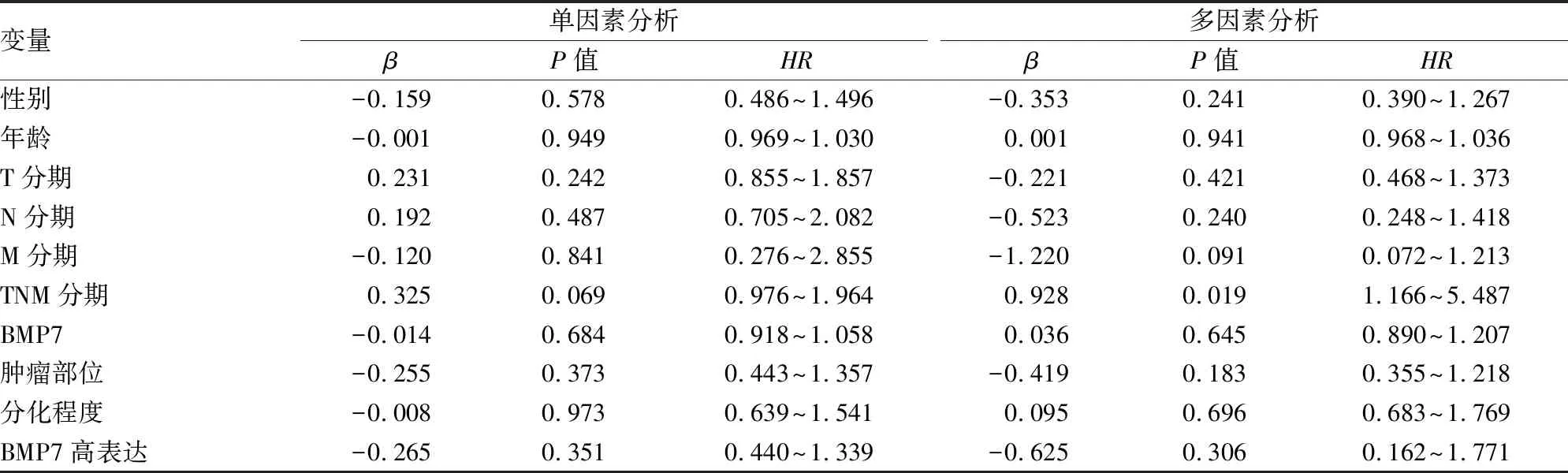
表3 ESCC中cox单因素和多因素分析(n=137)
2.2 细胞学实验验证BMP7对ESCC的影响EC9706细胞中,按照转染说明书分别使用不同量 BMP7 质粒: Lipofectamine2000 比 例 在 6 孔 板 中 进 行 转 染 分别24、48、72 h转染,同时做了无处理的Control组和转染了正常载体的NC组做对照,BMP7组分别按照 2.5、2.0、3.0 μg浓度梯度,确定最佳转染条件48 h BMP7 质粒2.5 μg,Lipofectamine2000 7.5 μl时过表达效果较好(图 3A)。使用最佳转染条件进行过表达BMP7 对ESCC细胞增殖能力的影响等实验,在CCK-8实验中,EC9706细胞过表达 BMP7 组吸光度值低于对照组(P<0.01)(图3B),平板克隆实验在EC9706 细胞中过表达 BMP7 组细胞集落数显著低于对照组(P<0.000 1)(图3C),结果显示 BMP7可以抑制ESCC细胞的增殖能力。Transwell 迁移结果显示过表达 BMP7 组的细胞迁移数目低于对照组的细胞迁移数目(P<0.000 1)(图3D)。

图3 BMP7对ESCC细胞的影响
2.3 BMP7在ESCC免疫微环境中的角色基于TCGA数据库去验证ESCC中BMP7与免疫细胞浸润水平的相关性。如图4A所示,BMP7与B细胞(r=0.373,P=0.008)、树突状细胞(r=0.343,P=0.016)、巨噬细胞(r=0.307、P=0.032)、NK细胞(r=-0.304,P=0.034)免疫细胞呈正相关,它与γ-δT细胞(r=-0.313,P=0.028)、M1-TAM(r=-0.353,P=0.013)、M2-TAM(r=-0.281,P=0.050)呈负相关。同时,BMP7相关的基因集GSEA富集分析显示其与哮喘、自身免疫性甲状腺疾病、补体与凝血疾病、糖脂磷脂酰肌醇、移植物抗宿主疾病通路呈正相关,与造血细胞系疾病、视黄醇代谢、RNA降解、氨基酸代谢、剪接体通路呈负相关(图4B)。
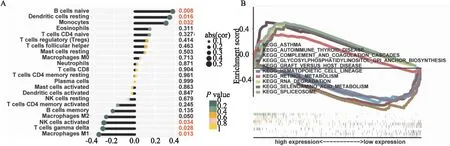
图4 BMP7的表达与ESCC中的免疫浸润水平相关
2.4 BMP7基因的列线图根据年龄、性别、分化程度、N分期、TNM分期、BMP7免疫组化表达评分等绘制可视化列线图,预测ESCC患者的患病风险,评估预后生存时间(图5)。

图5 ESCC风险预测列线图
3 讨论
近年来,ESCC的发病率和病死率开始下降,但患者术后总体生存率仍然较低。寻找有效的分子标志物可以为食管鳞状细胞癌提供新的诊断标志物,早诊早治提高患者生存率[5]。BMPs发挥抑癌作用或致癌作用,这取决于细胞环境和肿瘤类型[6]。肿瘤本身是细胞发生累积性基因突变的结果[3],寻找新的标志物有望提高诊断的有效性和准确性。比较近10年来BMP7与ESCC的研究进展,严琳 等[7]在56例ESCC组织标本中验证出BMP7阳性率(73.2%)远高于正常食管黏膜,且主要在胞膜和胞质。有研究[8]使用160例ESCC组织标本表明BMP7在ESCC细胞中有高、中、低表达3种情况,主要富集癌巢。该研究516 例样本中BMP7在ESCC组织中主要为低表达,主要表达在胞质,从样本角度分析原因可能是相对之前的研究扩大了样本数量且使用了其他地区的组织样本;从分子本身角度分析原因可能是ESCC可通过自分泌和旁分泌的方式产生,BMP7调节ESCC微环境,其分泌量受多种因素影响也处于一种动态平衡状态。综合分析不同的ESCC组织BMP7表达量有所不同,进一步研究可使用内镜下黏膜剥离术或类器官等ESCC样本深入构建模型研究。列线图能综合多种影响因素,简易方便地实现个人评估,提高ESCC患者个体化诊断和预后的效率[9]。
BMP7是一种通过改变靶基因转录调节许多不同细胞类型的增殖、分化和凋亡的分泌蛋白[3]。该细胞学实验验证过表达的BMP7质粒转染EC9706细胞后CCK-8以及平板克隆实验结果中过表达组的细胞增殖能力发生了显著的下降,同时Transwell 迁移实验结果也提示,过表达BMP7的处理组中,ESCC 细胞的迁移能力也出现明显的减弱,BMP7在EC9706中可发挥抑癌作用。有文献[10]表明 BMP7能抑制转移性肿瘤,能延缓肺癌转移和扩散。
越来越多的研究[11-13]表明BMPs调节免疫细胞反应并在癌症中具有免疫抑制作用,比如调节巨噬细胞的激活和极化等。在ESCC里,该研究表明BMP7与M1-TAM(经典活化型巨噬细胞)和M2-TAM(交替活化型巨噬细胞)呈负相关。肿瘤相关巨噬细胞是数量最大的炎症细胞群,有2种亚型,M1-TAM可产生IFN-γ、肿瘤坏死因子、IL-10等,可在一定程度上抵抗食管鳞状细胞癌的进展,但随着食管肿瘤细胞及间质细胞分泌的相关细胞因子( 包括 CCL-2、CCL-18 等趋化因子和 CSF-1) 增加,部分 M1 型肿瘤细胞能向 M2 型转化,形成以 M2-TAMs 为主的免疫微环境浸润[14],M2-TAM促进癌症发生。在这里,BMP7与树突状细胞呈正相关。树突状细胞表达I型和II型BMP受体(BMPRIA、BMPRIB、IA型激活素受体、BMPRII)和BMP信号转导分子(Smad1),其信号激活通过增加共刺激分子和CD83、程序性细胞死亡配体1(PD-L1)和PD-L2的表达,促进人类DC的表型成熟,而且BMPs处理的树突状细胞表现可增强的T细胞刺激能力。BMP7可通过自分泌和旁分泌影响肿瘤微环境肿瘤和免疫细胞进而影响肿瘤的进展。研究[3]表明BMP7信号通路是癌症中潜在的免疫治疗靶标,同时在TCGAESCC数据库中BMP7相关的基因集与自身免疫性疾病通路呈正相关。高表达BMP7的ESCC也可以介导正常成纤维细胞活化为肿瘤相关成纤维细胞,BMP7可通过激活Smad1/5/8并抵消TGF-β/Smad2/3信号通路来抑制纤维化[14]。BMP7抑制可能是克服ESCC免疫治疗一个靶点。

