输尿管软镜手术治疗肾结石的效果分析
王典豹
京山仁和医院泌尿外科 (湖北 京山 431800)
肾结石是一种常见的泌尿系结石,占比约在1/2以上,主要是由于草酸、钙等物质异常或过量蓄积在肾脏部位形成,始发于肾脏,可存在于泌尿系多部位,且肾盂肾盏内结石最为常见[1]。研究发现[2],肾结石的形成与多种综合因素有关,例如遗传、环境、饮食等,且与尿路梗阻、尿道感染、代谢异常等因素有关。目前[3],对于径>0.6cm、表面不光滑的结石,一般建议手术治疗,微创经皮肾镜碎石术(percutaneous nephrolithotomy,PCNL)就是一种常用的治疗技术,在较大结石治疗方面具有重要意义,但可能出现感染、瘘管等并发症。而输尿管软镜钬激光碎石术(flexible ureteroscopic lithotripsy,FURS)是一种微创治疗技术,近年来在临床治疗中应用较为广泛,但欧洲泌尿外科指南指出,该技术对于直径>1.5cm以上的结石结石清除率下降,不建议作为首选治疗方案。但近年来,随着软镜技术的发展,其临床疗效也在逐步提高,有研究认为[4],该技术在直径≤2cm肾结石治疗中可取得显著疗效。也有研究认为,在直径2~3cm肾结石治疗中FURS也具有较高价值。因此,为分析其具体价值,本文将对肾结石患者应用FURS治疗,现报道如下。
1 资料与方法
1.1 一般资料选取2020年2月至2022年2月,在我院治疗的82例肾结石患者。
纳入标准[5]:经影像学检查,明确诊断为肾结石;结石直径为2~3cm,单发性结石;同意一期手术治疗;已签署知情同意书。排除标准[6]:凝血功能异常、出血倾向患者;肝、肾、心、肺等脏器功能障碍患者;输尿管或尿道畸形、狭窄患者;复杂性结患者;急性感染未控制患者;未有效控制高血压、高血糖患者等。按照随机分组原则,将其分为两组。对照组:50例,男性:32例,女性:18例;年龄30~62岁,平均(46.76±5.59)岁;结石位置:肾盂13例,上盏17例,中盏12例,下盏8例。观察组:32例,男性:18例,女性:14例;年龄32~63岁,平均(46.88±5.43)岁;结石位置:肾盂7例,上盏13例,中盏7例,下盏5例。两组上述资料无明显差异(P>0.05)。本次研究已获得伦理委员会审核。
1.2 方法观察组应用FURL术式治疗,进行气管插管全身麻醉。手术时,采取膀胱截石位,经尿道口进入,置入输尿管硬镜,进入膀胱。使用异物钳,经工作通道置入,将患侧D-J管拔除,置入斑马导丝,仔细探查,直至肾盂,随后将输尿管硬镜退出。置入输尿管输送鞘,将内芯退出,经管腔置入输尿管软镜,对肾盂 、肾盏情况进行检查,确定结石位置 、大小 、数目,退出导丝。置入钬激光光纤,功率设置为0.8~2.0J,确认光纤前端超出软镜1cm,接触结石表面,进行碎石,残石直径应控制在3mm以下,随后将光纤退出。使用套石网篮取出其中较大的结石。使用等渗盐水冲洗,保证术野清晰,确认有无结石残留,明确是否有出血情况,将软镜、输尿管输送鞘撤出,常规留置双J管。对照组应用PCNL术式治疗,麻醉、体位与观察组一致,将输尿管导管插入,随后调整至俯卧位,将腹部适当垫高,注入生理盐水。应用超声定位,在其引导下进行穿刺,直至肾盏,作5mm左右的切口。扩张穿刺通道,随后将Peelaway鞘、光纤置入,调整光纤位置、相关参数,碎石后取出,常规留置双J管。
1.3 评价标准(1)结石清除率比较:于术后2周复查,结石清除判断:无输尿管梗阻、肾积水,结石残屑≤3mm。(2)围术期指标比较:比较两组患者的围术期相关指标,包括失血量、手术时间、住院时间等。(3)肾功能指标比较:采集空腹静脉血,应用酶联免疫吸附法测定,检测血肌酐、血清胱抑制素C指标。(4)并发症发生情况比较:包括出血、感染、发热等。
1.4 统计学方法数据应用SPSS 22.0软件处理,计数资料以(%)表示,应用χ2检验。计量资料以(±s)表示,应用t检验。P<0.05表示差异,有统计学意义。
2 结 果
2.1 结石清除率比较观察组患者经治疗结石清除率为93.75%(30/32),对照组应用94.00%(47/50),无明显差异(χ2=0.00,P>0.05)。
2.2 围术期相关情况比较与对照组比较,观察组患者的手术时间更短,失血量更低,住院时间更短,差异明显(P<0.05),见表1。
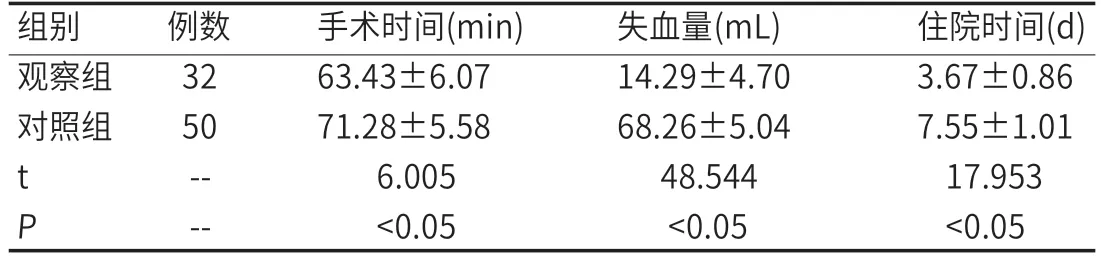
表1 两组围术期相关情况比较
2.3 肾功能指标比较治疗后,两组患者的血肌酐水平低于对照组,血清胱抑制素C水平明显高于对照组(P<0.05),见表2。
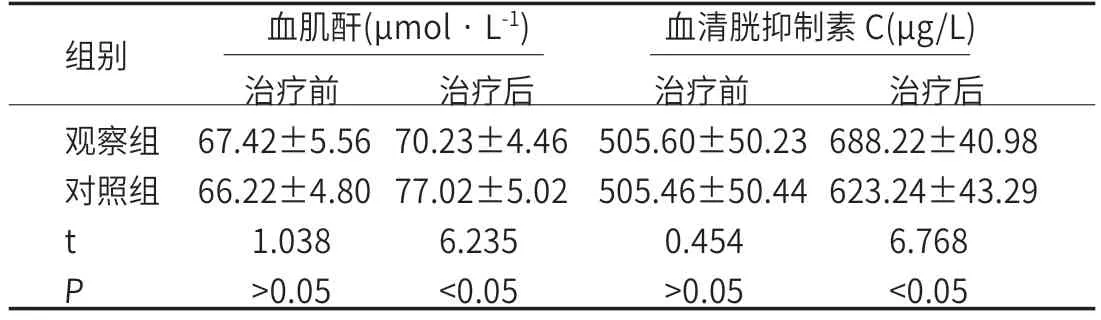
表2 两组肾功能指标比较(n=32/50)
2.4 并发症发生情况比较观察组患者的并发症率为6.25%,对照组为24.00%,差异明显(P<0.05),见表3。
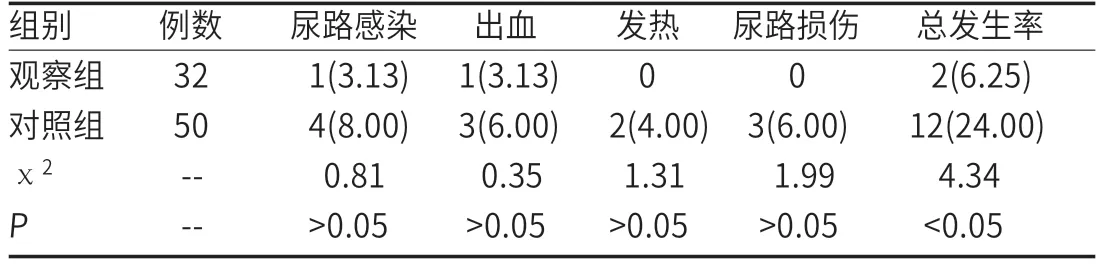
表3 两组患者并发症发生情况比较[n(%)]
3 讨 论
PCNL、FURL均是治疗肾结石常用的微创技术,与开放性外科手术相比,微创碎石技术的并发症更高,创伤性更大,其显著的微创优势已经得到临床上的一致肯定[7]。在PCNL治疗时,可在皮肤与肾集合系统之间建立工作通道,经肾盂、输尿管、肾盏将内镜置入,并利用超声或激光等技术碎石,并将碎石排出,达到治疗效果[8]。由于PCNL的适用范围较广,治疗效果显著,已经得到临床上的一致肯定。但该术式操作复杂,对肾实质损伤较大,且由于术后造瘘、留置引流管,可引起诸多并发症,存在一定局限性。而FURL则是利用输尿管软镜技术,经自然腔道进入病灶,具有无创性,且转动角度较大,基本能够覆盖全部肾盏,可在直视下观察肾盂各部位,其创伤小、并发症少、操作简单。与体外冲击波碎石治疗相比,其结石清除率更高,可降低再治疗率[9]。
研究认为[10],FURL在治疗直径<2cm肾结石方面更具优势,因此被认为可作为临床治疗的首选,但对于直径≥2cm的结石,其临床疗效尚未得到认同。有研究指出,FURL在治疗2~3cm结石方面可获得与PCNL相当的疗效。但也有研究认为,在直径≤2cm的肾结石治疗方面,FURL的结石清除率可达到94%,与PCNL相当,对于2~3cm的结石,其结石清除率有所下降,与PCNL相比略低。分析其原因,可能与肾内灌注高压有关,由于碎石激光能量受限,若结石直径稍大,则可能出现排石不完全情况,从而影响结石清除效果[11]。在本次研究中,观察组患者经治疗结石清除率为93.75%,对照组应用94.00%,无明显差异(P>0.05),可见两者的结石清除率无明显差异。通过应用输尿管软镜、钬激光,可达到碎石、分解结石的目的。同时,在本次研究中,主要利用钬激光碎石,钬激光的波长为2.1μm,是一种新型激光治疗,其能量能够使光纤末端以及结石的水汽气化,形成微小空泡,并将能量传递至结石,从而达到碎石效果,且气化的水汽还能够在一定程度上将激光释放的能量吸收,从而达到降低副损伤的目的。除此之外,钬激光的组织穿透度较浅,因此利用钬激光碎石也能够减少对邻近组织的损伤,保障治疗安全。由于钬激光能量较强,碎石力度较大,因此能够减少结石残留,从而获得较高的结石清除率[12]。同时,在本次研究中,与对照组比较,观察组患者的手术时间更短,失血量更低,住院时间更短,差异明显(P<0.05),可见与PCNL相比,FCNL手术时间更短,失血量更低,住院时间更短,降低手术创伤。在以往的治疗中,为确保输尿管软镜的走向正确,其手术时间相对延长,而在本次研究中,借助输尿管硬镜以及输尿管输送鞘,可在减少创伤性操作的同时缩短手术时间,且患者疼痛程度更低,失血量更少,患者术后恢复更块。也有学者认为[13],其操作时间较少、手术创伤下降也与医师临床经验积累、操作技术提升、镜体直径缩小、灵活度增加有关。但有研究指出[14],在2~3cm结石治疗时,FURL手术时间有所延长,可能与需要更多时间击碎结石、需要多次使用套石篮有关。
在肾功能影响方面,有研究显示[15],与PCNL相比,FCNL治疗患者术后 尿肾脏损伤因子-1、白细胞、血肌酐、血红蛋白等指标更佳,也证实了FCNL患者的肾功能损伤、炎症反应更轻。在本次研究中,治疗后,两组患者的血肌酐水平低于对照组,血清胱抑制素C水平明显高于对照组(P<0.05),也证实了FCNL对肾功能的损伤更轻。分析其原因,主要是由于FURL利用自然腔道,可最大程度的降低肾实质、肾盂黏膜损伤,可降低出血、感染风险。而PCNL需要穿刺、扩张等操作,均会损伤肾实质、肋间血管,可引起出血[16]。同时,在PCNL治疗时,其搜寻残留结石的操作需要较大幅度的摆动工作鞘,也容易造成叶间血管的损伤,甚至可能造成肾盏颈撕裂。而FURL手术则能够避免该类创伤。从安全性上看,观察组患者的并发症率为6.25%,对照组为24.00%,差异明显(P<0.05),也证实了其并发症率更低,安全性更好。
综上所述,FURS治疗可获得与PCNL相当的结石清除率,可降低失血量,缩短手术及术后恢复时间,同时可降低肾功能损伤,减少并发症发生。

