一起副溶血性弧菌食源性聚集事件的实验室检测及病原分析
李佳琪 罗昱玥 章兴隆 刘义萍 周莹冰
摘 要:目的:对一起游轮聚集性食源性疾病事件进行病原学调查,为预防食源性疾病事件的发生提供依据。方法:对采集的肛拭子、食品标本进行病原菌分离、鉴定,对分离出的5株副溶血性弧菌进行血清型鉴定、毒力基因(tlh、tdh、trh)鉴定,脉冲场凝胶电泳分子分型,开展药敏实验。结果:从5例病例肛拭标本中分离到副溶血性弧菌,菌株血清型均为O9:K44,所有菌株毒力基因为tlh+tdh+trh-;脉冲场凝胶电泳聚类分析显示3株同源性为100%,其余2株与这3株的同源性分别为88.89%、83.78%;药敏试验显示5株分离株仅对氨苄西林中度敏感,对氯霉素、甲氧苄啶/磺胺甲噁唑、多粘菌素E、厄他培南、头孢噻肟、头孢他啶、头孢他啶/阿维巴坦、四环素、替加环素、美罗培南、头孢西丁、环丙沙星、萘啶酸、阿奇霉素、阿米卡星和链霉素均敏感。结论:引起此次聚集性食源性疾病的病原菌是副溶血性弧菌O9:K44型,相关部门应加强对旅行机构餐饮宴席的日常监管,预防类似事件的发生。
关键词:副溶血性弧菌;食源性疾病;脉冲场凝胶电泳;药敏
Abstract: Objective: To investigate the causes of a clustered foodborne disease event which happened on a cruise ship and provide basis for the prevention and control of similar incidents. Method: Pathogens were isolated and identified from anal swabs and food samples collected, serotype identification, virulence genes (tlh, tdh, trh) identification, molecular typing by pulsed field gel electrophoresis, and drug sensitivity test were carried out for five strains of Vibrio parahaemolyticus isolated. Result: Vibrio parahaemolyticus was isolated from anal swabs of 5 cases. The serotype of all strains was O9:K44, and the virulence gene of all strains was tlh+tdh+trh-. Pulsed field gel electrophoresis cluster analysis showed that the homology of 3 strains was 100%, and the homology of the other 2 strains was 88.89% and 83.78%, respectively. Drug sensitivity tests showed that the 5 isolates were only moderate sensitive to ampicillin, and were sensitive to chloramphenicol, trimethoprim/sulfamethoxazole, polymyxin E, ertabenem, cefotaxime, ceftazidime/avibartam, tetracycline, tegacycline, meropenem, cefoxime, ciprofloxacin, nalidixic acid, azithromycin, amicacin and streptomycin. Conclusion: This incident was a clustered foodborne disease event caused by Vibrio parahaemolyticus serotype O9:K44, the relevant departments should strengthen monitoring and inspection of the food safety of cruise ship, so as to avoid the occurrence of foodborne diseases.
Keywords: Vibrio parahaemolyticus; foodborne disease; pulsed field gel electrophoresis; drug sensitivity
副溶血性弧菌是一类革兰氏阴性无芽孢杆菌,具有嗜盐性,可引起人类多种不同疾病,如败血症、急性胃肠炎、伤口感染等[1]。副溶血性弧菌最早于1950年从日本1例食物中毒的病人粪便中初次分离得到,是最常见的食源性致病菌之一,在近海岸的海水、海产品、海底沉积物中广泛存在。由于海产品在运输和销售中会交叉污染,导致副溶血性弧菌在淡水产品中也被大量检出。人们摄入被副溶血性弧菌污染的食品会引发食物中毒,导致患者出现恶心、呕吐、腹痛、腹泻和发烧等典型急性胃肠炎反应。副溶血性弧菌是细菌性食物中毒事件中的重要病原体。2021年4月18日,渝中区疾病预防控制中心接到某医院电话报告称“某游轮出现10余名疑似食物中毒病人”,立即赶往医院与游轮现场进行流行病学调查,采集肛拭子,留样食品进行检测。根据患者的临床表现、流行病学调查结果、实验室检测结果综合研判,认为本次事件是一起由副溶血性弧菌引起的食源性聚集事件。为进一步了解阳性菌株的病原学特征以及各菌株之间的相关性,本研究对分离的副溶血弧菌进行血清学鉴定、实时荧光PCR鉴定毒力基因、脈冲场凝胶电泳(Pulsed Field Gel Electrophoresis,PFGE)分子分型和药敏试验。
1 材料与方法
1.1 材料与试剂
显色培养基,科玛嘉微生物技术有限公司;其余培养基,北京陆桥技术股份有限公司;副溶血性弧菌血清,日本生研公司;病毒核酸提取试剂盒(磁珠法),江苏硕世生物科技有限公司;诺如病毒GⅠ/GⅡ双重荧光PCR检测试剂盒、食源性致病菌核酸多重实时荧光PCR检测试剂盒、副溶血性弧菌(tdh、trh、tlh)三重核酸检测试剂盒,北京卓诚惠生生物科技有限公司;VITEK 2 Compact GN鉴定卡,法国生物梅里埃股份有限公司;限制性内切酶XbaⅠ、NotⅠ,日本TaKaRa生物工程有限公司;琼脂糖SeaKem Gold Agarose,瑞士LONZA;蛋白酶K,北京索莱宝科技有限公司;革兰阴性菌药敏检测卡(CHNENF),赛默飞世尔科技有限公司。
1.2 设备与仪器
SSNP-9600A全自动核酸提取仪,江苏硕世生物科技有限公司;VITEK 2 Compact全自动微生物生化鉴定仪,法国生物梅里埃股份有限公司;CFX96实时荧光定量PCR仪,美国Bio-Rad公司;CHEF Mapper脉冲场凝胶电泳仪及凝胶成像系统,美国Bio-Rad公司。
1.3 试验方法
1.3.1 样品来源
采集样品28件,其中病例肛拭标本13件,留样食品15份,病例肛拭标本一式两份,分别存放于Cary-Blair运送培养基和病毒采样液中,及时送至实验室检测。
1.3.2 病原菌的分离鉴定
对采集样品进行诺如病毒和食源性致病菌实时荧光PCR检测,按照国家标准对沙门氏菌、空肠弯曲菌、副溶血性弧菌和致泻性大肠埃希氏菌等病原菌进行增菌分离培养。
1.3.3 血清学试验
取新鲜分离培养的副溶血性弧菌菌苔至含3%氯化钠的5%甘油溶液中,研磨乳化均匀,121 ℃高压1 h,4 000 r·min-1离心15 min,吸取上清液,加入等体积的生理盐水重悬,玻片凝集检测O抗原,生理鹽水作为自凝对照。取菌苔与含3%氯化钠的5%甘油溶液制备浓厚的菌悬液,玻片凝集检测K抗原,3%氯化钠溶液作为自凝对照。
1.3.4 毒力基因鉴定
用接种环刮取新鲜培养的菌苔于100 μL DNA裂解液中研磨均匀,100 ℃水浴10 min后冰上放置5 min,12 000 r·min-1离心2 min,取上清液进行实时荧光PCR检测毒力基因(tdh、trh、tlh)。
1.3.5 脉冲场凝胶电泳分型
分离出的5株副溶血性弧菌以Not Ⅰ酶切,沙门菌标准菌株H9812用限制性内切酶Xba Ⅰ酶切,作为分子量标(marker),电泳时间18 h,脉冲时间10~35 s,以Gelred染胶后使用凝胶成像系统成像。
1.3.6 药敏试验
按照微量肉汤稀释法对分离的病原菌进行药敏试验,采用定制的商品化MIC药敏板CHNENF进行药敏测试,含氨苄西林、头孢西丁、美罗培南、环丙沙星、氯霉素等17种抗菌药物,大肠埃希氏菌标准菌株ATCC 25922作为本次试验的质量控制菌株。
2 结果与分析
2.1 病原体检测
经实时荧光PCR检测,所有样品诺如病毒检测均为阴性;食源性致病菌核酸多重实时荧光PCR检测出5件病例肛拭样品弧菌阳性,其余样品均为阴性。28件样品进行分离培养,荧光PCR检测为弧菌阳性的5件样品均分离到副溶血性弧菌,未检出其他致病菌,其余8件肛拭样品和15件留样食品均未检出致病菌。
2.2 血清学试验
分离到的5株副溶血性弧菌均为O9:K44血清型,结果一致。
2.3 毒力基因鉴定
对分离到的5株副溶血性弧菌采用实时荧光PCR方法检测毒力基因,5株副溶血性弧菌均为tdh、tlh基因阳性,trh基因阴性,结果一致。
2.4 PFGE分子分型
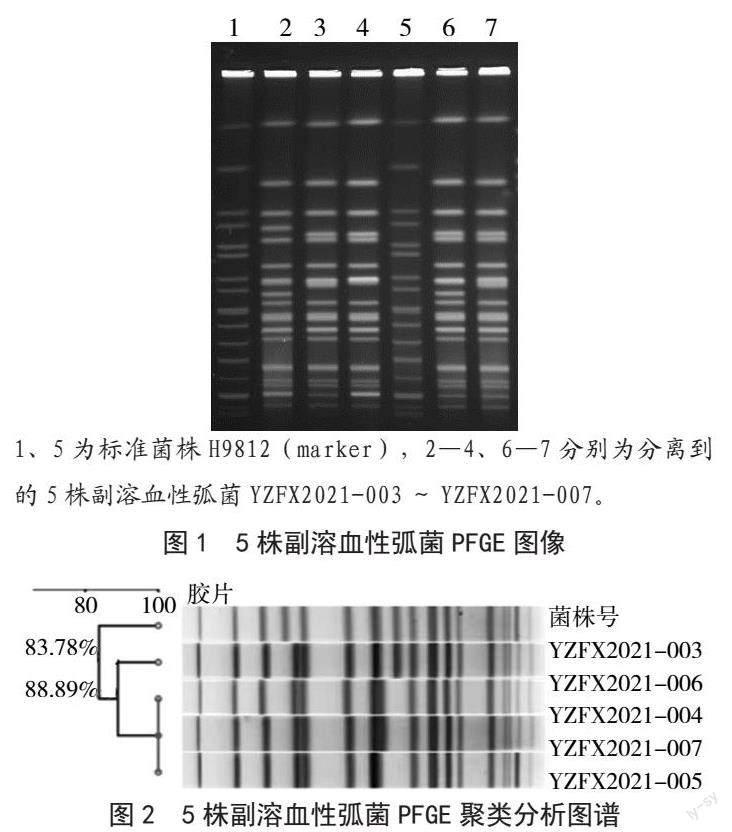
用限制性内切酶NotⅠ对5株副溶血性弧菌基因组核酸酶切,进行脉冲场凝胶电泳,结果如图1所示,YZFX2021-004、YZFX2021-005、YZFX2021-007具有完全相同的带型,另外2株稍有不同。如图2所示,PFGE分子分型聚类分析发现YZFX2021-004、YZFX2021-005、YZFX2021-007的同源性为100%,YZFX2021-006和YZFX2021-003与这3株的同源性为88.89%、83.78%。
1、5为标准菌株H9812(marker),2—4、6—7分别为分离到的5株副溶血性弧菌YZFX2021-003~YZFX2021-007。
2.5 药敏试验结果
本次试验质控标准菌株ATCC 25922药敏结果在质控范围内,表明试验结果有效。结果判定参照《疾控系统药敏判断标准-2022修订》,药敏结果显示5株菌株对氨苄西林中度敏感,对氯霉素、甲氧苄啶/磺胺甲噁唑、多粘菌素 E、厄他培南、美罗培南、头孢噻肟、头孢他啶、头孢他啶/阿维巴坦、四环素、替加环素、头孢西丁、环丙沙星、萘啶酸、阿奇霉素、阿米卡星、链霉素均敏感,无多重耐药表型,5株菌株结果一致。
3 结论与讨论
副溶血性弧菌引起的食物中毒事件在沿海地区时有发生,在微生物性食物中毒事件中高居首位,发生频次、人群暴露规模均表现出明显的上升趋势。海产品是副溶血性弧菌食源性污染的主要媒介。随着交通运输业的发展和内陆居民饮食结构的变化,我国微生物性食物中毒的致病因子逐步发生了变化。研究表明,在全国范围内,副溶血性弧菌导致的食物中毒事件数量已升至第二位,仅次于沙门氏菌[2]。实验室在5名病例肛拭子中检出血清型一致的副溶血性弧菌O9:K44型,虽然未在留样食物中检出该菌,同时由于游轮方食品留样不全,不排除游客食用了游船之外的食品,可能存在携带致病菌食物漏检的情况。尽管未确定病因食品,但根据现场流行病学调查、患者的临床表现、实验室检测结果综合分析,判定该事件为一起由副溶血性弧菌引起的聚集性、食源性疾病事件。
实验室通过荧光PCR快速筛查和常规分离培养鉴定,迅速获得了副溶血性弧菌核酸阳性结果,这一结论在后续的分离培养中得到证实,对于事件的及时处理和控制起到了关键作用。在突发性食源性疾病事件调查中,应用快速检测方法对于及时确定病原体、开展后续事件处置工作具有重要的意义。
副溶血性弧菌的致病性主要由毒力因子造成,毒力因子包括溶血素类、侵袭因子、尿素酶等。溶血素类包括耐热直接溶血素(Thermostable Direct Hemolysin,TDH)和耐热相关溶血素(Tdh-elated Hemolysin,TRH),二者作用于宿主细胞表面,可破坏细胞的完整性[3]。副溶血性弧菌还可产生不耐热溶血素(Thermolabile Hemolysin,TLH),现普遍认为tlh基因是副溶血性弧菌的特异性基因,在所有分离株中均可检测到。本实验室对分离培养出来的5株副溶血性弧菌进行tdh、trh、tlh基因检测,发现5株菌株均为tdh和tlh基因阳性,trh基因阴性。
PFGE是目前广泛应用于食源性致病菌分子溯源的重要方法[4-5]。根据公认的判定标准[6],具有85%以上相同条带的菌株可认为是相同菌株。在本次事件中,分离到的5株副溶血性弧菌有4株菌株经PFGE聚类分析发现具有85%以上的相似性,另一菌株带型与这4株稍有不同,提示本次事件中可能存在不同的污染源,但未从食品中分离出相关菌株,不能判断本次事件的病因食品。
分离的5株菌株对氨苄西林为中度敏感,对头孢他啶、头孢噻肟等其他16种药物均敏感,与重庆市万州区报道[7]的药敏结果相同,与广州市、浙江省等地报道[8-12]的分离菌株对氨苄西林耐药情况不同,与北京市、辽宁省等地[13-14]副溶血性弧菌的耐药情况有显著不同,表明耐药性除了受血清型、来源背景的影响,还具有地域差异。水产品养殖应规范、合理使用抗生素,避免副溶血性弧菌的耐药性变异,降低多重耐药的风险。对腹泻病人进行抗生素治疗时,应结合药敏试验结果,确保临床合理用药,降低耐药菌株的产生。
游轮旅游具有旅程时间较长、人员聚集程度较高等特点,相关部门应加强对旅行机构餐饮宴席等重点领域的日常监管,强化食品安全知识的宣传培训,提高食品相关从业人员的食品安全意识和个人卫生意識,规范食品制作流程,注意生熟分开,并按要求做好食品的留样,减少食源性疾病的发生。
参考文献
[1]BAKER-AUSTIN C,OLIVER J D,ALAM M,et al.Vibrio spp. infections[J].Nature Reviews Disease Primers,2018,4(1):1-19.
[2]刘辉,任婧寰,伍雅婷,等.2018年全国食物中毒事件流行特征分析[J].中国食品卫生杂志,2022,34(1):147-153.
[3]张健,朱秋华,张明,等.副溶血性弧菌毒力因子及耐药机制研究进展[J].食品与发酵工业,2022,48(1):301-307.
[4]LUKINMAA S,TAKKUNEN E,SIITONEN A.Molecular epidemiology of Clostridium perfringens related to food borne outbreaks of disease in Finland from 1984 to 1990[J].Appl Environ Microbiol,2002,68(8):3744-3749.
[5]ALAM M,CHOWDHURY W B,BHUIYAN N A,et al.Serogroup, virulence, and genetic traits of Vibrio parahaemolyticus in the estuarine ecosystem of Bangladesh[J].Applied and Environmental Microbiolo-gy,2009,75(19):6268-6274.
[6]TENOVER F C,ARBEIT R D,GOERING R V,et al.Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel electrophoresis: criteria for bacterial strain typing[J].Journal of Clinical Microbiology,1995,33(9):2233-2239.
[7]孔令汉,贺良,唐敏,等.2021年重庆市万州区两起食物中毒事件副溶血性弧菌溯源和耐药性分析[J/OL].中国预防医学杂志:1-12[2023-03-24].http://kns.cnki.net/kcms/detail/11.4529.R.20220901.1744.002.html.
[8]张晶,王安娜,陶霞,等.一起副溶血性弧菌食物中毒分离株的特征分析[J].中国食品卫生杂志,2021,33(3):256-259.
[9]吴晓芳,陈莉萍,沈月华,等.一起由副溶血性弧菌引起的聚集性腹泻事件的病原特征分析[J/OL].中国食品卫生杂志:1-7[2023-03-24].http://kns.cnki.net/kcms/detail/11.3156.R.20220607.1801.002.html.
[10]严伟,沈月华,徐德顺.2019年浙江省湖州市副溶血性弧菌病原学特征分析[J].中国食品卫生杂志.2021,33(1):74-78.
[11]刘秀峰,叶海梅,陈凡冰,等.副溶血性弧菌耐药检测和分子生物学分型[J].中国热带医学,2021,21(8):742-747.
[12]强鑫华,蔡云祥.食源性腹泻患者分离副溶血性弧菌毒力基因及药敏分析[J].中国卫生检验杂志,2021,31(2):155-158.
[13]曲梅,田祎,黄瑛,等.2010—2019年北京市副溶血性弧菌临床分离株血清型和耐药性分析[J].首都公共卫生,2020,14(6):285-290.
[14]李雪,孙婷婷,刘海霞,等.2020年辽宁省副溶血性弧菌PFGE分型、血清型分布和耐药谱分析[J].中国食品卫生杂志,2022,34(6):1166-1171.
作者简介:李佳琪(1990—),女,土家族,重庆人,本科,主管技师。研究方向:微生物检验。
通信作者:周莹冰(1975—),女,四川泸州人,博士,副主任技师。研究方向:微生物检验。E-mail: 377616489@qq.com。

