珠芽魔芋叶片组培褐变抑制条件探索
张利娜 王蕊嘉 谢雨琪 王天喜 吴学尉 李文涵 赵青青





摘要 以珠芽魔芋叶片作为外植体,通过培养温度、活性炭以及培养光暗条件的改变等简单易操作的方式,探索抑制组织褐变的最佳环境条件。结果表明,与光照相比,黑暗培养条件可以有效抑制魔芋叶片组织褐变,褐变率仅为 5.88%;温度和活性炭处理对珠芽魔芋叶片褐变的抑制效果均不佳。
关键词 珠芽魔芋;叶片;褐变
中图分类号 S 632.3 文献标识码 A 文章编号 0517-6611(2023)05-0037-04
doi: 10.3969/j.issn.0517-6611.2023.05.010
开放科学(资源服务)标识码(OSID):
Study on Browning Inhibition of Amorphophallus bulbifer Leaf Tissue Culture
ZHANG Li-na,WANG Rui-jia,XIE Yu-qi et al
(College of Agriculture, Yunnan University, Kunming, Yunnan 650504)
Abstract Amorphophallus bulbifer leaves were used as explants to explore the optimal environmental conditions for inhibiting tissue browning through simple and easy operation methods such as culture temperature, activated carbon and the change of light and dark conditions. The results showed that compared with light culture, dark culture conditions could effectively inhibit the browning of konjac leaves, and the browning rate was only 5.88%.The inhibitory effects of temperature and activated carbon treatment on the browning of konjac leaves were poor.
Key words Amorphophallus bulbifer;Leaves;Browning
珠芽魔芋是近年來已经产业化应用的一类可食用魔芋,因葡甘聚糖含量高、抗病能力强、种植范围广等优良特性,在食品、医药、工业等领域广泛应用,有较高经济价值,可作为林下经济作物种植,发展立体农业,带动山区经济增长,具有良好的产业开发与市场前景[1-3]。珠芽魔芋生产中多采用叶面球茎或地下球茎切块的方式进行繁殖[4]。但目前珠芽魔芋种球生长周期长,繁殖率较低,原种、原原种、种芋数量严重不足[5],不能满足市场与日俱增的种苗需求,利用组培快繁技术可以很好地解决这些问题。但魔芋组织培养严重的褐变现象,阻碍了魔芋组培苗的规模化发展。
组织褐变是组织培养中的一个普遍现象,主要是由于酚类化合物积累氧化形成有毒性的棕褐色物质,抑制组织生长,在组培过程中该物质还会在培养基中扩散,抑制其他外植体生长,直至死亡[6]。目前,大多通过在培养基中添加褐变抑制剂,改善培养条件来抑制褐变,提高组培成功率[7-8]。如在草莓茎尖培养时,黑暗预处理可减轻草莓茎尖褐变发生程度,提高茎尖萌发率,但单一黑暗处理并不能抑制褐变的发生[9]。低温条件下,酶活性下降,可有效抑制酚类物质的生物合成,进而减轻褐变。还可通过添加吸附剂的方式来吸附已产生的酚类物质,抑制褐化。如在培养基中添加一定浓度具有吸附作用的活性炭或抑制酚类物质产生的化学抑制剂等[10]。但导致褐变的原因多种多样,化学抑制剂的添加一定程度上对愈伤组织的形成有负面影响。
目前魔芋组织培养主要是以球茎、根状茎、实生籽、叶柄、芽鞘、花序轴、叶片等作为外植体。2001 年,研究者使用白魔芋和花魔芋的根茎、块茎及种子诱导愈伤,发现魔芋离体繁殖产 生的拟块茎也可作为繁殖器官,直接用作种芋[11]。随后组培研究逐渐深入,研究者以根状茎和实生籽为试验对象,优化培养基配方,120 d即可生产出优质的魔芋组培苗[12],极大地缩短了魔芋种球繁殖周期。然而魔芋根状茎、实生籽、花序轴需要生长 3 年以上的魔芋球茎才能产生,作为外植体材料获取困难。相比于花魔芋,珠芽魔芋组培研究起步较晚,相关报道较少,外植体主要集中在芽鞘、叶柄和叶片[13-15]。
叶片是组织培养中最大量且易得的外植体材料。魔芋近缘物种红掌的组培再生体系中,叶片因为其诱导率高,愈伤组织质地紧密,后期生长快速等成为最合适的外植体材料[16]。魔芋中,研究者以魔芋块茎、芽、叶柄、叶片作为外植体材料,愈伤诱导率均不高且存在严重褐变的情况[17]。另有研究者根据叶的生长时期不同,以叶芽、开始伸出鳞片叶片、完全伸出鳞片叶片、刚展开的叶片和成熟的叶片 5 个不同发育时期的叶片作为组培外植体[15],结果表明,叶片具有较高的愈伤诱导率且能够再生成苗,但组织褐变严重,有关珠芽魔芋叶片褐变抑制的相关研究尚未见报道,褐变仍是制约魔芋组培技术发展的关键难题。
笔者以珠芽魔芋叶片作为外植体,通过设置光照和黑暗的培养条件,不同温度条件和培养基是否添加活性炭等培养方式,探究抑制珠芽魔芋叶片组培褐变的最佳培养方法,为珠芽魔芋叶片组织的高效诱导提供参考。
1 材料与方法
1.1 材料
2020 年从云南省临沧市获得珠芽魔芋叶面球茎,低温解除休眠后种植于云南省昆明市云南大学温室大棚内,展叶后随机采取不同株的叶片作为外植体材料开展组织培养试验。
1.2 方法
1.2.1 外植体消毒。
将采集到的叶片浸泡在加有洗洁剂的自来水中浸泡5 min将表面刷洗干净;叶片装入网袋流水冲洗30 min,擦拭表面水分后放入已灭菌的超净工作台中;在超净工作台中,75%乙醇浸泡叶片30 s,无菌水清洗3次,每次2 min;使用2%次氯酸钠浸泡叶片8 min,无菌水清洗5次,每次2 min;滤纸吸干叶片表面多余水分后,剪切成0.2~0.5 cm2大小用于后续试验。
1.2.2 不同激素处理。
将经过表面消毒后的魔芋叶片剪成0.2~0.5 cm2大小,接种在含有不同激素类型和浓度的培养基中。具体配方为NAA 0.5 mg/L+6-BA 1.0 mg/L(A1),
NAA 05 mg/L+6-BA 1.0 mg/L+2,4-D 0.5 mg/L(A2),
NAA 0.5 mg/L+6-BA 1.0 mg/L+2,4-D 1.0 mg/L(A3),
NAA 0.5 mg/L+6-BA 1.0 mg/L+TDZ 0.5 mg/L(A4),
NAA 0.5 mg/L+6-BA 1.0 mg/L+TDZ 1.0 mg/L(A5)。
14 d更换一次培养基,28 d后进行愈伤诱导和褐变统计。
1.2.3 不同培养环境。
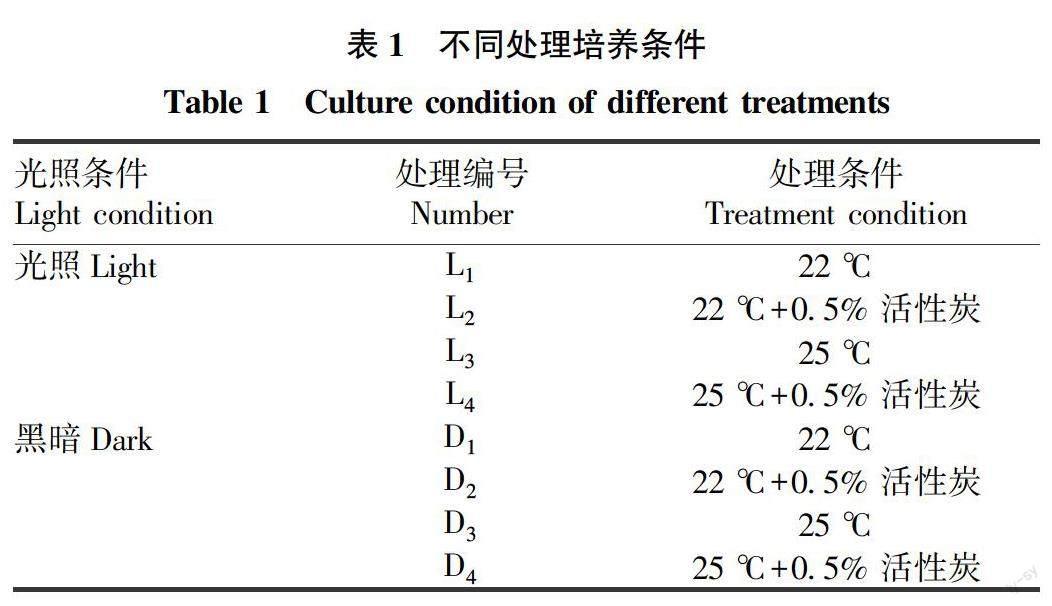
叶片剪切成0.2~0.5 cm2大小作为外植体,接种在MS+1.0 mg/L 6-BA+0.5 mg/L NAA培养基中,每瓶接种10个外植体,设置光照培养(1 500 lx)或暗培养,培养温度22或25 ℃,是否添加0.5%活性炭组合的培养条件。14 d更换一次培养基,28 d后进行愈伤诱导和褐变统计。各处理条件见表1。
1.2.4 褐變评定指标。
培养28 d后对材料进行统计,材料边缘因剪切引起的褐变不计入统计内。由培养材料本身性质和不良培养条件引起的褐变会在培养过程中向叶片中部扩散,统计时将褐变面积超过接种材料面积50%及以上的材料记为褐变。
1.3 数据统计与分析 统计所得数据采用 IBM SPSS Statistics 25 软件进行统计分析。
褐变率= 褐变外植体数量/无污染的接种外植体总数×100%
愈伤诱导率= 愈伤组织数量/无污染的接种外植体总数× 100%
2 结果与分析
2.1 激素处理对叶片褐变的影响
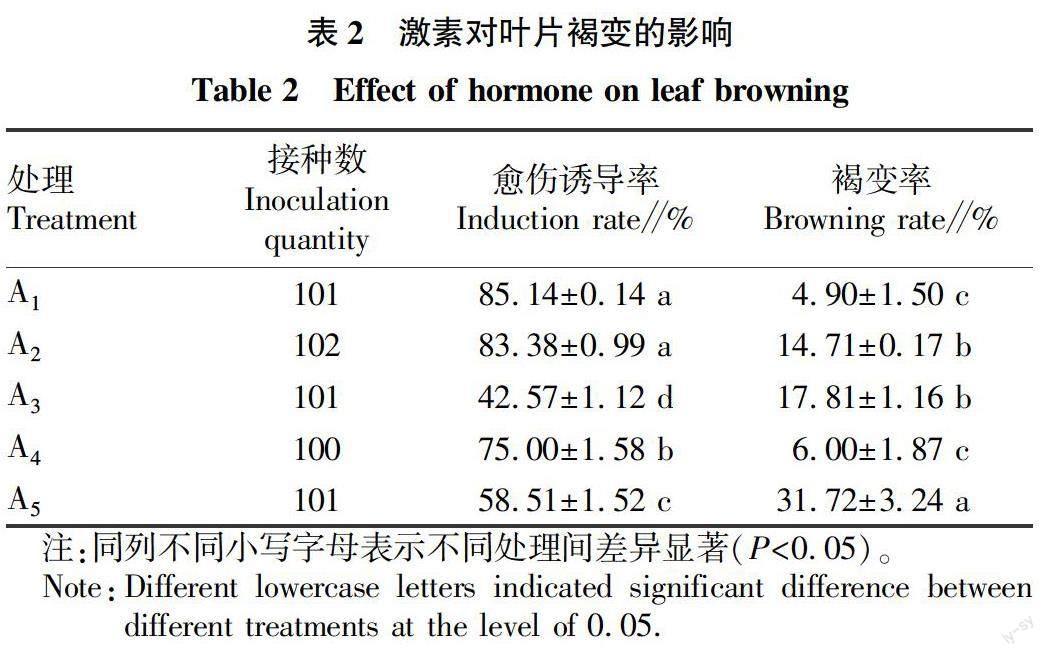
以接种在MS+1.0 mg/L 6-BA+0.5 mg/L NAA 为基础培养基中的叶片作为对照,其余叶片接种在含不同浓度 2,4-D 和 TDZ 的培养基中。由表2可知,叶片在愈伤诱导率和褐变率方面与对照有明显差异,褐变率均高于对照。低浓度的 2,4-D 的愈伤诱导效果明显优于同浓度的 TDZ,但褐变率较高,接种于1.0 mg/L 的 2,4-D 或 TDZ 培养基中的材料褐变率均明显升高,同时愈伤诱导也被抑制(图1)。
2.2 黑暗处理对叶片褐变抑制效果
将接种在MS+1.0 mg/L 6-BA+0.5 mg/L NAA培养基和接种在MS+1.0 mg/L 6-BA+0.5 mg/L NAA+0.5%活性炭培养基中的叶片培养在22或25 ℃无光照的黑暗条件下。结果表明,黑暗条件下,添加活性炭的培养材料在22、25 ℃条件下褐变均较不添加活性炭的材料严重,25 ℃时褐变率最高可达 7679%。不添加活性炭的外植体材料褐变率明显较低,叶片褐变率最低为 588%,同时可保持较高的愈伤诱导率。2种培养温度下外植体褐变率差异不显著(表3、图2)。
2.3 光照处理对叶片褐变抑制效果
将接种在 MS+1.0 mg/L 6-BA+0.5 mg/L NAA 培养基和接种在 MS+1.0 mg/L 6-BA+0.5 mg/L NAA+0.5% 活性炭培养基中的叶片培养在22或25 ℃ 光照条件下。结果表明,光照条件下,不添加活性炭的外植体材料褐变率明显较低,叶片褐变率最低为 12.67%,2种培养温度下的外植体褐变率差异不显著(表4、图3)。
2.4 培养期叶片褐变情况
外植体随着培养时间的增加,褐变从叶片边缘逐渐向中部扩散,褐变的材料数量逐渐增多。培养7 d时材料无明显变化,部分材料因机械损伤,叶片边缘轻微褐变卷曲;培养14 d时有愈伤形成,褐变面积扩大,数量增多;培养21 d时,褐变扩散至材料中部,褐变数量增幅最大并出现少量的全叶片褐化,培养28 d,已褐变材料逐渐全叶片褐变,进而导致材料死亡。褐变后的材料几乎不形成新的愈伤组织,因褐变扩散还会致使已形成愈伤的材料死亡,导致愈伤数量的减少(图4)。
3 结论
该试验结果表明,珠芽魔芋叶片组培,外源激素的添加都会造成组织一定程度的褐变,不添加活性炭,22 ℃ 低温黑暗培养条件下组织褐变率最低且最有利于愈伤的形成,在不添加活性炭、25 ℃ 培养条件下,光照和黑暗培养对组织褐化的抑制效果不存在明显差异,组织褐变与愈伤形成之间存在明显的负相关性。研究还发现,叶片培养14 d时,褐变率大幅提高,28 d时,全褐变材料死亡,无法继续诱导产生新的愈伤组织,在珠芽魔芋茎段组培试验中也得到相似结果。说明褐变率突增发生在材料接种后14 d,此时也是愈伤组织开始形成的时期,活性炭在组织培养前期能够有效吸附酚类物质,减轻材料褐变,但在材料生长后期,活性炭对愈伤组织的生长和增殖有强烈的抑制作用,须在褐变大量形成前及时将材料转移至新的不含活性炭的培养基中,以获得更多的愈伤组织。
4 讨论
魔芋组培再生体系成功建立的关键因素在于成功诱导愈伤的前提下有效抑制褐变的发生。组织培养材料褐变可分为酶促褐变和非酶促褐变,除外植体本身性质外,操作过程中的机械损伤和不适宜的环境条件也易造成褐变[18-19]。魔芋本身叶片革质,细胞壁较厚,在外植体消毒过程中起一定的保护作用,但细胞内酚类物质含量较高,外植体接种过程,不可避免会造成材料损伤,因此魔芋褐变问题十分突出。
研究者通过添加化学抑制剂聚乙烯吡咯烷酮(PVP)、维生素 C(VC)、天冬氨酸(ASP)等来抑制和吸附酚类物质产生和扩散[20-22]。不同的化合物在抑制褐变的机制上不同,效果差异也很大。一些试验中化学物质的添加虽然减少了褐变,但同时也抑制了愈伤的形成[21,23]。另有研究表明,组培中常见的植物生长调节剂 2,4-D 可通过抑制多酚生物合成中的酶来减少酚类化合物的合成从而减轻组织褐变,但同样对愈伤组织的形成有抑制作用[24],这与该试验结果相似,高浓度的 2,4-D 不仅降低材料的愈伤发生率,同时显著增加了组织褐变,因此化学物质的添加具有两面性。
引起组织褐变的因素很多,如外植体生理状态、取材部位、消毒方法、培养基成分等[25],但总体而言,酶促褐变是植物组织培养中外植体褐变的主要原因,也是造成愈伤诱导率低的主要原因。一方面,由于外植体剪切造成植物损伤,诱使植物发生抗逆反应,促使大量酚类物质的产生,破坏组织代谢,抑制生长,最终导致外植体褐变和死亡;另一方面,外植体接种于透气性、流动性差的固体培养基中,加速了有害物质的积累,引起外植体死亡,进而降低愈伤诱导率。该试验对愈伤诱导和褐变进行了相关关系分析,结果显示其皮尔逊相关系数为-0.765,说明愈伤诱导率和褐变率之间呈显著负相关,因此要提高外植体出愈率,建立高效再生体系,抑制组织褐变必不可少。在其他褐变严重的植物研究中,如核桃,研究者通过对比不同培养基质中材料的褐变程度,发现多酚氧化酶 PPO(poly-phenol oxidases)在褐变过程中起重要作用[26],有研究者通过转录组测序,筛选出与愈伤形成和组织褐变的相关基因[21]。随着高通量测序技术的发展,魔芋遗传研究逐步深入,花魔芋染色体级别的基因组测序完成[27],为珠芽魔芋遗传改良提供了宝贵的基因组数据,未来或可通过遗传改良来解决组织褐变问题。
参考文献
[1] CHUA M,BALDWIN T C,HOCKING T J,et al.Traditional uses and potential health benefits of Amorphophallus konjac K.Koch ex N.E.Br[J].Journal of ethnopharmacology,2010,128(2):268-278.
[2] SANTOSA E,SUGIYAMA N,HIKOSAKA S,et al.Cultivation of Amorphophallus muelleri Blume in timber forests of East Java,Indonesia[J].Japanese journal of tropical agriculture,2003,47(3):190-197.
[3] 張东华,汪庆平.泰国—缅甸边境地区珠芽魔芋资源分布及利用现状[J].热带农业科学,2017,37(7):67-74.
[4] 张东华,汪庆平.中国魔芋种植业如何应对日本重返缅甸[J].热带农业科学,2015,35(7):76-80.
[5] 杨英,何峰,金文闻,等.魔芋种植业发展存在的问题与对策[J].湖北农业科学,2008,47(9):1095-1098.
[6] JONES A M P,SAXENA P K.Inhibition of phenylpropanoid biosynthesis in Artemisia annua L.:A novel approach to reduce oxidative browning in plant tissue culture[J].PLoS One,2013,8(10):1-13.
[7] 李川,员艳,杨松杰.降低魔芋球茎组培褐变的技术研究[J].中国农学通报,2012,28(31):243-246.
[8] 李翎,程海刚,刘晓婷.魔芋组织培养中的褐变问题及防治措施[J].农业科技通讯,2017(11):275-276.
[9] 付崇毅,姜伟,王建国,等.草莓茎尖组织培养防褐化及玻璃化研究[J].北方农业学报,2016,44(1):46-51.
[10] 张蕊,孙玲凌,王彦伟.不同活性炭浓度对楸树组培苗褐化的影响[J].农技服务,2020,37(7):45-46.
[11] 柳俊,谢从华,余展深,等.魔芋(Amor phophallus)离体繁殖研究[J].华中农业大学学报,2001,20(3):283-285.
[12] 陈国爱.花魔芋根状茎组培配方优化研究[J].蔬菜,2016(11):19-21.
[13] 吴金平,宋志红,刁英,等.珠芽魔芋的组织培养与快速繁殖[J].植物生理学通讯,2007,43(5):887-888.
[14] 桂明春,田海,唐敏,等.植物生长调节剂对珠芽黄魔芋叶柄离体培养效果的影响[J].北方园艺,2020(7):20-26.
[15] 魏博,潘登浪,刘子凡,等.珠芽魔芋组培快繁技术[J].热带作物学报,2021,42(4):975-981.
[16] 易双双,冷青云,黄少华,等.红掌新品种‘13100-A3’愈伤组织诱导及再生体系的建立[J].分子植物育种,2022,20(4):1273-1280.
[17] 周濤.“楚魔花1号”组培快繁体系的建立[D].雅安:四川农业大学,2016.
[18] 王栋,买合木提·克衣木,玉永雄,等.植物组织培养中的褐化现象及其防止措施[J].黑龙江农业科学,2008(1):7-10.
[19] 郭艳,杨海玲.植物组织培养中的褐化现象及解决途径[J].山西农业科学,2009,37(7):14-16,31.
[20] FENG Y Y,LIU Q Q,LIU P,et al.Aspartic acid can effectively prevent the enzymatic browning of potato by regulating the generation and transformation of brown product[J/OL].Postharvest biology and technology,2020,166[2021-09-27].https://doi.org/10.1016/j.postharvbio.2020.111209.
[21] GAO J,XUE J Q,XUE Y Q,et al.Transcriptome sequencing and identification of key callus browning-related genes from petiole callus of tree peony(Paeonia suffruticosa cv.Kao)cultured on media with three browning inhibitors[J].Plant physiology and biochemistry,2020,149:36-49.
[22] 戴莹,杨世海,赵鸿峥,等.药用植物组织培养中褐化现象的研究进展[J].中草药,2016,47(2):344-351.
[23] 刘贵周,谢世清,赵庆云,等.优质魔芋组培快繁技术研究[J].云南农业大学学报,2005,20(6):795-799.
[24] ZHONG L,LIU E X,YANG C Z,et al.High embryogenic ability and regeneration from floral axis of Amorphophallus konjac(Araceae)[J].Open life sciences,2017,12(1):34-41.
[25] 周亚辉.植物组织培养中褐变的影响因素及防止措施[J].现代农业科技,2016(5):117-118.
[26] ZHAO S G,WANG H X,LIU K,et al.The role of JrPPOs in the browning of walnut explants[J].BMC plant biology,2021,21(1):1-12.
[27] GAO Y,ZHANG Y N,FENG C,et al.A chromosome-level genome assembly of Amorphophallus konjac provides insights into konjac glucomannan biosynthesis[J].Computational and structural biotechnology journal,2022,20:1002-1011.

