表达表皮生长因子酿酒酵母对长江水系中华绒螯蟹生长性能•免疫功能和肠道发育的影响
徐文俊 李凤华 周炜 夏兵兵 赵俊


摘要[目的]研究表达表皮生长因子酿酒酵母对长江绒螯蟹生长性能、免疫功能以及肠道发育的影响。[方法]试验分为2组,对照组饲喂基础日粮,试验组在1 kg基础日粮基础上添加5 mL表达表皮生长因子酿酒酵母发酵液,螃蟹按照15 000 只/hm2进行投放,试验周期为9个月。[结果]与对照组相比,添加酿酒酵母能够显著提高螃蟹存活率(P<0.05),存活率提高了6.1%;但添加酿酒酵母对螃蟹血液中溶菌酶含量和组织中SOD和MDA含量没有显著性影响;而添加酿酒酵母能够显著提高螃蟹后肠肠道上皮细胞高度(P<0.05)。[结論]在长江绒螯蟹饲料中添加表达EGF酿酒酵母能够提高机体非特异性免疫力,促进肠道生长发育,提高螃蟹平均体重和存活率。
关键词 酿酒酵母;表皮生长因子;中华绒螯蟹;生长性能;免疫功能;肠道发育
中图分类号 S963 文献标识码 A
文章编号 0517-6611(2023)06-0078-03
doi:10.3969/j.issn.0517-6611.2023.06.020
Effects of Saccharomyces cerevisiae Expressing Epidermal Growth Factor on Growth Performance,Immune Function and Intestinal Development of Mitten Crab from the Yangtze River System
XU Wen-jun1,LI Feng-hua2,3,ZHOU Wei1 et al
(1.Wuhu Interferon Biological Products Industrial Research Institute Co.,Ltd.,Wuhu,Anhui 241000;2.Shandong Xundakang Veterinary Medicine Co.,Ltd.,Jinan,Shandong 250000;3.College of Animal Science and Veterinary Medicine,Huazhong Agricultural University,Wuhan,Hubei 430070)
Abstract [Objective] The purpose of the experiment was to study the effect of Saccharomyces cerevisiae expressing epidermal growth factor on the growth performance,immune function and intestinal development of mitten crab.[Method] The mitten crab was divided into two groups.The control group was fed the basal diet,and the experimental group was fed the basal diet supplementing with 5 mL Saccharomyces cerevisiae expressing epidermal growth factor.The crabs were released at a rate of 15 000 inds per hectare.The experiment period was 9 months.[Result]The results showed that compared with the control group, the addition of Saccharomyces cerevisiae could significantly improve the survival rate of mitten crab (P<0.05), the survival rate increased by 6.1%. The addition of Saccharomyces cerevisiae had no significant effect on the contents of lysozyme in blood and SOD and MDA in mitten crab tissues; the addition of Saccharomyces cerevisiaecan could significantly increase the height of intestinal villi in the hindgut of mitten crab (P<0.05).[Conclusion]Adding Saccharomyces cerevisiae expressing epidermal growth factor to the basal diet could improve the non-specific immunity,promote intestinal growth and development,and improve the average weight and survival rate of mitten crab.
Key words Saccharomyces cerevisiae;Epidermal growth factor;Mitten crab;Growth performance;Immune function;Intestinal development
随着抗生素在饲料中逐步禁止使用,人们不断开发出新的抗生素替代品。在水产养殖中,益生菌是一种最有潜力的抗生素替代品[1],酿酒酵母作为益生菌的一种,能够有效增强水产动物的消化吸收率,提高生长性能,同时增强动物的免疫水平,提高动物的存活率[2-3],酵母菌和酵母细胞壁中富含的β-葡聚糖和甘露寡糖能够竞争性抑制病原菌在肠道上定植,减少病原数量,维持肠道菌群的平衡[4-5]。
表皮生长因子(Epidermal Growth Factor,EGF)作为一种有丝分裂原,能够促进细胞的增殖与分化[6],其在畜禽养殖无抗生产中也得到研究与应用。有研究发现,在断奶仔猪日粮中添加EGF能够提高仔猪日增重,刺激肠道紧密连接蛋白mRNA的表达,抑制炎症基因mRNA表达,抑制有害菌的繁殖[7]。也有研究发现,在肉鸡饲料中添加EGF能够显著提高肉鸡生长性能、免疫功能,并且促进肉鸡的肠道发育[8]。该试验旨在研究酿酒酵母表达EGF对长江水系中华绒螯蟹生长性能、肠道发育以及免疫功能的影响。
1 材料与方法
1.1 试验材料 试验用长江水系中华绒螯蟹蟹苗购自南京高淳,蟹苗按照15 000只/hm2的密度投放至池塘中。
试验用表达表皮生长因子酿酒酵母由芜湖英特菲尔生物制品产业研究院有限公司生产。试验用饲料为海大螃蟹膨化配合饲料,主要营养成分:粗蛋白≥36.0%,粗纤维≤6.0%,粗灰分≤16.0%,粗脂肪≥4.0%,赖氨酸≥1.8%。
1.2 试验时间与场地 试验时间:2021年3—11月;试验场地:无为县贤铭特种水产养殖有限公司。
1.3 试验设计 试验将螃蟹随机分为2组,对照组池塘面积0.285 hm2,全程饲喂海大螃蟹配合饲料,试验组池塘面积0.315 hm2,试验组在1 kg配合饲料中添加5 mL的表达表皮生长因子酿酒酵母发酵液,饲料经搅拌均匀后,室内低温晾干保存,并对试验组螃蟹进行全程饲喂。
试验过程中饲养管理按照养殖场养殖规范进行,整个试验过程对照组和试验组的药物、添加剂等产品试用均保证一致。
1.4 生长指标测定 试验结束后,统计对照组和试验组的螃蟹数量、体重,按下方公式计算螃蟹平均体重、单位面积螃蟹数量、螃蟹存活率、单位面积螃蟹产量。
螃蟹平均体重(g/只)=m/n
单位面积螃蟹数量(只/hm2)=n/t
螃蟹存活率(%)=n/(t×15 000)×100
单位面积螃蟹产量(kg/hm2)=m/t
式中,m为试验结束时所有螃蟹总体重,n为试验结束时螃蟹数量,t为试验池塘大小。
1.5 血清溶菌酶测定 试验结束后,在试验组和对照组中分别随机抽取6只大小接近的螃蟹将河蟹螯足第2对关节处折断取血淋巴,置于离心管中4 ℃过夜,经冷冻高速离心机4 000 r/min离心后吸出血清,-20 ℃保存备用,溶菌酶活性采用南京建成生物工程研究所试剂盒测定。
1.6 组织超氧化物歧化酶和丙二醛含量测定 试验结束后,分别将2组螃蟹的肝脏、性腺和肌肉组织,按照重量体重比加入生理盐水制备成10%的组织匀浆,1 000 r/min离心10 min,取上清-20 ℃保存,用于超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量的测定。SOD活性用呤氧化酶法测定,MDA含量用过氧化脂质硫代巴比妥酸分光光度计法测定,两者均采用南京建成生物工程研究所试剂盒进行测定。
1.7 肠道粘膜的组织学观察 分别取出2组螃蟹的后肠,4 ℃预冷1×PBS轻轻漂洗,然后投入预先配好的10%福尔马林固定液中,固定完成后进行脱水透明、浸蜡包埋、制片和HE染色的步骤,利用尼康E-CLIPSE80i型高级研究用正置生物数码摄影显微镜观察切片,测定肠上皮细胞高度和肠绒毛高度。
1.8 统计分析 试验数据用Excel 2016进行初步处理,用
SPSS 18.0软件进行t检验,分析差异显著性,试验数据以平均值±标准差表示。
2 结果与分析
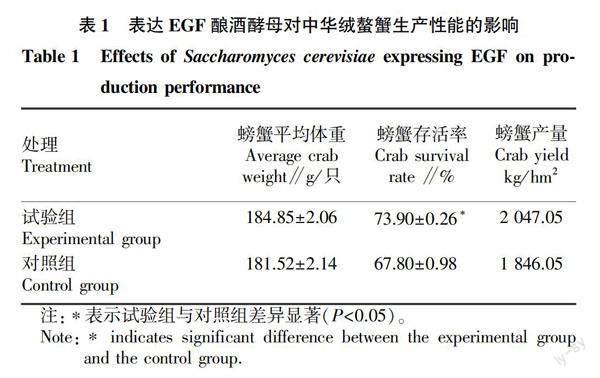
2.1 表达EGF酿酒酵母对中华绒螯蟹生产性能的影响
由表1可看出,与对照组相比,在饲料中添加表达EGF酿酒酵母能够显著提高螃蟹存活率(P<0.05),存活率提高了6.1百分点,而对螃蟹的平均体重提高了3.33 g/只,同时螃蟹产量提高201.00 kg/hm2,预计经济效益可提高20 100元/hm2(中华绒螯蟹单价约为100元/kg)。
2.2 表达EGF酿酒酵母对中华绒螯蟹血清溶菌酶含量和组织中SOD和MDA含量的影响
试验结果表明,与对照组相比,在饲料中添加表达EGF酿酒酵母对中华绒螯蟹血清溶菌酶含量影响不显著,对照组和试验组含量分别为44.44和66.67 U/mL。由表2可看出,与对照组相比,在饲料中添加表达EGF酿酒酵母对肝脏、性腺、肌肉组织中SOD和MDA的含量影响不显著(P>0.05)。
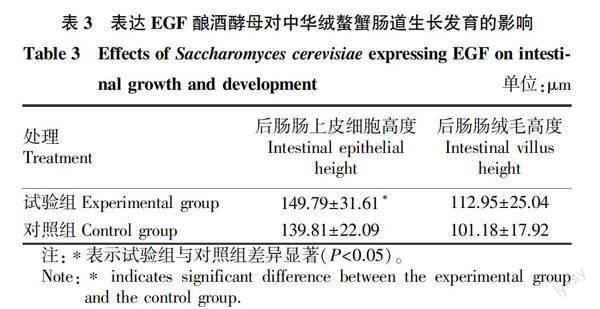
2.3 表达EGF酿酒酵母对中华绒螯蟹肠道生长发育的影响
由图1肠道组织形态学可以看出,与对照组相比,试验组肠道组织形态完整,肠壁内外层分层清晰,肠上皮细胞连接紧密,没有明显的细胞损伤和脱落;由表3可看出,与对照组相比,在饲料中添加酿酒酵母能够显著提高螃蟹后肠上皮细胞高度(P<0.05),对后肠绒毛高度有提高趋势。
3 讨论
中华绒螯蟹是我国重要的水产经济动物之一,随着养殖规模和密度的不断增加,细菌性和病毒性的疾病也越来越多,严重影响了其生产和经济效益[9]。酿酒酵母作为一种益生菌和工程菌,利用其表达表皮生长因子既能发挥益生菌的功效,又能通过表达表皮生长因子发挥其有丝分裂原的功能,是一种具有潜力的微生态饲料添加剂[10]。
酿酒酵母发酵液中含有丰富的营养物质,包括酵母细胞壁和细胞溶解物质,其能够提高动物机体免疫力[11],酵母细胞壁中含有的β-葡聚糖和甘露寡糖能够与巨噬细胞表面的糖蛋白结合激活巨噬细胞,同时增加免疫球蛋白的数量,提高动物的存活率[12]。溶菌酶是水产动物机体重要的非特异性免疫因子之一[13],其通过催化水解細菌的细胞壁使得细菌灭亡,同时增强其他免疫因子活性,协同抵抗外源致病菌的侵袭[14]。也有研究表明,在日粮中添加EGF能够促进断奶仔猪机体免疫功能的发育,提高肠道的免疫屏障功能[15]。该试验发现,在中华绒螯蟹饲料中添加表达表皮生长因子酿酒酵母有提高血清溶菌酶含量的趋势,提高了螃蟹机体的非特异性免疫功能,从而提高螃蟹养殖过程中的存活率。
利用益生菌表达EGF促进肠道发育已有一定的研究。刘淑杰等[16]研究发现,在结肠炎模型小鼠中添加表达EGF的乳酸乳球菌能够修复肠道损伤,改善肠道屏障;Zhou等[8]研究发现,在肉鸡日粮中添加表达EGF乳酸乳球菌能够提高肉鸡的生长性能,促进肉鸡肠道的发育;Wang等[17]研究发现,在断奶仔猪日粮中添加表达EGF的酿酒酵母能够促进仔猪肠道绒毛高度、绒毛隐窝比以及肠道的发育。该试验发现,在螃蟹饲料中添加表达表皮生长因子酿酒酵母能够促进螃蟹肠道发育,提高肠绒毛高度和肠上皮细胞的高度。这可能跟酿酒酵母与EGF的生物活性有关,酵母菌进入动物机体胃肠后能够产生多胺类的物质,多胺类物质能够直接参与细胞的增殖分化,以及核酸蛋白质的合成[18]。同时酿酒酵母表达的EGF能够与肠上皮细胞和微绒毛中丰富的EGFR受体结合,通过激活MAPK和PI3K型号通路促进细胞的增殖与分化,同时刺激杯状细胞分泌Muc2黏蛋白,减少有害菌的定位和迁移,维持肠道固有屏障功能[19-20],从而促进肠道的生长发育。饲喂活的酵母菌能够提高水产动物消化酶的活性,如淀粉酶、脂肪酶和胰蛋白酶,促进水产动物的消化吸收能力提升[21]。外源性添加EGF也能够显著提高动物胃肠道消化酶的活性,如α-淀粉酶、碱性蛋白酶、脂肪酶、碱性磷酸酶、肌酸激酶及乳酸脱氢酶等[10,22-23]。该试验结果表明,添加表达EGF酿酒酵母能够提高螃蟹的平均体重和产量,这可能与螃蟹中胃肠道消化酶的活性提高与肠道上皮细胞生长发育相关。
参考文献
[1] NEWAJ-FYZUL A,AL-HARBI A H,AUSTIN B.Review:Developments in the use of probiotics for disease control in aquaculture[J].Aquaculture,2014,431:1-11.
[2] 產启霞,王福强,憨素连,等.复合益生菌对大菱鲆(Scophthalmus maximus)幼鱼免疫及抗病力的影响[J].饲料工业,2021,42(20):36-40.
[3] HARIKRISHNAN R,KIM M C,KIM J S,et al.Immunomodulatory effect of probiotics enriched diets on Uronema marinum infected olive flounder[J].Fish & shellfish immunology,2011,30(3):964-971.
[4] ELGHANDOUR M M Y,TAN Z L,ABU HAFSA S H,et al.Saccharomyces cerevisiae as a probiotic feed additive to non and pseudo-ruminant feeding:A review[J].Journal of applied microbiology,2020,128(3):658-674.
[5] 易建华,杨凡,聂琴,等.酵母细胞壁中β-葡聚糖在水产养殖中的研究进展[J].中国饲料,2016(14):41-44.
[6] NI H M,SHENG X H,CUI X,et al.Epidermal growth factor-mediated mitogen-activated protein kinase3/1 pathway is conducive to in vitro maturation of sheep oocytes[J].PLoS One,2015,10(3):1-12.
[7] 汤小朋.表皮生长因子对脂多糖诱导的仔猪肠道屏障功能及磷吸收影响研究[D].长沙:湖南农业大学,2018.
[8] ZHOU Y,CHEN P P,SHI S,et al.Expression of Gallus epidermal growth factor (gEGF) with food-grade Lactococcus lactis expression system and its biological effects on broiler chickens[J].Biomolecules,2021,11(1):1-15.
[9] 李春静,张杰,祝雅晨,等.黄芪多糖在水产动物疾病防控中的应用[J].水产科学,2019,38(6):881-886.
[10] 王蜀金,王斌星,郭春华,等.分泌表达pEGF的重组酿酒酵母在断奶仔猪上的应用研究[J].畜牧兽医学报,2016,47(5):944-954.
[11] 何远法,郁欢欢,迟淑艳,等.酵母培养物对凡纳滨对虾生长性能、非特异性免疫力和抗病力的影响[J].动物营养学报,2016,28(12):4063-4072.
[12] GOPALAKANNAN A,ARUL V.Enhancement of the innate immune system and disease-resistant activity in Cyprinus carpio by oral administration of β-glucan and whole cell yeast[J].Aquaculture research,2010,41(6):884-892.
[13] ELLIS A E.Immunity to bacteria in fish[J].Fish shellfish immunol,1999,9(4):291-308.
[14] 李红,易建中,刘成倩,等.简述溶菌酶的研究现状[J].国外畜牧学(猪与禽),2016,36(6):99-101.
[15] BEDFORD A,CHEN T,HUYNH E,et al.Epidermal growth factor containing culture supernatant enhances intestine development of early-weaned pigs in vivo:Potential mechanisms involved[J].Journal of biotechnology,2015,196/197:9-19.
[16] 刘淑杰,陶新,邓波,等.表达猪表皮生长因子重组乳酸乳球菌的构建及其对结肠炎模型小鼠肠道损伤的修复作用[J].动物营养学报,2021,33(4):2253-2262.
[17] WANG S J,GUO C H,ZHOU L,et al.Comparison of the biological activities of Saccharomyces cerevisiae-expressed intracellular EGF,extracellular EGF,and tagged EGF in early-weaned pigs[J].Applied microbiology & biotechnology,2015,99(17):7125-7135.
[18] RAMOS-MOLINA B,QUEIPO-ORTUO M I,LAMBERTOS A,et al.Dietary and gut microbiota polyamines in obesity-and age-related diseases[J].Frontiers in nutrition,2019,6:1-15.
[19] TANG X P,LIU H,YANG S F,et al.Epidermal growth factor and intestinal barrier function[J].Mediators of inflammation,2016,2016(3):1-9.
[20] WANG L X,ZHU F,YANG H S,et al.Epidermal growth factor improves intestinal morphology by stimulating proliferation and differentiation of enterocytes and mTOR signaling pathway in weaning piglets[J].Science China life sciences,2020,63(2):259-268.
[21] TOVAR-RAMREZ D,INFANTE J Z,CAHU C,et al.Influence of dietary live yeast on European sea bass (Dicentrarchus labrax)larval development[J].Aquaculture,2004,234(1/2/3/4):415-427.
[22] XU S,WANG D,ZHANG P,et al.Oral administration of Lactococcus lactis-expressed recombinant porcine epidermal growth factor stimulates the development and promotes the health of small intestines in early-weaned piglets[J].Journal of applied microbiology,2015,119(1):225-235.
[23] 單春乔,刘秋晨,李娟,等.表皮生长因子对肉鸡十二指肠形态结构、消化酶活性以及表皮生长因子受体表达的影响[J].动物营养学报,2021,33(6):3218-3227.
基金项目 安徽省自然科学基金(1808085MC75);芜湖市重点研发计划(2019YF44);芜湖市发明专利技术成果产业化计划(202021)。
作者简介 徐文俊(1991—),男,安徽芜湖人,硕士,从事饲料添加剂的研发。*通信作者,讲师,博士,从事生物制品的研究与开发。
收稿日期 2022-04-11;修回日期 2022-05-09

