平台试验设计及案例分析
王晓宇,张润华,2,3,赵博特,刘改芬,2,3
1 平台试验设计背景
随机对照试验(randomized controlled trial,RCT)作为评价干预措施的金标准,被广泛应用于临床研究中[1]。但随着研究的进展和新的临床数据的产生,传统的试验设计难以满足实时调整的需要和个体化诊疗要求,此外,评价多种干预措施时,传统试验设计需要耗时耗力地进行多个独立的试验,是导致试验效率低和阻碍药物开发的重要因素之一[2-3]。因此,寻找高效的试验设计方法迫在眉睫。
2018年,美国食品和药品管理局提出了一种新型试验设计方法——主方案试验设计(master protocol),旨在在单一总体方案下单独或联合评价多种疗法或对多种疾病的疗效,包括篮式设计(basket trial)、伞式设计(umbrella trial)和平台试验设计(platform trial)3种研究设计方法[4-5]。其中,平台试验旨在长期、动态地评价某种疾病的多种治疗方法,并允许新的试验药物随时加入,有利于最佳干预方式的选择和新型药物及干预方式的评价[6]。2021年1月,国家药品监督管理局药品审评中心颁布《药物临床试验适应性设计指导原则(试行)》,为我国建立和运行篮式、伞式和平台试验提供了试验思路和指导意见[7]。平台试验设计依赖其高效、灵活、共享的特点,在临床研究中受到愈加广泛的关注[6]。
2 平台试验设计思路
平台试验用于评估多种药物/治疗措施对同一疾病的疗效,从而寻找对该类疾病最好的治疗策略,是持续性、动态的研究过程。图1展示了较为常规的平台试验设计思路[8]。在试验开始时,招募的患者接受筛查,根据筛查结果将患者随机分配到常规治疗组、药物1组和药物2组。以常规治疗组作为对照,评估两种药物的疗效。在试验进程中,研究人员按照原定计划进行两次期中分析和一次最终分析。在第一次期中分析中,药物1满足事先设定的试验“成功”或“失败”的标准,该组终止,药物2进行既定计划的最终分析。当有证据表明药物3与药物4具有潜在疗效时,研究人员分别在第一次和第二次期中分析过程中将其引入平台,与之前纳入的患者共享同一个对照组,重复上述试验过程。
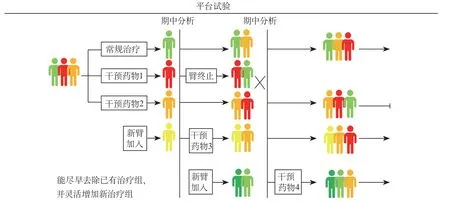
图1 常规平台试验设计示意
图2展示了涉及生物标志物的平台试验设计思路[4]。在试验开始时,利用统一的生物标志物筛选平台,对招募的患者进行标志物A和B的筛查,并根据结果将其分配到标志物A阳性组、标志物B阳性组和标志物均为阴性组。随后,标志物A阳性组患者被随机分配到药物1组、药物2组和标准治疗A组,以标准治疗A组为对照,评估药物1和药物2的疗效。当药物1符合事先设定的试验“成功”标准时,药物1取代标准治疗A成为新的对照。药物2完成原计划入组并停止新的入组。当靶向标志物A的新药物5出现后,标志物A阳性组进行随机化分组,分为药物5组和替代原有标准治疗的药物1组,以药物1作为对照,评估药物5的疗效。当药物3未达到试验“成功”标准时,标志物B组停止入组新的患者,药物3组的研究也因患者未获益而终止。此时,标志物B阳性患者被分配到标志物阴性组。当研究过程中出现了新的标志物C及其对应的靶向药物6时,设立新的标志物C阳性组,对患者进行生物标志物A和C的筛查并分配到适当的标志物组,重复上述试验进程。
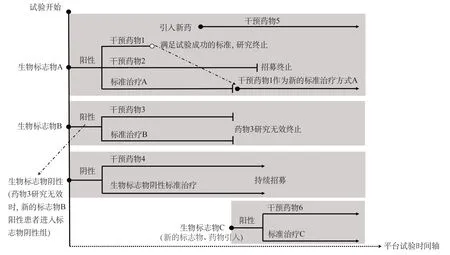
图2 生物标志物平台试验设计思路
3 平台试验设计的特点及其与篮式设计、伞式设计的关系
平台试验设计作为主方案试验设计的重要组成部分,受主方案设计整体框架的约束,在主方案约束下可加入或终止子研究,随着时间推移而持续进行,没有固定的终止日期。平台试验遵循适应性随机化设计,在不破坏试验的整体性和有效性的前提下,可以根据前期的试验和积累的信息与数据,对后续的试验方案进行调整,遵循尽可能让更多患者获益的原则,以研究积累的数据为基础进行治疗分配,将更多的患者分配到更有效的治疗组。篮式设计、伞式设计与平台试验设计均为主方案试验设计的重要组成,三者之间有一定的联系和区别(表1)[4,9]。篮式设计是一种将多类疾病联合起来,筛选出共同的作用靶点,进而评价特定的治疗方式对该靶点作用效果的研究设计。篮式设计涉及多种疾病,尤其有利于对罕见病的研究,但同时由于不同疾病的治疗方案不同,该试验设计的对照组选择略显困难。相反,伞式设计是对同一类疾病的多种生物标志物进行筛查,进而评价各类标志物对应的靶向治疗对该疾病的疗效,有助于针对同一疾病探索不同的有效治疗方案。由于疾病类型单一,传统的治疗方式可作为共享对照组,因此,对照组的选择更加方便快捷。平台试验设计与伞式设计相似,均研究多种靶向治疗方案对同一疾病的疗效,但平台试验设计是持续性的、动态的过程,有利于治疗方案的更新,且设计和执行均较为复杂。
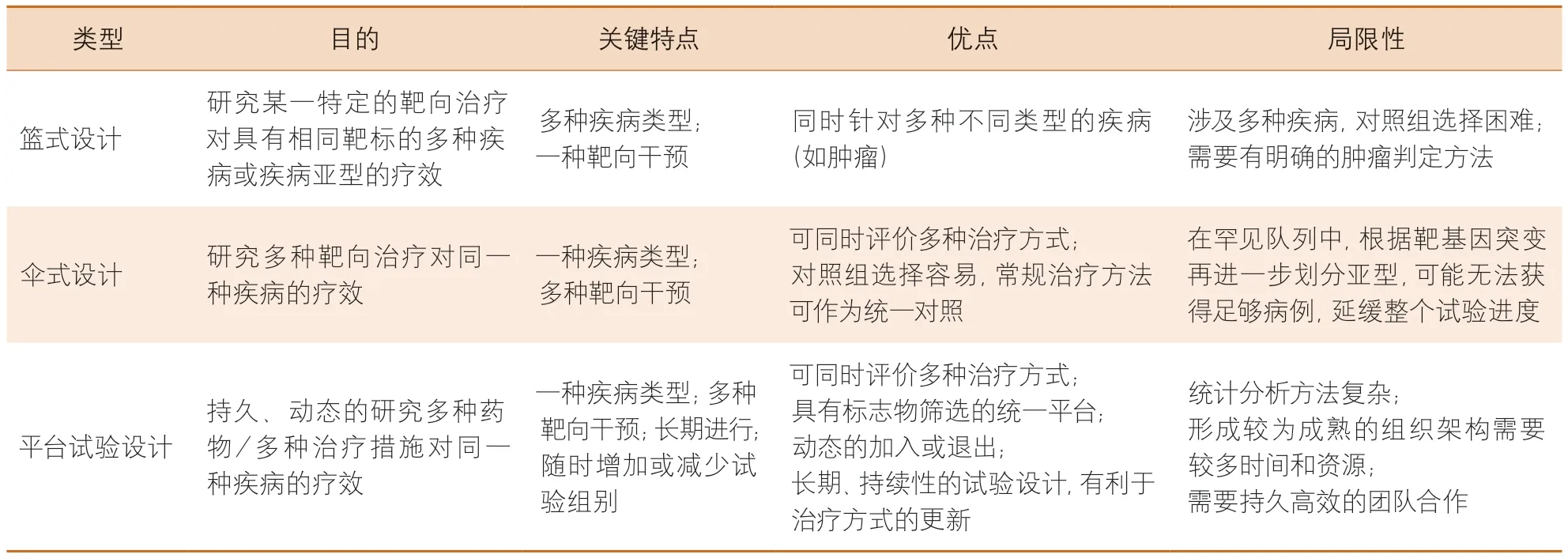
表1 篮式设计、伞式设计和平台试验设计的特点
4 平台试验设计中需要考虑的重要问题
平台试验设计具有共享性和灵活性的特点,被越来越多地应用在大规模临床研究中[10-12]。在平台试验的准备阶段,研究人员需考虑以下几个问题(表2)[8]。
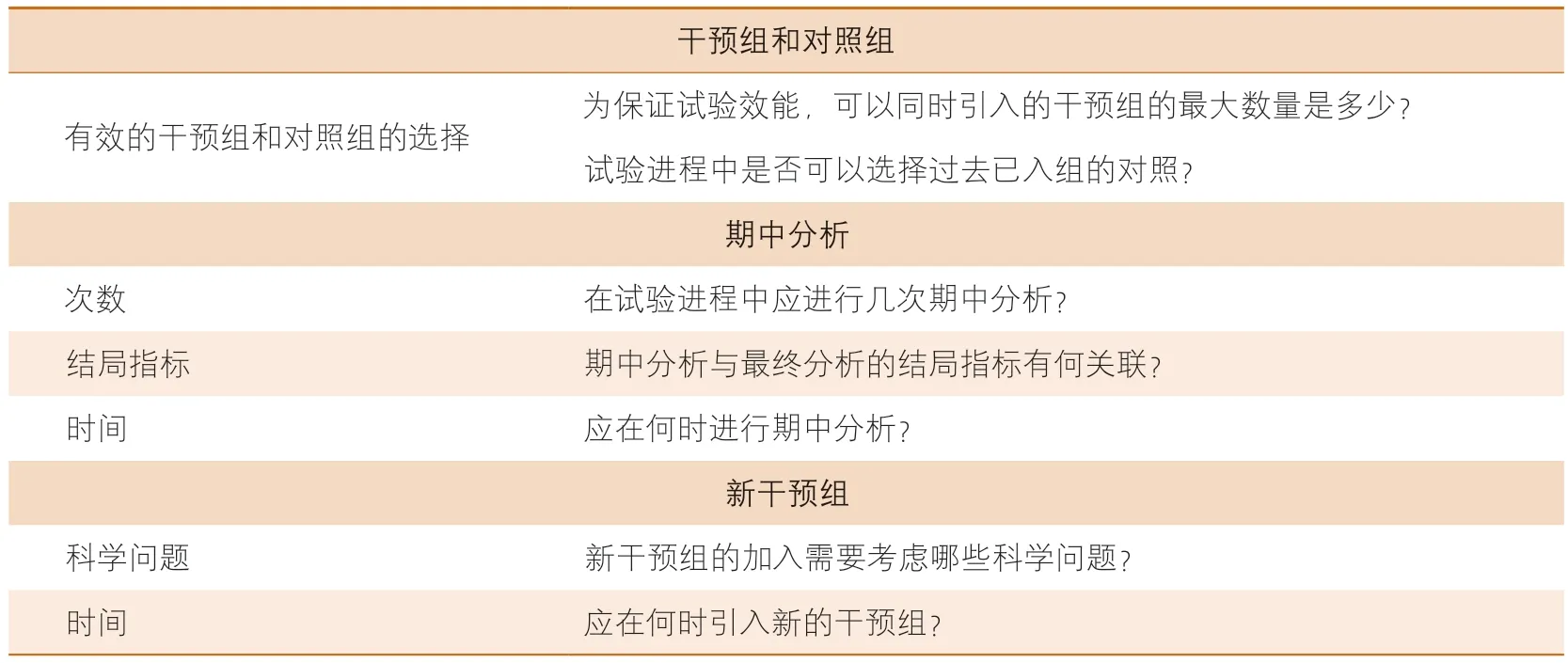
表2 平台试验设计中需要考虑的重要问题
①为保证试验效能,可以同时引入的干预组的最大数量是多少?
平台试验通常根据其可操作性和可行性预先确定最大干预臂的数量,随着招募的臂的数量增加,入组时间不断增加,数据管理和物资供应的压力也会逐渐增加[13-15]。
②试验进程中新加入的治疗组是否可以选择过去已入组的对照?
目前已有研究解释了对照组的时效性,当应用于临床的治疗方案或试验方案改变,可能影响对照组数据的准确性时,应更换为新的对照组;反之,如无足够证据证明对照组数据发生改变,则可使用已入组对照[8]。
③在试验进程中应进行几次期中分析?
平台试验允许早期终止某项干预,没有校正的期中分析可能终止有效的干预,增加了假阴性错误的风险;在部分平台试验中,某项干预达到原定的“成功”标准而终止,并未进行校正的期中分析,增加了假阳性错误的风险[16-17]。因此,对期中分析的次数进行适当的统计调整尤为重要。
④期中分析与最终分析的结局指标有何关联?
在期中分析时,结局指标应尽量与最终分析的主要结局相同,但在主要结局难以获得的情况下,可以使用更易测量的替代结局进行期中分析;此外,替代结局须与主要结局之间有着较强关联,不应使用无关的结局指标[8,18]。例如:在慢性淋巴细胞白血病的治疗方式研究中,期中分析结局可选择无进展生存期这一与主要结局(总生存期)高度相关的指标[19]。
⑤应在何时进行期中分析?
过早的进行期中分析易出现样本量不足引起的随机误差[16-17]。应综合多种因素决定适当的期中分析时间,如干预和随访的持续时间、入组数量和速度以及预期的治疗效果等[16]。
⑥新的干预组的加入需要考虑哪些科学问题?
干预组的引入需考虑预先制定的科学标准。在进展性或转移性前列腺癌的全身治疗:药物疗效评估(systemic therapy in advancing or metastatic prostate cancer:evaluation of drug efficacy,STAMPEDE)研究中规定,新的干预组引入时,应有证据表明其具有较强的生物学合理性和抗肿瘤活性[11]。在通过影像和分子分析预测治疗效果的系列研究调查2(investigation of serial studies to predict your therapeutic response with imaging and molecular analysis 2,I-SPY2)研究中,新的干预组应具有较强的生物学合理性,并有至少一项临床Ⅰ期试验表明其与紫杉烷类药物联用时具有安全性[12]。
⑦应在何时引入新的干预组?
在平台试验进程中,对照组随时间推移而更新,因此,适时引入新的干预组至关重要[8]。在STAMPEDE研究中,研究人员综合了前期试验结果和多项RCT的系统分析结果后,发现多西他赛改善了前列腺癌患者生存率,将多西他赛联合雄激素剥夺疗法替代原有雄激素剥夺疗法,作为前列腺癌的标准疗法[10,20-21]。
5 平台试验设计案例分析
评估新型冠状病毒(corona virus disease 2019,COVID-19)感染的多种靶向治疗方法疗效的COVID-19治疗随机评估(randomised evaluation of COVID-19 therapy,RECOVERY)研究[22],采用了大规模的随机对照临床试验设计,该平台试验旨在评估多种潜在有效的治疗方式,包括洛匹那韦/利托那韦、干扰素-β和小剂量皮质类固醇等对COVID-19的疗效。试验开展过程中随时加入其他待评估的治疗手段。符合条件的COVID-19感染患者在签署知情同意书后加入该平台,被随机分组后接受各组的特定治疗。试验的主要结局为28 d死亡,次要结局为候选药物对住院时间、通气需求及肾脏替代治疗的影响。该平台的各类治疗方式处于不断更新状态,当有证据表明存在潜在有效的治疗方式时,及时将其添加为新的干预组,当现有的或新的治疗手段确认有效或无效时,及时移除该干预组,并将有效的治疗方式替代常规治疗成为新的对照组。截至2022年5月,由于不同的药物引入或删除,此研究的版本已被更新至V25.0,图3展示了该试验重要版本的更新时间和内容[22]。目前,试验结果显示巴瑞替尼、地塞米松、单克隆抗体组合、托珠单抗可降低COVID-19感染住院患者的28 d死亡率。
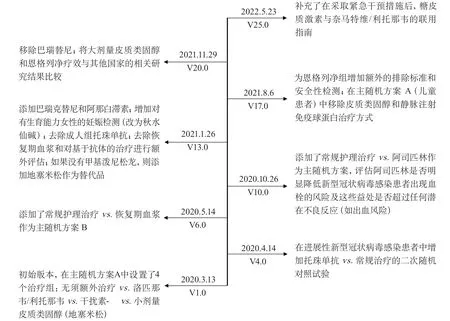
图3 新型冠状病毒感染治疗随机评估研究版本更新
平台试验设计针对单一疾病可同时评价多种药物,并可根据不同的药物疗效,动态地调整干预组。与传统的RCT相比,平台试验更加灵活和高效,加快了新药研发和开发标准治疗方案的进程。但同时,平台试验设计较为复杂,在持续的试验进程中需要消耗较多的时间和资源[23]。在后续的研究中,可进一步完善平台试验研究设计中面临的问题,提升其可操作性。平台试验设计有望在临床研究领域发挥更加重要的作用,为临床治疗方法的改进和患者受益做出积极贡献[24]。

