老年心力衰竭患者合并衰弱的最新研究进展
李晨,徐敏
(黄山市人民医院老年医学科,安徽 黄山 245000)
衰弱作为一种与增龄相关的老年综合征,在老年人群中比较常见。2021年国家统计局显示我国60岁及以上老年人已达2.64亿人,占18.7%。社会人口老龄化的问题越来越明显,而社会保障和医疗保健的负担更加沉重。衰弱是老年人心力衰竭(heart failure, HF)事件的危险因素[1],与慢性心力衰竭(chronic heart failure, CHF)患者的不良结局密切相关。早期识别衰弱,探索二者共同的病理生理学机制,有助于制定有效临床干预措施,完善综合管理制度,提高老年HF患者的综合生活质量。
1 衰弱的定义
2001年Fried等[2]针对美国社区老年人提出“脆弱状态”的概念被定义为衰弱,衰弱会导致机体发生跌倒、失能、谵妄、甚至死亡等不良结局,通常用五大标准,即为衰弱表型来衡量:无意识的体质量减轻、疲乏、行动迟缓、握力下降及低体力活动。衰弱的另一个定义将衰弱描述为生理储备的丧失,加上内分泌紊乱和免疫系统功能障碍,还涉及心理、社会功能等多维概念,是多方面健康缺陷累积的结果,即缺陷累积模型[3]。衰弱的定义尚无统一标准,尤其HF患者的衰弱。自上世纪60年代以来提出基于衰弱表型、缺陷累积模型这两个衰弱的基本概念。目前的定义更趋向于一种包含躯体、心理、社会等方面的动态的复杂临床综合征。
2 衰弱筛查和评估工具
基于衰弱表型、缺陷累积模型这两个衰弱的基本概念,衍生出许多衰弱筛查和评估工具,大部分工具操作繁琐,未在CHF患者中得到验证,也不常用于CHF患者的常规管理。HF患者的衰弱研究中常见评测工具主要包括基于衰弱表型的量表,如Fried衰弱表型,Frail量表;累积指数类工具,如衰弱指数(frailty index, FI),临床衰弱评估(clinical frailty scale, CFS);自我报告式问卷,如爱德蒙顿衰弱量表(Edmonton frail scale, EFS),Tilburg衰弱指数(Tilburg frailty indicator, TFI),格罗宁根衰弱指标(Groningen frailty indicator, GFI)。
基于衰弱表型量表的测试内容之一为体质量减轻,但CHF患者的体质量因水肿或者利尿剂的使用而失真,可能会导致衰弱漏诊,同时HF和衰弱的相关症状重叠难以区分,如乏力、疲乏等导致测试结果灵敏度和特异度有待考证,且仅考虑生理层面,未纳入心理、社会等因素,评估维度不够全面。Frail量表由国际老年营养和保健学会提出[4],评估方法较为简易,更适合快速临床筛查,因此在门诊、临床研究、养老机构中应用广泛,2022年老年人衰弱预防中国专家共识中使用此评估方法[5]。FI纳入包括躯体、功能、心理及社会等多维健康变量,能更好地评估衰弱程度的细微差异及预测临床预后,适用于流行病学研究中人群整体健康状况评估和预期寿命的计算,在临床研究、社区应用较为广泛,但由于评估的项目繁多、耗时较长、需要专业人员进行评估等缺陷,在临床上普及受限。
目前,CHF患者常见的衰弱筛查和评估工具详见表1。此表就主要内容、优缺点等相关细则进行了归纳总结。还需开发出相对简便的筛查和评估工具,可在常规临床环境中有效、快速地识别衰弱的CHF患者并进行综合评估,早期干预,以期改善CHF患者的功能状态、生活质量和长期临床结果。
3 HF合并衰弱患者的临床表现和预后
正如Fried等[2]所假设的理论,衰弱的循环是由与疾病和(或)衰老相关的肌肉质量和力量下降引发的,导致活动水平和步行速度降低,引起并进一步加剧体质量减轻和营养不良。衰弱、恶病质、疲乏和活动耐力下降相互交织,这些症状也可表现在HF患者上,因此HF和衰弱的相关症状存在大量重叠,老年HF患者合并衰弱会使这些症状更明显,如乏力、恶病质、活动缓慢、呼吸困难等,二者相互恶化、难以区分,不利于预后。老年CHF患者常常合并衰弱,衰弱会导致CHF患者入院率及死亡率增加[10-12],相关最新研究详见表2。衰弱是老年人HF事件的独立危险因素,与HF患者的不良结局密切相关,如跌倒风险增加、日常生活能力下降、生活质量下降、住院频率更高、死亡率更高等。值得注意的是,衰弱是一个动态可逆的过程,适当早期识别并干预衰弱可能在一定程度上改善HF患者的预后。
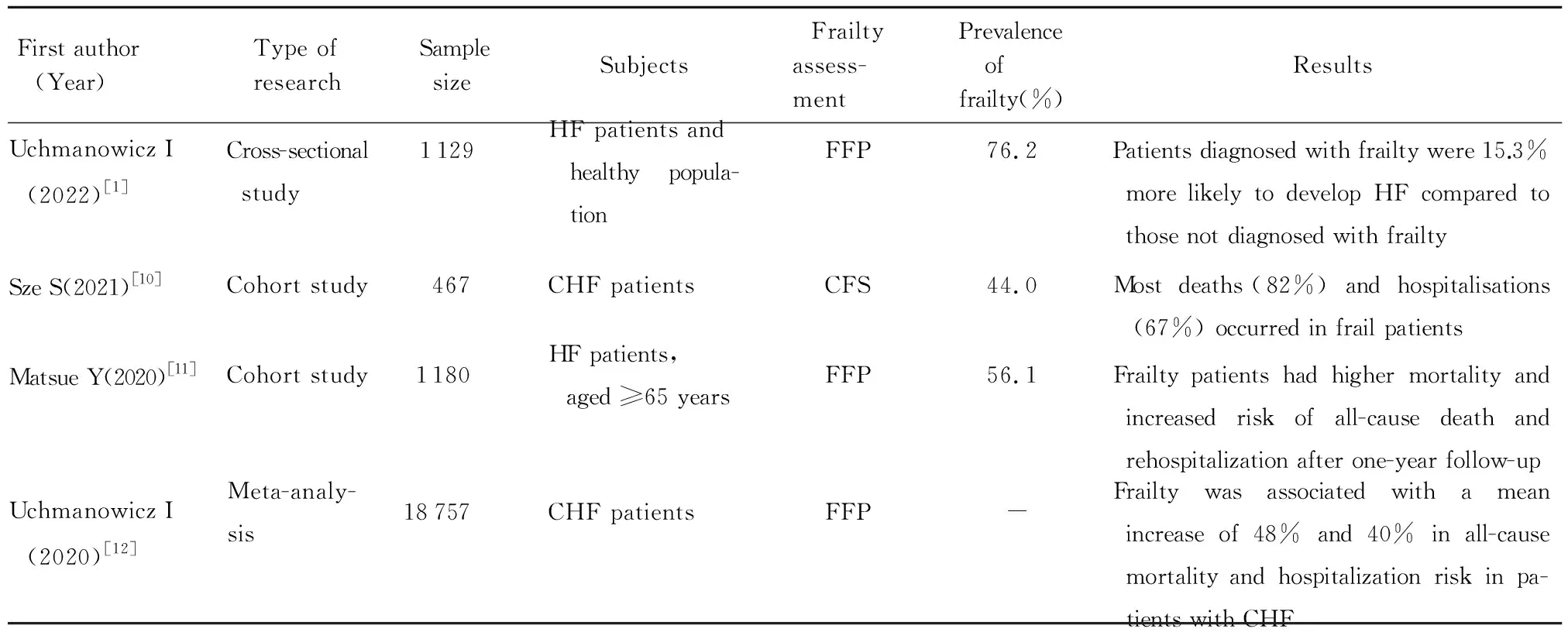
表2 衰弱在HF患者中的患病率及预后情况近期研究Table 2 Recent studies on prevalence and prognostic impact of frailty in patients with HF
4 共同的发病机制
虽然国内外研究者对衰弱与HF关系的认识显著提高,但这两者之间的确切病理生理联系尚未完全阐明。衰弱和CHF都存在多系统异常,二者通过各种复杂的致病机制相互恶化,例如神经-内分泌改变、代谢异常、免疫系统失调、炎性介质过度释放及肌肉系统功能障碍等[13,14]。
4.1 炎症起源
衰弱不具有年龄特异性,但可以确定的是,伴随年龄增加,衰弱和CHF的发生率显著上升[2]。衰弱和CHF可能存在某些炎症病理生理联系,例如细胞衰老、氧化应激增加、自噬减少、DNA损伤增加及线粒体功能障碍,这些都会破坏细胞稳态并导致细胞死亡。细胞死亡激活先天免疫系统以诱导炎症,而慢性炎症又会加剧细胞衰老及人体衰弱。
CHF患者的血流动力学改变诱导组织缺氧,从而导致细胞死亡和无菌炎症;肾素-血管紧张素-醛固酮系统(renin angiotensin aldosterone system, RASS)过度激活诱导先天免疫导致慢性炎症;HF导致肠道血管灌注不足或充血致肠道缺血,肠道细菌易位,加剧全身炎症反应。所以,CHF可能通过血流动力学改变、RASS激活以及肠道菌群易位加剧慢性炎症,从而造成衰弱的形成。而衰弱和CHF之间的关系又是双向的,衰弱通过上调促炎通路和降低抗压能力,致使CHF患者身体功能状态、认知障碍和生活质量更差。
4.2 内分泌及代谢障碍
多种激素分泌异常和胰岛素样生长因子-1(insulin-like growth factor-1, IGF-1)的信号轴失调导致的肌肉萎缩,与CHF和衰弱有关[15]。IGF-1能够增加肌细胞的产生,并抑制肌肉蛋白分解。研究表明,低水平IGF-1与老年人肌少症相关[16]。因此,低水平IGF-1通过肌少症成为衰弱与HF的可能共同机制。
此外,胰岛素抵抗和维生素D缺乏也在这两种疾病的发病机制中发挥作用[17,18],CHF中肌肉成分的加速变化以及与衰弱相关的促炎状态上调可导致代谢障碍,产生胰岛素抵抗。而胰岛素抵抗和维生素D缺乏又导致骨骼肌代谢异常,肌肉合成减少,加速了肌少症的发生。因此,胰岛素抵抗和维生素D缺乏可能是HF与衰弱产生关联的机制所在。
4.3 肌少症
肌少症的定义目前尚无统一共识,根据欧洲老年人肌肉减少症工作组的新定义,肌少症被定义为肌肉力量下降,其根源在于肌肉数量和质量的下降,通常与衰弱有关[19]。欧洲心脏病学会在2016年的指南中首次专门用一章来讨论恶病质和肌肉减少症,将其视为HF的重要合并症[20]。肌肉萎缩是老年HF患者活动耐力和通气效率低下的主要原因之一,造成生活质量下降和预后不良,而衰弱和HF的某些机制又会影响肌肉代谢,导致肌少症[21],这种相互交织的内在联系使肌少症、衰弱、CHF三者的关系更加复杂。最近,英国一项基于469830例参与者的研究表明,肌肉减少症与心血管疾病不良结果(全因死亡率、发病率和死亡率)有强关联[22]。
另外一些涉及肌肉萎缩的机制,如线粒体功能障碍、泛素-蛋白酶体系统的过度激活和异常的细胞自噬仍在研究中,可能是未来衰弱和HF治疗上的潜在方向。
5 临床干预策略
对老年人衰弱和CHF的系统干预策略应涵盖多领域内容,包括药物治疗、运动和身体康复、营养支持、共病管理等,以期提高患者的日常活动能力、生活质量和生存率。
5.1 饮食和营养支持
CHF患者胃肠道淤血导致的胃肠功能紊乱、劳力性呼吸困难、抑郁症等相关疾病,会影响进食,可能导致营养摄入受到限制。CHF患者营养缺乏和营养不良的风险增加,随之而来的可能是体质量减轻、衰弱和心脏恶病质。最近国内研究发现,营养不良使患者因HF加重入院风险增加2.451倍,是主要不良心血管事件发生的独立危险因素[23];国外研究证明营养不良导致CHF患者的预期寿命显著下降[24]。
对老年人衰弱和CHF的饮食干预可能涵盖了钠盐限制,饮食模式(既强调水果、蔬菜、谷物和豆类,又限制饱和脂肪酸),热量限制,脂肪和不饱和脂肪酸、蛋白质、氨基酸以及微量营养素的补充等方面[25]。国内外尚无统一的针对衰弱CHF患者的膳食计划,需要未来更多的研究证实。
5.2 运动与锻炼
运动与锻炼是提高老年人生活质量和功能有效的方法,阻力训练是一种基本运动干预措施,可以在类似衰弱状态的心脏康复模型中有效地实施,且被证明可以改善衰弱状态[26]。阻力训练增加骨骼肌质量、肌肉力量和耐力,改善血管功能,有利于心肺健康,提高生活质量[27]。中高强度的定期有氧运动训练可以改善心肺功能、调节血糖、减重、提高日常生活活动能力等,然而年老体弱的HF患者并不适宜单纯的有氧运动,由阻力、平衡和敏捷性训练及有氧运动组成的多维干预可能是最有效的方法[28]。
欧洲心脏病协会最新发表的心力衰竭运动指南推荐的运动方式包括耐力训练、高强度间歇运动、抗阻运动等[29],针对中国老年CHF住院患者的运动方案无统一共识,鼓励病情稳定的HF患者尽早主动运动,在不诱发症状的前提下从床边小坐开始逐渐增加有氧运动量。针对衰弱老年人的居家运动,更多推荐多元运动干预方案:平衡和柔韧性运动(双脚站立、足跟行走、直线行走、单腿站立和太极等)+有氧运动(健步走、爬山、游泳等)+抗阻训练(坐姿提踵、坐姿抬小腿、绷足尖运动、站姿提踵、站姿抬小腿及踮脚尖运动等),每次运动约45~60min,运动强度主观感觉运动稍费力为宜,运动频率3~5次/周。郭金花等[30]研究表明个体化多元运动干预能够改善住院老年患者的衰弱状态和躯体功能,值得临床推广。
5.3 自我管理和合理用药
加强自我保健意识,良好的治疗依从性,社区医院或门诊定期复诊,记录体质量、限制液体摄入、服用药物、定期锻炼等,所有这些活动都是HF患者自我管理的基本要素,特别是坚持用药,是治疗HF和预防再入院的关键。此外,身体衰弱评估及社会家庭支持可以更好地预测30d再入院和死亡风险[31]。老年人群多病共存,多重用药往往很常见。为避免过度使用多种药物及其潜在的不良后果,临床医师应仔细检查所用药物的适当性,尤其是在患有多种疾病和衰弱的患者中。在安全范围内减少不必要的药物,仅保留对控制临床症状至关重要的药物,有益于更好的药物依从性和满意的治疗结果。再者,多学科团队(老年科医师为主导,心血管内科、肾病内科、内分泌与代谢科、呼吸内科、神经与精神病科、药剂科、营养科等多学科医师共同参与)管理的模式,为患有合并症、需多种药物治疗和衰弱的老年CHF患者提供整体治疗方案,便于患者就诊,还能节省医疗成本,未来可能有更健全的推行模式值得期待。
6 小 结
综上,老年人群衰弱与CHF的双向关系可能基于炎症、内分泌与代谢障碍、肌少症等共同病理生理学机制,未来构建相关实验模型,完善基于衰弱和HF的老年综合评估和管理,有助于制定有效干预措施,提高老年人综合生活质量。建议对老年HF患者进行常规筛查和衰弱评估,启动有针对性的干预措施,以预防和最大限度地减少疾病并发症的发生。目前缺乏统一的HF患者衰弱评估工具和综合干预方案,期待未来在该领域深入研究。

