喉癌内皮细胞THBS1 的表达与临床意义
王嘉宁 沈志森 林晨 王嘉达 沈一鸣
喉癌是头颈部最为常见的恶性肿瘤之一,2007 至2017 年,我国喉癌发病率大幅增加[1]。2020 年全球有18 万例喉癌新发病例,其中10 万人死亡[2]。声门上型喉癌富含血管和淋巴管,早期可发生血行转移和淋巴转移,是造成不良预后的主要原因。内皮细胞既是构成血管和淋巴管通道的主要细胞成分,也是肿瘤微环境中重要的基质细胞,在肿瘤的进展和侵袭中发挥关键作用。内皮细胞可分泌血小板凝血酶蛋白(thrombospondin,THBS)家族成员之一的THBS1,有研究表明THBS1 与多种肿瘤的发生、发展密切相关[3]。Pal 等[4]发现在口腔鳞癌(oral squamous cell carcinoma,OSCC)肿瘤微环境中,肿瘤细胞可以诱导内皮细胞表达THBS1,THBS1 刺激肿瘤细胞的迁移和基质金属蛋白酶(matrix metalloproteinases,MMPs)的表达,从而促进口腔鳞癌的侵袭。本研究采用单细胞转录组测序对来自5 例声门上型喉癌患者的肿瘤组织、癌旁组织及转移淋巴结中的内皮细胞进行分群,挖掘其生物学功能,比较内皮细胞亚群组成差异,结合免疫组化染色研究THBS1 在喉癌内皮细胞中的表达,并探讨该因子在喉癌临床诊断及治疗中的潜在价值,现报道如下。
1 材料和方法
1.1 标本采集 采集2019 至2021 年在宁波市医疗中心李惠利医院接受手术治疗的3 例伴淋巴结转移的喉癌患者的术中新鲜标本,包括喉癌肿瘤组织、配对的癌旁组织、转移淋巴结,以及2 例无淋巴结转移喉癌患者的肿瘤组织。纳入标准:(1)经病理学检查证实为声门上型喉鳞状细胞癌;(2)患者为初次诊断,未进行放化疗;(3)所取癌旁组织远离肿瘤边界至少0.5 cm,且所取肿瘤组织、癌旁组织及转移淋巴结组织经病理检查证实。5 例患者的临床资料见表1。本研究经医院医学伦理委员会批准(批件号:KY2020PJ191),患者术前均签署知情同意书。

表1 5 例喉癌患者临床资料
1.2 方法
1.2.1 单细胞悬液制备、单细胞转录组测序 将新鲜的组织标本切碎,经PBS 洗涤2~3 次后保存于4 ℃保存液中,送至实验室。根据制造商指南使用人类肿瘤分离试剂盒(德国Miltenyi Biotec 公司, 批号:130-095-929)解离组织。随后通过细胞筛过滤及离心后获得单细胞悬液,去除红细胞及细胞碎片,细胞存活率>85%,符合上机要求。采用微流控系统进行细胞分选,裂解细胞后行逆转录和扩增,构成cDNA 文库,随后应用NoveSeq 6000 系统测序仪进行测序。
1.2.2 单细胞转录组测序数据预处理 利用Cell Ranger 软件处理原始数据,将测序输出的数据与人类参考基因组进行比对。将处理定量后的测序数据加载到R 包Seurat(版本:4.2.1),利用“scDblFinder”软件过滤双细胞数据,在质量控制过程中剔除线粒体、血细胞、核糖体等基因的干扰。数据过滤及质量控制标准包括:过滤掉基因表达<700 或>2 000,线粒体基因表达>20%的细胞。
1.2.3 细胞类型和亚型鉴定 为了纠正单细胞技术导致的样本间差异,采用SCTransform 算法进行数据标准化并计算表达值,随后运行Harmony 算法进行多样本批次矫正及数据整合。主成分分析(principal component analysis,PCA)对数据进行降维,最终确定25 个主成分,利用t-分布领域嵌入算法(t-distributed stochastic neighbor embedding,t-SNE)及统一流行逼近与投影(uniform manifold approximation and projection,UMAP)进行非线性降维及可视化。利用Seurat 中的Find-Neighbors 函数和FindClusters 函数以0.5 的分辨率聚类后可获得25 个细胞亚群,最后通过FindAllMarkers 函数计算各亚群特征基因,每个聚类的特征基因通过Wilcoxon 秩和检验,结合生物学背景知识人工鉴定各亚群类型。基于典型的内皮细胞标志物提取656个内皮细胞,对其进一步降维聚类后将内皮细胞分为4 簇。
1.2.4 基因本体论(gene ontology,GO)分析和京都基因和基因组百科全书(Kyoto encyclopedia of genes and genomics,KEGG)分析 利用“GOplot”包、“topGO”包、“enrichplot”包“circlize”包、“clusterProfiler”包,对内皮细胞亚群显著差异基因进行GO 功能注释和KEGG 富集分析,探索细胞亚群的主要功能,寻找富集的显著通路。
1.2.5 癌症基因组图谱(The Cancer Genome Atlas,TCGA)队列分析 从TCGA 数据库中下载123 例喉癌样本的基因表达数据和临床参数信息,其中肿瘤样本111 例,正常样本12 例,利用“Survival 包”对内皮细胞中高表达的差异基因进行Kaplan-Meier 生存分析。
1.2.6 免疫组化染色 40%甲醛溶液固定手术切除的喉癌及正常组织标本,石蜡包埋后切片,石蜡切片经过梯度乙醇及二甲苯脱蜡、脱苯后,乙二胺四乙酸抗原修复液中孵育20 min,进行高温高压抗原修复。3%过氧化氢阻断内源性过氧化物酶活性,3%牛血清白蛋白溶液进行血清封闭。分别滴加THBS1 抗体(美国Abcam 公司,批号:267388,1∶500)、FLT1 抗体(美国Abcam 公司,批号:32152,1∶50)和丝氨酸蛋白抑制剂E1(serine protease inhibitor clade E member 1,SERPINE1)抗体(美国Abcam 公司,批号:154591,1∶100),室温孵育1 h,PBS 漂洗3 次,滴加与一抗相应种属的二抗(1∶1 000),PBS 再次漂洗后用二氨基联苯胺(美国Sigma公司,批号:ZLI-9018)溶液显色,苏木素复染,脱水后封片。
2 结果
2.1 喉癌肿瘤微环境单细胞表达图谱 经过多重质量控制获得45 207 个高质量的单细胞纳入下一步分析,通过PCA 及t-SNE 得到25 个细胞簇,利用生物学知识对各簇细胞的标记基因进行注释,共鉴定出以下几种主要细胞类型:上皮细胞(epithelial cells)、内皮细胞(endothelial cells)、单核细胞(monocyte cells)、T 细胞(T cells)、CD8+T 细胞、自然杀伤性T 细胞(natural killer T cell,NK T)、B 细胞(B cells)、肥大细胞(mast cells)、树突状细胞(dendritic cells)、巨噬细胞(macrophage cells),成纤维细胞(fibroblasts cells),见图1(插页)。

图1 通过单细胞转录组测序分析喉癌组织的肿瘤微环境组成(A:喉癌样本收集及单细胞转录组测序工作流程;B:展示主要细胞类型的t-SNE 图)
2.2 内皮细胞亚群功能表征及组成分析 基于典型的内皮细胞标志基因PECAM1(CD31)、CDH5、ERG 等确定了656 个内皮细胞,对其进一步降维聚类后发现喉癌肿瘤微环境中主要包括血管内皮细胞(vascular endothelial cells,vECs)及淋巴管内皮细胞(lymphatic endothelial cells,lECs),vECs 根据其特征基因可分为以血管内皮生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR1/FLT1)为标志基因的血管内皮细胞(vECs-FLT1),特异高表达非典型趋化因子受体1(atypical chemokine receptor 1,ACKR1)的内皮细胞(vECs-ACKR1),及显著高表达G 蛋白信号转导调节蛋白5(regulator of G protein signaling 5,RGS5)的血管内皮细胞(vECs-RGS5)。淋巴管内皮细胞中CC 类趋化因子配体21(CC chemokine ligand 21,CCL21)显著上调(lECs-CCL21)。内皮细胞亚群丰度差异分析显示肿瘤组织中含量最丰富的内皮细胞为vECs-FLT1,其次为vECs-ACKR1,癌旁组织中含量最高的是vECs-ACKR1,其次是vECs-RGS5。vECs-FLT1 在肿瘤组织中的含量显著高于癌旁组织及转移淋巴结,提示富含FLT1 的vECs 可能是构成肿瘤供血血管的主要细胞成分。见图2(插页)。
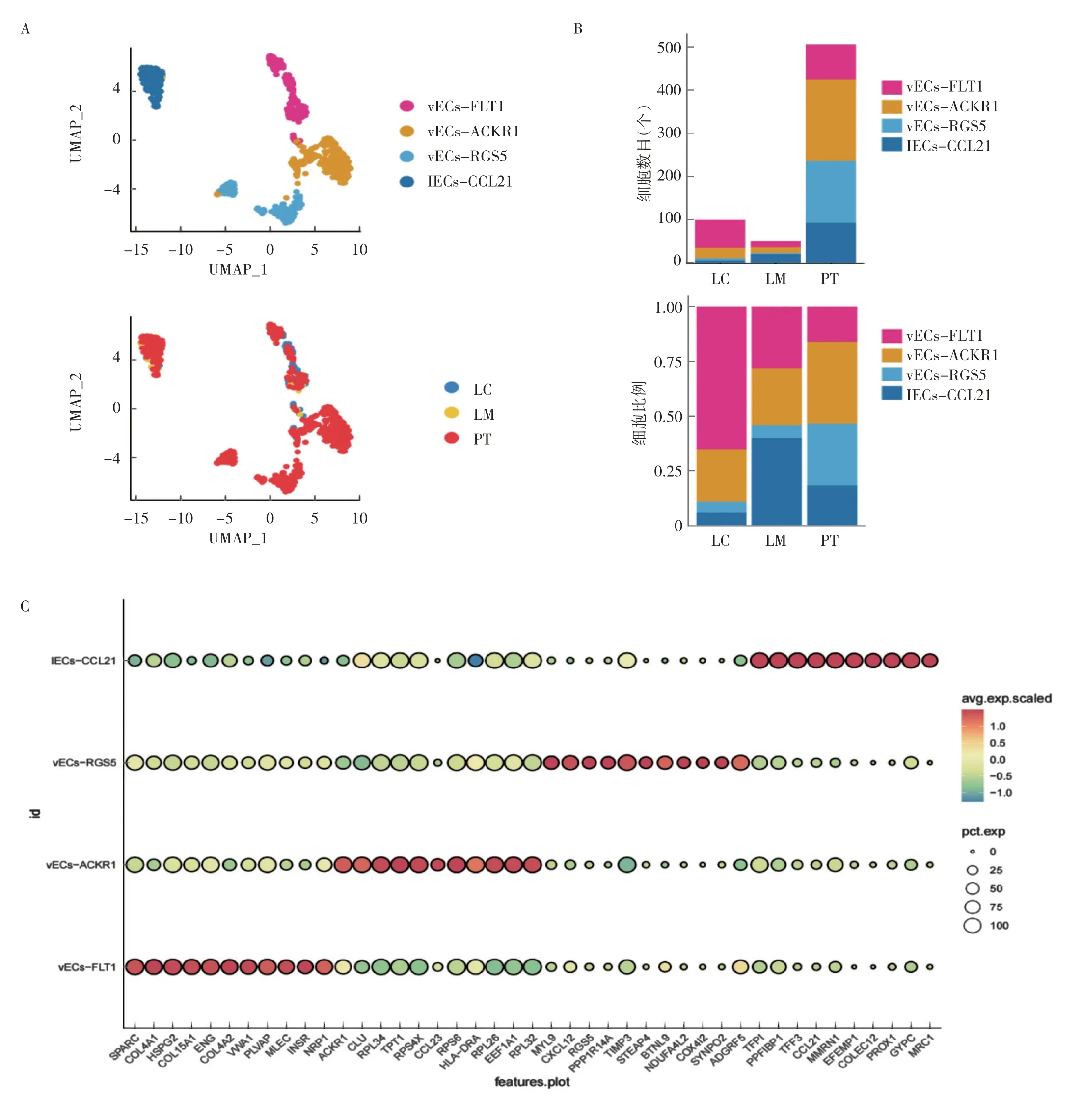
图2 单细胞转录组测序评估喉癌肿瘤微环境内皮细胞异质性(A:UMAP 图显示降维聚类后内皮细胞亚群及样本分布;B:内皮细胞各亚群在LC、LM、PT 中的丰度差异;C:气泡图示各内皮细胞亚型中差异基因表达)
2.3 GO 分析和KEGG 分析结果 GO 分析示vECs-FLT1 特征基因功能富集于“阿米巴样细胞迁移”、“调节血管新生”、“调节血管”以及“上皮细胞的迁移”。在细胞组分方面大部分过表达基因是细胞外基质中的胶原蛋白编码基因。在生物过程方面主要集中于“细胞外基质构成”,“生长因子的结合”及“整合素的结合”等。KEGG 示vECs-FLT1 中上调的基因主要与“磷脂酰肌醇3 激酶/丝氨酸-苏氨酸蛋白激酶(phosphatidylinositol 3 kinase/serine—threonine protein kinase,PI3K/Akt)信号通路”、“局灶黏附”及“HPV 病毒感染”等通路有关。通过富集基因与所在功能通路关系发现THBS1同时参与“血管新生”及“阿米巴样细胞迁移”。
vECs-ACKR1 亚群GO 富集分析及KEGG 富集分析示该亚群富含核糖体相关基因。vECs-RGS5 亚群GO 分析示大多数过表达基因功能主要富集于“阿米巴样细胞迁移”,“上皮细胞迁移”及“组织迁移”,在细胞组分方面主要富集于“细胞外基质胶原”、“局灶黏附”及“细胞底部连接”等,在生物过程方面主要集中于“肌动蛋白结合”,KEGG 主要富集于“肿瘤蛋白多糖”相关通路。lECs-CCL21 细胞GO 分析结果显示在生物过程方面主要集中于“伤口愈合”、“白细胞迁移”,在分子功能方面主要集中于“信号传导受体激活”、“配受体激活”等,KEGG 分析结果主要包括“趋化因子信号通路”、“局灶黏附”。
2.4 THBS1 及SERPINE1 表达水平与总体生存率的比较 对vECs-FLT1 中高表达的差异基因行生存分析发现THBS1 及SERPINE1 的表达水平与患者生存相关(P<0.05),喉癌组织中高表达THBS1 及SERPINE1 的患者具有更差的总生存率,见图3,这提示THBS1 和SERPINE1 高表达可能与喉癌不良预后相关。

图3 生存分析图显示喉癌组织中THBS1、SERPINE1 高表达组和低表达组患者总体生存率比较
2.5 免疫组化证实肿瘤血管内皮细胞高表达THBS1及FLT1 对手术切除的喉癌组织及配对的癌旁组织行免疫组化发现FLT1 在喉癌组织及血管内皮细胞中表达强阳性,为棕褐色,在正常组织中表达为阴性。THBS1 在肿瘤血管内皮细胞中阳性表达呈黄褐色,在正常组织中表达阴性。SERPINE1 在正常组织和肿瘤组织中表达均为阴性。
3 讨论
近年来,尽管以手术为主,结合放化疗、免疫治疗的综合治疗在一定程度上提高了喉癌患者的5 年生存率,但仍有40%的患者死于喉癌复发和转移[5]。且对于中晚期的患者,保守治疗难以达到预期效果,大多需要行部分喉切除术甚至全喉切除术,患者术后会出现长久性的声嘶甚至失声、吞咽功能紊乱、吸入性肺炎等术后并发症。术后生活质量受损及心理因素导致喉癌幸存者的自杀率居高不下[6]。因此发现新的靶向参与肿瘤微环境形成的分子和细胞迫在眉睫,从而优化现有的喉癌治疗方案,为耐药及无法应用PD-1/PD-L1 肿瘤免疫治疗的患者提供另一可能的选择。
早在1971 年,Folkman[7]开创性提出了“肿瘤血管新生”理论即肿瘤的浸润、生长、转移均依赖于肿瘤血管生成。基于该理论,临床发现了一系列抗血管靶向药物,在非小细胞肺癌等晚期实体肿瘤的临床应用中大获成功,作为抗肿瘤治疗靶点,在其他肿瘤的治疗中也显示出强大疗效。随着高通量测序技术的发展,临床得以从单个细胞的水平描述内皮细胞的异质性,发现内皮细胞绝非单纯的液体及细胞运输管道构成成分,其在肿瘤微环境中所发挥的作用非常复杂,一方面,部分血管内皮细胞因其物理屏障作用可防止脱落肿瘤细胞的转移,同时可通过对免疫细胞的招募和黏附参与抗肿瘤免疫的产生。另一方面,肿瘤内皮细胞通过形态学改变,分泌相关生长因子,上调血管生成相关基因等方式,主动或被动地参与肿瘤的内渗、转移、免疫耐受及免疫逃避[8]。不同生物学功能的肿瘤内皮细胞在肿瘤转移前微环境中具体构成比例、可塑性的调控方式、与微环境中其他细胞互作机制是新的研究热点。Kalucka 等[9]通过对小鼠不同组织来源的内皮细胞进行单细胞转录组测序分析发现来自不同血管床(动脉、毛细血管、静脉、淋巴管)的内皮细胞表现出跨组织的转录组相似性,组织类型而非血管类型决定了内皮细胞异质性。
本研究探讨内皮细胞在喉癌肿瘤微环境中的异质性及功能,基于临床5 例喉癌患者获得的喉癌组织、癌旁组织及转移淋巴结进行单细胞转录组测序,经过质控后获得45 207 个单细胞,通过内皮细胞标志基因筛选出内皮细胞后,对内皮细胞进一步的亚聚类分析发现喉癌组织中的内皮细胞存在4 种细胞亚型,分别为vECs-FLT1、vECs-ACKR1、vECs-RGS5 及lECs-CCL21。vECs-FLT1 显著表达特殊内皮“顶细胞”(tip cell)的 特 征 基 因FLT1 及 内 皮 联 蛋 白(endoglin,ENG)。FLT1 基因通过编码VEGFR1 参与VEGF 信号通路,ENG 被公认为肿瘤血管生成和新生血管形成的特异性标记,它是转化生长因子β(transforming growth factor β,TGF-β)家族蛋白质的辅助受体,在肿瘤微环境中,缺氧条件可刺激组织释放VEGF 和TGF-β,并激活邻近血管内皮细胞上的VEGF 和TGF-β 等信号通路,被激活的内皮细胞可随着VEGF 的浓度梯度迁移,向外增殖延伸发育成新的血管[10],由此可推测vECs-FLT 细胞参与血管出芽。在vECs-FLT1 中还可观测到胶原亚基编码基因COL4A1、COL15A1、COL4A2 以及硫酸肝素蛋白多糖2(heparan sulfate proteoglycan 2,HSPG2)的过表达。HSPG2 编码的蛋白广泛存在于血管基膜,肝脏及软骨,参与肿瘤血管的形成[11]。此外质膜小泡相关蛋白(plasmalemma vesicle-associated protein,PLVAP)也在该亚群中上调,已有研究证明PLVAP 与基底血管通透性内皮膜的形成和维持有关,PLVAP 高表达可能在肿瘤细胞的侵袭及转移中发挥作用[12]。ACKR1 为典型的静脉标志物,局限表达于小静脉内皮细胞,参与白细胞的招募[13],提示vECs-ACKR1 参与构筑肿瘤小静脉。
周细胞参与构成血管结构的完整性。RGS-5 被确认为血管周细胞的标志基因,可在癌前病变中被特异性诱导,在肿瘤血管中进一步升高,参与血管重塑[14]。此外vECs-RGS5 高表达趋化因子C-X-C 基序配体(CX-C motif chemokine ligand,CXCL)12 基因,Su 等[15]的研究发现CXCL12 作为细胞趋化因子存在于前列腺癌等上皮癌的细胞间质中,通过CXCR4 和CXCR7 受体进行信号传导,参与激活肿瘤细胞生长和侵袭。
lECs-CCL21 高表达淋巴管内皮细胞标记基因Prospero 相关同源异形盒蛋白1(prospero homeobox 1,PROX1)和CCL21。淋巴管内皮细胞周围可形成CCL21浓度梯度,调节树突状细胞和T细胞等免疫细胞的淋巴迁移及淋巴结归巢,参与免疫耐受及肿瘤转移[16]。
vECs-FLT1 主要来源于肿瘤组织,提示该亚型可能是肿瘤血管的主要构成成分,结合对该亚型的GO分析及KEGG 分析示该亚型功能富集于“阿米巴样细胞迁移”、“血管新生”及“细胞迁移”,“阿米巴样细胞迁移”是肿瘤细胞侵入和穿出血管的主要运动模式[17],综上所述该亚群主要功能可能与促进瘤生长、局部浸润及远处转移有关。通过对vECs-FLT1 差异表达基因绘制生存曲线发现高表达SERPINE1 及THBS1 的喉癌患者具有更差的预后,免疫组化染色验证了喉癌组织中FLT1 肿瘤血管内皮的存在,且肿瘤血管内皮中THBS1 为阳性表达,提示内皮细胞可能通过分泌THBS1参与肿瘤进展。
THBS1 在肿瘤微环境中的水平取决于肿瘤和基质细胞的表达,它是一个大分子三聚体糖蛋白,具有复杂的结构域和功能域,每个特定的结构域和功能域与不同种类的细胞因子结合可以发挥不同的生物学效应[18]。THBS1 既可以通过与内皮细胞膜上的白细胞分化抗原36、整合素相关蛋白相互作用抑制内皮细胞迁移并促进细胞凋亡,进而抑制血管生成[19],也可与黏多糖结合,促进肿瘤细胞与内皮细胞的黏附和侵袭,THBS1 与转化生长因子相互作用时可通过刺激血管生成而促进肿瘤生长和转移[3]。因此THBS1 在肿瘤进展中起到矛盾而至关重要的作用,其在肿瘤预测及靶向治疗上可能有广阔的应用前景,但THBS1 在喉癌中发挥的功能及其对肿瘤的调控机制尚未完全明确,仍需进一步研究证实。
综上所述,本研究利用单细胞转录组测序成功揭示喉癌内皮细胞的异质性,THBS1 表达情况可以作为辅助区分肿瘤内皮细胞与非肿瘤内皮细胞的参考依据。THBS1 不仅可以作为喉癌不良临床预后的独立预测因子,也可能为喉癌的治疗提供了一个新的方向与思路,但THBS1 发挥作用的具体调控机制需要进一步的研究。

