PLGA 纳米微球的制备条件优化
董亚尊,柳凯月,陈晶,吴双双,马金柱
(黑龙江八一农垦大学生命科学与技术学院,大庆 163319)
在现代医疗中,由于药物自身的性质不够稳定,进入机体后它们在血液中半衰期较短,血药浓度易出现峰谷现象[1],从而导致治疗效果不够理想,通常需要多次用药才能治愈,造成了大量的医药资源浪费。通过改变药物的剂型设计可以在一定程度上缓解这种现象,常见的胶囊和片剂用药效果依旧不够理想,因此近年来新开发出了多种药物载体,包括脂质体、合成聚合物胶束、凝胶、磁性纳米颗粒、微球和微囊等用于疾病的诊断和治疗[2-3],然而脂质体载体的稳定性太差,其他载体构建的成本太高或者是载药量太低,亦或是对于疏水性药物的缓释不可控[4],也有一些材料因其本身的毒性和不可降解性也限制了它们作为药物载体的应用。
理想的载体应该是安全、稳定、高效、有良好的靶向性和生物利用度的[5],PLGA 作为一种可生物降解高分子材料,它在体内经过水解产生代谢物单体乳酸和乙醇酸,这两种单体均是内源性的,很容易通过三羧酸循环途径被生物体代谢,将其用于药物载体系统毒性非常小[6],已被美国食品和药物管理局批准用于人类治疗,因此在纳米药物医学领域大放光彩。除此之外,PLGA 的生物降解速率是可控的,它主要是取决于其结构中的乙交酯与丙交酯的单体数目比例,乙交酯的单体比例越低,PLGA 的降解时间就越长,反之亦然[7]。使用PLGA 包封药物,可以防止药物经过消化道时被降解[8],使药物能够从肠道进入血液,提高其体内的生物利用度并延长半衰期,进而提高药物吸收率[9-10],非常适合药物和生物大分子的持续细胞内递送[11]。
PLGA 用作载体的有效尺寸范围为1 到1 000 nm[12],在不同的制备条件下,PLGA 纳米微球具有不同的粒径、多分散指数和形态特征,这些特性是确保药物稳定性、包封性和充分释放的基础[13]。因此,实验对PLGA纳米微球的制备条件进行了优化,以便获得理想的纳米微球,为微球载体后续的深入应用打下基础。
1 材料与方法
1.1 材料
聚乳酸羟基乙酸共聚物购买自济南岱罡生物工程有限公司,聚乙烯醇购买自阿拉丁药物试剂公司,二氯甲烷购买自天津基准化学试剂有限公司。
1.2 PLGA 纳米微球的制备方法
实验采用双溶剂乳化法制备PLGA 纳米微球,首先将120 mg PLGA 颗粒溶于6 mL 的二氯甲烷中,避光使其充分溶解。然后称量0.4 g PVA 干粉试剂倒入小烧杯并加入超纯水,放入水浴锅中在70 ℃下搅拌溶解,后定容至40 mL 后冷却至室温等待使用。随后将PLGA 溶液在冰浴环境中放入细胞破碎仪,以30 W 功率4 s 超声开关间隔超声乳化1 min。吸取初步乳化液2 mL 逐滴加入PVA 溶液中,将混合溶液以相同条件二次超声乳化,之后将形成的微球悬液用磁力搅拌器以600 rpm·min-1过夜搅拌,使二氯甲烷充分挥发。第二天将微球悬液在4 000 g 条件下离心5 min,弃掉上清,重悬PLGA 纳米微球进行洗涤和离心,反复3 次,末次离心后用微量的超纯水重悬PLGA 纳米微球,在-70 ℃下冷冻2 h 后放入低温干燥冷冻机中,经过24 h 冷冻干燥后,收集PLGA 纳米微球干粉进行后续表征检测,表征检测包括粒径大小、粒径分布和zeta 电位等。
1.3 不同乳化剂浓度对PLGA 纳米微球表征的影响
PLGA 纳米微球的制备方与2.2 中相同,将乳化剂PVA 的浓度分别设置为1%、2%、3%、4%和5% 共5 个浓度梯度进行单因素控制变量实验,探究不同的PVA 浓度对PLGA 纳米微球的表征的影响。
1.4 不同超声功率对PLGA 纳米微球表征的影响
PLGA 纳米微球的制备方与2.2 中相同,将超声功率分别设置为30、45、60、75 和90 W 共5 个功率梯度进行单因素控制变量实验,探究不同的超声乳化功率对PLGA 纳米微球的表征的影响。
1.5 不同超声时间对PLGA 纳米微球表征的影响
PLGA 纳米微球的制备方与2.2 中相同,将超声时间分别设置为1、2、3、4 和5 min 共5 个时间梯度进行单因素控制变量实验,探究不同的超声乳化时间对PLGA 纳米微球的表征的影响。
1.6 优化条件下的PLGA 纳米微球制备
对微球制备的最优乳化剂浓度、超声时间和超声功率进行确定后,将各个最优条件进行汇总联合,以此条件来制备PLGA 纳米微球,并对微球进行形态表征。
1.7 统计与分析
实验得到的数据均以平均值±SD 表示,并采用GraphPad Prism 8.0 进行显著性分析,其中“*”表示P<0.05,“**”表示P<0.01,“***”表示P<0.001。
2 结果与分析
2.1 乳化剂浓度的确定
在不改变其他变量的条件下,分别用1%、2%、3%、4%和5%的PVA 浓度制备PLGA 纳米微球,并依次对各组纳米微球进行形态表征,结果如图1 所示,随着PVA 浓度的增大,各组纳米微球的平均粒径和PDI 指数均呈现出先减小后增大的趋势,且以2%的PVA 浓度制备出的PLGA 纳米微球有最小的平均粒径和PDI 指数,平均粒径约为750 nm,PDI 指数约为0.19,与其余各组有显著差异,表明这组微球的粒径大小更为均一,形态分布上更加集中。再对比各组微球的zeta 电位,发现以5% PVA 浓度制备出的PLGA 纳米微球zeta 电位绝对值最高,约为31.5,与其余各组有显著差异。综合比较上述结果,优先考虑平均粒径与PDI 指数的影响,确定了以2% PVA 浓度来制备PLGA 纳米微球。

图1 不同乳化剂浓度条件下制备出的PLGA 纳米微球Fig.1 PLGA nanospheres prepared under different emulsifier concentrations
2.2 超声功率的确定
在不改变其他变量的条件下,分别用30、45、60、75 和90 W 的超声功率制备PLGA 纳米微球,并对各组纳米微球进行形态表征,结果如图2 所示,随着超声功率的增大,各组纳米微球的平均粒径和PDI 指数均呈现出先减小后增大的趋势,以75 W 超声功率条件下制备的纳米微球平均粒径更小,与其余各组有显著差异,而60 W 微球组的平均粒径要略小于45 W 微球组,但未呈现出差异性。对比分析各组微球的PDI 指数,以60 W 超声功率制备出的PLGA 纳米微球PDI 指数更低,约为0.263,表明该组微球的粒径大小更为均一,形态分布上更加集中,与其余各组有显著差异。最后分析zeta 电位的测定结果,发现以45 W 超声功率制备出的PLGA 纳米微球zeta 电位绝对值最高,约为19.10,与其余各组有显著差异。综合比较上述结果,优先考虑平均粒径与PDI 指数的影响,确定了以60 W 超声功率来制备PLGA 纳米微球。
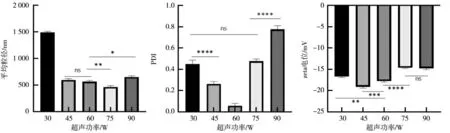
图2 不同超声功率条件下制备出的PLGA 纳米微球Fig.2 PLGA nanospheres prepared under different ultrasonic power conditions
2.3 超声时间的确定
在不改变其他变量的条件下,分别用1、2、3、4和5 min 的超声时间制备PLGA 纳米微球,并依次对各组纳米微球进行形态表征,结果如图3 所示,随着超声时间的增加,纳米微球的平均粒径和PDI 指数呈现出先减小后增大的趋势,且以4 min 超声时间制备的纳米微球有最小的平均粒径和PDI 指数,平均粒径约为441.5 nm,PDI 指数约为0.272,与其余各组有显著差异,表明该组微球的粒径大小更为均一,形态分布上更加集中。最后分析zeta 电位的测定结果,发现各微球组的zeta 电位随着超声时间的延长表现为先降低后升高,其中以2 min 超声时间制备出的PLGA 纳米微球zeta 电位绝对值最高,约为22.03,与其余各组有显著差异。综合比较上述结果,优先考虑平均粒径与PDI 指数的影响,确定了以4 min 超声时间来制备PLGA 纳米微球。
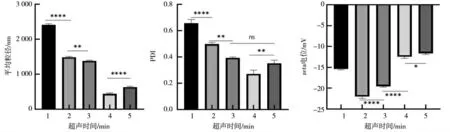
图3 不同超声时间条件下制备出的PLGA 纳米微球Fig.3 PLGA nanospheres prepared under different ultrasonic time
2.4 优化条件下的PLGA 纳米微球制备
将上述的制备条件联合,制备出PLGA 纳米微球并对其进行表征,结果如图4 所示,2% PVA 浓度下,用60 W 超声功率进行4 min 超声,所得到的纳米微球平均粒径为332.2 nm,软件评估PDI 指数为0.114,而zeta 电位的绝对值为19.1,从平均粒径到微球的均一性,都优于单变量条件优化下制备的纳米微球。扫描电镜的结果如图5 所示,从图5A 中,可以看出没有经过条件优化制备的微球粒径较大,形态大小不一,粒径分布较宽;从图5B 中,可以看出经过条件优化后制备的微球粒径要比前者小,形态上更加均一,粒径分布较窄,表明PLGA 纳米微球的制备条件优化是比较成功的。
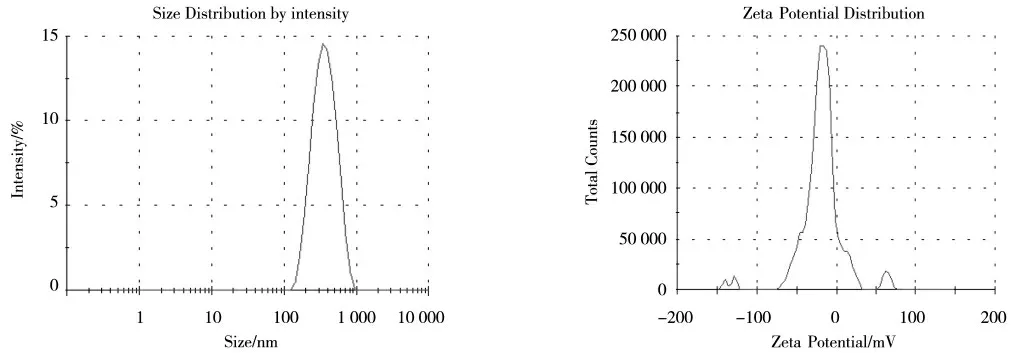
图4 最优条件下制备出的PLGA 纳米微球Fig.4 PLGA nanospheres prepared under optimal condition
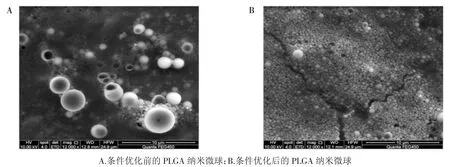
图5 PLGA 纳米微球的扫描电镜图片Fig.5 Scanning electron microscope image of PLGA nanospheres
3 讨论
实验中使用的是双溶剂乳化法制备PLGA 纳米微球,技术的主要优点在于技术相对简单易操作,成本较低,因而被人们广泛使用。但制备出的微球可重复性差,粒径分布宽,形态可调整性较小,作为载体包封率低[14],且不适用于大批量制备纳米微球,要达到理想的使用条件,需要进行大量的重复实验来摸索出最佳的微球制备条件,因此存在一定的局限性。随着人们对纳米微球载体的研究不断深入,已经有越来越多的新型制备方法被开发出来,其中包括:超临界流体乳化法、喷雾干燥法、水凝胶模板法、微流体法及膜乳化法等。和双溶剂乳化法相比,微流体法将材料的溶液流体通过固定的微管,可以获得窄尺寸分布且粒径控制精准的微球,同时还能极大提高对药物的包封率和负载率[15-16]。另外在微球制备前,PLGA 需要选择适当的溶剂进行溶解后才能进行乳化,在实验中,用的是二氯甲烷作溶剂进行溶解,除此之外还可以选择氯仿或乙酸乙酯等作为溶剂,然而上述的溶剂都是有较强毒性的,对人体有巨大的危害,目前报导出的无毒替代物种类较少且效果不佳,因此寻求高效的无毒替代物就成了日后亟待解决的问题。
PLGA 纳米微球作为一种非常便捷的药物载体,它的形态特征、大小和PDI 都是控制药物释放动力学的重要因素,在相关的文献中已经有相应的数学模型能够通过评估粒子的形态和尺寸参数来预测药物的释放动力学[17]。由于PLGA 聚合物链末端存在羧基,所以PLGA 纳米微球zeta 电位常为负值[18]。然而有研究表明,表面带有正电荷的纳米微球会更容易被细胞所摄取,而且会诱导更多的T 淋巴细胞增殖和细胞因子分泌[19-20]。因此为了达到更好的治疗效果,将PLGA 用带有正电荷的材料进行修饰,在正负电荷间的中和作用下,可以极大减少PLGA 纳米微球zeta 电位的负值[21]。在实验过程中还发现,制备的纳米微球在扫描电镜下观察,有些微球表面孔隙很多,有的微球表面接近于光滑,这可能是由外界气温变化,致使二氯甲烷挥发速度不同导致的。在去除有机溶剂过程中聚合物的沉淀速率会对微球的形态产生影响,缓慢消除有机溶剂利于微球缓慢沉淀从而形成光滑的表面,相反如果溶剂被快速去除则微球形成多孔表面[22]。Wang 等[23]研究发现溶剂的挥发性越低则形成的微球孔径就越大,而溶剂的挥发性越高则形成的微球孔径就越小。微球孔隙与药物输送的关系紧密,多孔性微球具有更大的表面积和更低的密度,能够使药物得到较快的释放[24]。因此,在实验过程中应严格保持在一个稳定的实验环境,这样会更有利于获得理想的纳米微球。
实验中选择的乳化剂为PVA,且选择改变其浓度来优化PLGA 纳米微球的制备条件,是因为微球的粒径大小与乳化剂的种类及其浓度有关。Noviendri等[25]通过实验比较了聚乙烯醇(PVA)、吐温20(Tween 20)、斯潘20(Span 20)和十二烷基硫酸钠(SDS)4 种乳化剂对微球粒径的影响。结果表明,使用PVA 作乳化剂可以制备出最小粒径的微球,而使用SDS 作乳化剂制备出的微球粒径最大。而微球粒径的大小与所选择的治疗途径关系紧密,例如对于心肌内应用,适宜的粒径大小约为5~8 μm,而对于吸入剂或亲代颗粒适宜的粒径约为1~5 μm。Hernández 等[26]研究了单一乳化法和纳米共沉淀法制备PLGA 纳米粒子的不同,分析了聚合物及乳化剂浓度、有机溶剂含量、超声波幅度和注射速度(纳米沉淀)对最终结果的影响,总结出聚合物的组成和浓度影响纳米粒子的物理化学性质(粒径、PDI 和zeta 电位),有机溶剂主要控制微球颗粒的尺寸,而PLGA 和PVA 的浓度则影响纳米共沉淀剂的效果。
PLGA 纳米微球是理想的药物载体,可极简单的通过单体组成、分子量和端基功能化来修饰达到调控降解时间和靶向性的目的,此外它还可以用来搭载多种类型的负载物,能适用于制药、食品等多个工业领域,在应用上有很强的塑造性。在食品领域,Zhu等[27]将具有广谱抗菌性的麝香草酚用PLGA 进行包封,极大地延缓了麝香草酚的挥发,将其应用在牛奶样品中作抗菌保添加鲜剂,后样品经过检测分析证明该保鲜剂对金黄色葡萄球菌和大肠杆菌有很强的拮抗作用,研究结果为食品保鲜行业的发展带来了新思路。而在靶向治疗肿瘤方面,Ruoslahti 等[28]用PLGA 负载紫杉醇(PTX),将表面用与肿瘤生长有关的神经通透性蛋白(NRP)作靶向分子进行修饰,对小鼠肿瘤模型进行治疗,与未修饰的PLGA 微球相比,修饰过的PLGA 微球治疗小鼠的存活率提高了1.6 倍,这一结果为肿瘤治疗发展提供了重要的参考价值。
到目前为止,只有少数几类以纳米载体为基础的药物被批准用于临床,因此未来的研究重点在于完成实验室成果到临床应用的转化,这需要制药公司、科学家和临床医生等多方的密切合作。基于近年来的制备工艺不断进步以及大量相关研究的出现,相信作为药物载体的纳米粒子将彻底改变医疗领域的局面,在不久的将来,基于纳米微球的疗法会更加智能和个性化,有望进行临床应用。
4 结论
实验通过探究不同乳化剂浓度、超声时间和超声功率对微球表征结果的影响,确定了微球制备的优化条件为2% PVA 浓度下,以60 W 功率超声4 min,此时获得的PLGA 纳米微球最理想,这一结果为下一步用PLGA 纳米微球包封相关抗原抗金黄色葡萄球菌感染的研究奠定了基础。

