高效GFPuv荧光筛选基因编辑载体的改造及其在马铃薯遗传转化中的应用
杜静雅,陈凯园,普金,周会英,祝光涛,张春芝,杜慧
高效GFPuv荧光筛选基因编辑载体的改造及其在马铃薯遗传转化中的应用
杜静雅1,2,陈凯园2,普金2,周会英3,祝光涛3,张春芝2,杜慧
1河南大学生命科学学院,河南开封 475004;2中国农业科学院农业基因组研究所,广东深圳 518000;3云南师范大学马铃薯科学研究院,昆明 650500
【目的】转基因技术的发展离不开筛选标记的完善与创新,其中的可视化筛选标记在转基因中的应用越来越广泛。近年来,经过突变获得的增强型黄绿荧光蛋白(an enhanced Yellow Green Fluorescent like Protein(eYGFP) under ultraviolet (UV),eYGFPuv(GFPuv))在365 nm紫外光线下能够发出强烈且稳定的绿色荧光,便于观察。构建GFPuv荧光筛选的基因编辑载体,并在马铃薯遗传转化中进行应用验证,为GFPuv荧光筛选在马铃薯转化中广泛应用提供技术支持,同时为后期利用基因组编辑技术创制马铃薯雄性不育系奠定基础。【方法】利用同源重组技术将GFPuv表达框架和基因编辑元件Cas9_sgRNA依次与pCAMBIA2300载体连接,并进行农杆菌介导的烟草瞬时转化试验;通过发根农杆菌Ar qual和MSU440转化马铃薯茎段,在便携紫外灯下观察,并统计荧光根;利用改造载体构建了6个马铃薯花药发育保守基因的编辑载体,通过发根农杆菌体系转化2种马铃薯材料,验证转化效率和编辑效率;利用改造载体对马铃薯进行遗传转化。【结果】成功构建了GFPuv荧光筛选的基因编辑载体pCAMBIA2300MGFPuv-sgRNACas,瞬时转化烟草证实GFPuv表达框架能正常表达;2种发根农杆菌的转化均筛选到绿色荧光的毛状根,加入卡那霉素(kanamycin,Kan)显著提高阳性荧光根的比例,2种菌的转化效率差异不大,但MSU440的发根形成速度更快;6个马铃薯花药发育保守基因的编辑载体在2种马铃薯材料中的转化效率和编辑效率是一致的,但不同靶位点的编辑效率差异较大;改造载体遗传转化马铃薯证实GFPuv荧光可用于马铃薯愈伤组织和再生苗的筛选。【结论】发根农杆菌遗传转化体系是基因编辑效率验证的重要途径,GFPuv荧光可用于马铃薯转化的筛选。
马铃薯;GFPuv;基因组编辑;毛状根;遗传转化
0 引言
【研究意义】随着转基因技术的快速发展和完善,人们已成功培育出许多植物新品种,并取得了巨大的经济和社会效益。这些植物新品种通常经过农杆菌介导法或基因枪转化法进行目标性状的改良而获得。然而,与生物体自身存在的正常细胞相比,遗传转化获得的转化细胞在生物组织中通常占比较小,竞争力也较弱。因此,必须借助合适的标记将转化细胞筛选出来,最终获得阳性转化株系。【前人研究进展】目前,使用的筛选标记有很多,主要分为抗生素抗性基因筛选[1]、除草剂抗性基因筛选[2]和可视化的报告基因筛选等。其中,可视化报告基因让看不见摸不着的遗传转化变得清晰可见,并且大大减少了转基因植株筛选的工作量,可以在低成本的前提下显著提高遗传转化的筛选效率。常见的可视化报告基因有β-葡萄糖苷酸酶(β-glucuronidase,GUS)基因[3-4]、荧光素酶(luciferase,LUC)基因[5]、红色荧光蛋白(the red fluorescent protein identified insp.,DsRed)基因[6]和绿色荧光蛋白(green fluorescent protein,GFP)基因[7]等。其中,和报告基因需要借助化学试剂进行显色观察,对植物组织损害是不可逆的,很难在组织培养过程中进行观察筛选;而DsRed和GFP可以借助荧光显微镜进行观察,不会破坏植物样品,但所需的荧光显微镜价格比较昂贵,且难以在整体植株水平上进行观察。2017年,日本科学家将源自的类黄色GFP蛋白(yellow green fluorescent like protein,YGFP)进行突变,鉴定到一种在365 nm紫外光下具有很强荧光的eYGFPuv(下文简称GFPuv),该蛋白比YGFP的荧光强度增加24倍[8]。随后,该团队将GFPuv遗传转化矮牵牛,获得了具有强烈、稳定绿色荧光的转基因植株,该植株在紫外光下裸眼即可观察,不需要高灵敏度成像设备或特殊成像条件;同时,转基因植株经紫外光照射而不受损伤,发出的荧光也不会衰减[9]。因此,认为GFPuv用作转基因的可视化标记,将会比GFP有更好的前景。马铃薯营养全面,种植周期短、产量高,同时适应性强,是世界第三大粮食作物。目前,大多数栽培马铃薯是同源四倍体,基因组高度复杂,育种周期长,同时以块茎进行繁殖,存在繁殖系数低、易携带病虫害等问题[10]。为了彻底解决马铃薯生产中的这些问题,国内外科学家开展了以种子进行繁殖的二倍体马铃薯育种工作,并取得了突破性的进展[11-13]。然而,马铃薯杂交制种需要耗费大量的人力物力,同时还存在去雄不完全造成种子混杂的问题。如果能够选育出马铃薯雄性不育系,将彻底解决杂交制种的去雄问题,降低种子生产成本。目前,马铃薯育性相关研究报道还较少,拟南芥、水稻和玉米中的研究较多[14-15]。它们花药发育的遗传调控网络也比较明晰,具有类似的花药发育时期,其中一些关键调控基因在不同物种也非常保守[16]。因此,可以借鉴这些物种的研究结果,开展马铃薯育性相关的研究。【本研究切入点】虽然已经有不少四倍体和二倍体马铃薯材料建立了成熟的转基因体系[17-20],但在转基因筛选中还经常存在嵌合体,增加了后期检测的工作量,尤其是基因编辑株系的检测。实验室前期使用的pKSE402基因编辑载体采用GFP进行阳性株系筛选,但GFP荧光在马铃薯阳性株系的地上部分中很难观察到荧光,只有部分根中能观察到微弱的荧光,对转基因株系的筛选效果较差。【拟解决的关键问题】本研究使用pCAMBIA2300作为载体骨架改造了一个高效GFPuv荧光筛选的基因编辑载体;同时,选取一些花药发育的保守基因,通过序列比对找到马铃薯中的同源基因,分别设计它们的靶位点,利用改造的编辑载体在马铃薯发根体系中验证基因组编辑的效率;最后将改造的编辑载体遗传转化马铃薯,验证GFPuv在马铃薯转基因中的筛选效果,为GFPuv荧光筛选在马铃薯转化中广泛应用提供技术支持,同时为后期利用基因组编辑技术创制马铃薯雄性不育系奠定基础。
1 材料与方法
1.1 材料
所用二倍体马铃薯材料PG6359和二倍体马铃薯自交系A056的无菌苗由中国农业科学院农业基因组研究所杂交马铃薯育种课题组保存;载体改造所用的框架载体pCAMBIA2300同样由本课题组保存,pKSE402和pCBC_DT1T2由中国农业大学陈其军老师提供,GFPuv表达框架由金斯瑞生物科技股份有限公司合成后连入pUC57载体;感受态细胞DH5α、GV3101、Ar qual和MSU440购买自上海唯地生物技术有限公司。
1.2 载体改造与构建
1.2.1 GFPuv荧光筛选基因编辑载体的构建 首先,以原始载体pCAMBIA2300为模板,使用引物CZ1扩增载体全长序列(表1),进一步使用诺唯赞ClonExpress Ⅱ One Step Cloning Kit克隆试剂盒(C112-01)进行重组连接,通过挑取单克隆和一代测序获得Ⅰ酶切位点突变的载体pCAMBIA2300M。其次,利用Ⅺ对pCAMBIA2300M载体进行单酶切,然后使用引物CZ2从pUC57载体上扩增合成的GFPuv表达框架35Sp-GFPuv-HSPT878,进一步使用ClonExpressⅡOne Step Cloning Kit克隆试剂盒进行重组连接,并通过对单克隆进行测序获得pCAMBIA2300MGFPuv。最后,以pKSE402载体为模板,利用引物CZ3扩增Cas9表达框和sgRNA表达框,同时使用HⅠ和Ⅰ对pCAMBIA2300MGFPuv进行双酶切,最后利用ClonExpressⅡOne Step Cloning Kit克隆试剂盒进行重组连接,获得pCAMBIA2300MGFPuv-sgRNACas载体。

表1 载体构建引物名称和序列
小写加粗的碱基是同源重组接头序列,下划线的碱基是靶位点或其互补序列
The bases in bold and lowercase are homologous recombination splice sequences, and the underlined bases are target sites or their complementary sequences
1.2.2 雄性不育系列基因编辑载体的构建 根据Jiang等[16]研究报告,选择拟南芥、水稻和玉米花药发育中的保守基因、、、和,以它们的氨基酸序列进行同源比对,在马铃薯基因组中找到其对应的同源基因、、、、和(其中,在马铃薯中找到2个相似度比较高的基因,依次编号为和)。利用CRISPRdirect在线分析网站(https://crispr.dbcls.jp/)分别对这6个基因进行sgRNA设计,以DM6.1为参考基因组,每个基因设计2个靶点;将设计好的第一个靶点替换DT1F(5′- tcgaagtagtgattgGTTTTAGAGCTAGAAATAGC-3′)中的N,将第二个靶点反向互补替换DT2R(5′-ttctagctctaaaacCAATCTCTTAGTCGACTCTAC-3′)中的N,具体的引物序列见表1。分别使用上述设计的重组引物StAMSCZ、StDYT1CZ、StMS1aCZ、StMS1bCZ、StMYB80CZ和StTDF1CZ,以pCBC- DT1T2中间载体为模板进行片段扩增;同时,使用Ⅰ酶切pCAMBIA2300MGFPuv-sgRNACas基因编辑载体,最后利用ClonExpressⅡOne Step Cloning Kit克隆试剂盒进行将上述扩增片段重组到编辑载体中,构建6个马铃薯雄性不育保守基因的双靶编辑载体。
1.3 烟草瞬时转化
将上述构建好的pCAMBIA2300MGFPuv-sgRNACas载体热激转化农杆菌GV3101,挑取单克隆至5 ml含有卡那霉素(kanamycin,Kan)和利福平(rifampicin,Rif)的LB液体培养基中,28 ℃ 220 r/min过夜培养。当OD600达到0.6—0.8时,4 000 r/min离心10 min收集菌体,用瞬时转化液(1/2 MS溶液含10 mmol·L-1MES,200 μmol·L-1AS)重悬菌体,使最终OD600值为0.5,室温放置3 h。使用去除针头的1 ml注射器通过指压法在本氏烟草叶片的背面注射上述菌液。暗培养36 h后,在365 nm便携式紫外灯下检测烟草叶片的GFPuv荧光信号。
1.4 马铃薯毛状根转化
首先将构建好的载体转化发根农杆菌MSU440或Ar qual,提取单克隆于含有Kan的LB液体培养基进行培养,并进行甘油保菌,于-80 ℃保存。在进行遗传转化前,取出菌株进行划线活化,然后挑取部分菌落于含有Kan的LB液体培养基中进行过夜培养;当OD600达到0.6—0.8时,离心收集菌体,再用MS30液体培养基稀释至OD600为0.5,加入AS至终浓度为40 mg·L-1。选取培养4—5周的马铃薯无菌苗,切出适量0.5—1 cm的茎段,用侵染液常温侵染10 min;侵染完成之后在无菌滤纸上晾干茎段,将茎段转移至铺有无菌滤纸的MS30固体培养基上,25 ℃暗培养48 h。将暗培养结束的茎段转到含相应抗性和200 mg·L-1特美汀(Timentin,TMT)的MS30培养基上进行生根培养,每个培养皿摆放约20个茎段。培养20 d后,可以观察到大量毛状根长出,统计每皿放置的茎段数和毛状根数目,同时,将培养皿放置在紫外灯下观察统计荧光根的数目,并取一些荧光根放置在离心管中用于后续检测。
1.5 马铃薯遗传转化
参考叶明旺等[19]二倍体马铃薯遗传转化方法,取4周苗龄的PG6359无菌苗,切取不带腋芽的茎段,摆放于A1预培养基,光照培养48 h。将上述pCAMBIA2300MGFPuv-sgRNACas转化GV3101的菌株进行活化和摇菌,侵染液制备参考上述毛状根遗传转化步骤,将预培养结束后的茎段置于侵染液中10—15 min,期间不断摇晃;去除侵染液并用无菌滤纸吸干茎段表面的菌液,将茎段转至铺了一张无菌滤纸的A2共培养基,25 ℃暗培养48 h。暗培养结束后的茎段置于分化培养基(shoot inducing medium 2,SIM2)上继续培养,每两周更换一次SIM2培养基,当愈伤组织分化出芽时,将芽剪下移至生根培养基(root inducing medium,RIM)中。
1.6 马铃薯荧光根和阳性株系的分子鉴定
在紫外灯下挑出的荧光根单独放在1.5 ml EP管中,采用TPS(提取液包含Tris-HCl、Potassium Chloride(KCl)和EDTA 3种组分)法提取基因组DNA。为了进一步确定T-DNA是否插入到马铃薯基因组上,使用Cas-sgRNA区域的特异引物U626-IDF1(5′-TGTCCCAGGATTAGAATGATTAGGC-3′)和Cas9-35S-R(5′-GCTCCACCATGTTGACCTGC-3′)进行PCR,反应体系为6.0 μL 2×Rapid Taq Master Mix、1.0 μL 10 μmol·L-1引物、2 μL基因组DNA和3 μL ddH2O。反应条件为94 ℃ 5 min;94 ℃ 15 s,58 ℃ 20 s,72 ℃ 1 min,35个循环;72 ℃ 5 min,16 ℃ 5 min。PCR产物经1%琼脂糖凝胶电泳后拍照。
根据每个基因的靶点位置在两端设计靶位点检测引物(表2)。PCR体系和程序如上所述,取5 μL进行琼脂糖凝胶电泳检测。根据电泳结果,选出没有大片段的缺失的样品,将对应的靶点扩增产物稀释200倍,参考Hi-TOM测序流程设计每个靶基因对应的Hi-TOM测序引物(表2)[21],进行二次扩增,PCR体系和程序同上,同样取5 μL进行琼脂糖凝胶电泳检测,剩余样品每个取5 μL,每6个样品混合成1管,每个靶基因编辑的2种材料PG6359和A056分别混6管。将混合好的样品装在96孔PCR板,送交中国农业科学院水稻研究所进行Hi-TOM测序,每个样品的测序深度是2 000×,根据参考序列分析每个样品的突变类型,并将所有变异类型的比例合并,计算出每个靶点在不同材料中的平均突变率。
表2 靶点检测引物
小写加粗的碱基是Hi-TOM测序的通用接头引物
The bases in bold and lowercase are the universal connector primer of Hi-TOM sequencing
通过生根和荧光筛选,获得的转基因株系同样采用TPS法提取基因组DNA,使用GFPuv-F(5′-GAG TTGGTTGGAGGTGGAGTTGG-3′)和GFPuv-R(5′- GAGTCTCTTCAACCCTTCTATGTG-3′)进行PCR,具体PCR体系和程序同上述发根检测。
2 结果
2.1 GFPuv荧光筛选的基因编辑载体改造
为了构建一个可以通过GFPuv荧光进行转基因筛选的基因编辑载体,选择pCAMBIA2300为骨架载体(图1-A)。通过PCR扩增和无缝克隆获得Ⅰ酶切位点突变的载体pCAMBIA2300M(图1-B)。利用无缝克隆技术将GFPuv表达框架35Sp-GFPuv- HSPT878与pCAMBIA2300M载体连接,获得载体pCAMBIA2300MGFPuv(图1-C)。最后,同时扩增pKSE402载体的Cas9表达框和sgRNA表达框,使用无缝克隆技术与pCAMBIA2300MGFPuv载体连接,获得可用于GFPuv荧光筛选的基因编辑载体pCAMBIA2300MGFPuv-sgRNACas(图1-D)。为了确认GFPuv表达框是否可以正常使用,将pCAMBIA2300MGFPuv-sgRNACas载体转化农杆菌GV3101,通过瞬时注射转化本氏烟草叶片,可以在紫外光下清晰地观察到荧光(图1-E—F)。因此,认为所构载体pCAMBIA2300MGFPuv-sgRNACas的GFPuv表达框能正常表达,可用于植物遗传转化的荧光筛选。
2.2 不同发根农杆菌发根效率的比较
为了确认所构建载体是否可以正常侵染马铃薯,采用试验周期较短的发根农杆菌转化体系进行验证。Butler等[22]在进行马铃薯发根再生研究时发现不同发根农杆菌的转化效率存在较大差异。因此,将空载体pCAMBIA2300MGFPuv-sgRNACas分别转化实验室常用的2种发根农杆菌Ar qual和MSU440进行发根转化效率的比较。同时,为了确定Kan筛选是否会提高转化效率,将2种发根农杆菌侵染过的A056茎段分别转移至加入50 mg·L-1Kan和不加Kan的MS30培养基进行光照培养,每种处理120个左右的茎段,分别放置在6个培养皿上。MSU440菌株侵染的茎段于7 d左右在愈伤组织处产生毛状根,Ar qual菌株在12 d开始有毛状根出现,20 d左右2个菌株产生的毛状根可以布满整个培养皿(图2-A),在黑暗和荧光灯下可以看到部分毛状根发出绿色荧光(图2-B)。统计发现,在同种类型培养基上,不同菌株侵染的茎段所产生荧光根的数目没有明显差异(图2-C),并且不同菌株产生的荧光根占总根数的比例也无差异(图2-D),但加入Kan可以显著提高每个茎段产生荧光根的数目和荧光根在毛状根中的比例。因此,认为MSU440和Ar qual诱导马铃薯产生毛状根的效率差异不明显,但加入Kan筛选可以显著提高阳性荧光根产生的比率。此外,MSU440诱导毛状根产生更快一些,因此,后续将使用MSU440进行下一步研究。
2.3 GFPuv荧光筛选编辑载体在马铃薯毛状根中编辑效率的验证
为了验证所构载体pCAMBIA2300MGFPuv- sgRNACas在不同材料中的转化效率和编辑效率,利用马铃薯毛状根转化体系对马铃薯中6个花药发育相关基因、、、、和进行编辑。每个基因设计2个靶点,分别构建它们的双靶编辑载体pCAMBIA2300MGFPuv- sgRNACas-StAMS、pCAMBIA2300MGFPuv-sgRNACas- StDYT1、pCAMBIA2300MGFPuv-sgRNACas-StMS1a、pCAMBIA2300MGFPuv-sgRNACas-StMS1b、pCAMBIA2300MGFPuv-sgRNACas-StMYB80和pCAMBIA2300MGFPuv-sgRNACas-StTDF1;将这些载体分别转化发根农杆菌MSU440,并转化纯合二倍体自交系A056和杂合二倍体材料PG6359,每个基因分别转化2种材料各100个左右的茎段,放置在含50 mg·L-1Kan的MS30培养基上进行光照培养,20 d后进行毛状根的观察统计(图3-A)。除了,其余5个编辑载体转化A056和PG6359产生荧光根的效率基本一致;同时发现所有6个编辑载体在2种材料产生的毛状根中荧光根的占比也无明显差异(图3-B)。表明相同GFPuv荧光筛选编辑载体在2种类型材料中的转化效率差异不大。
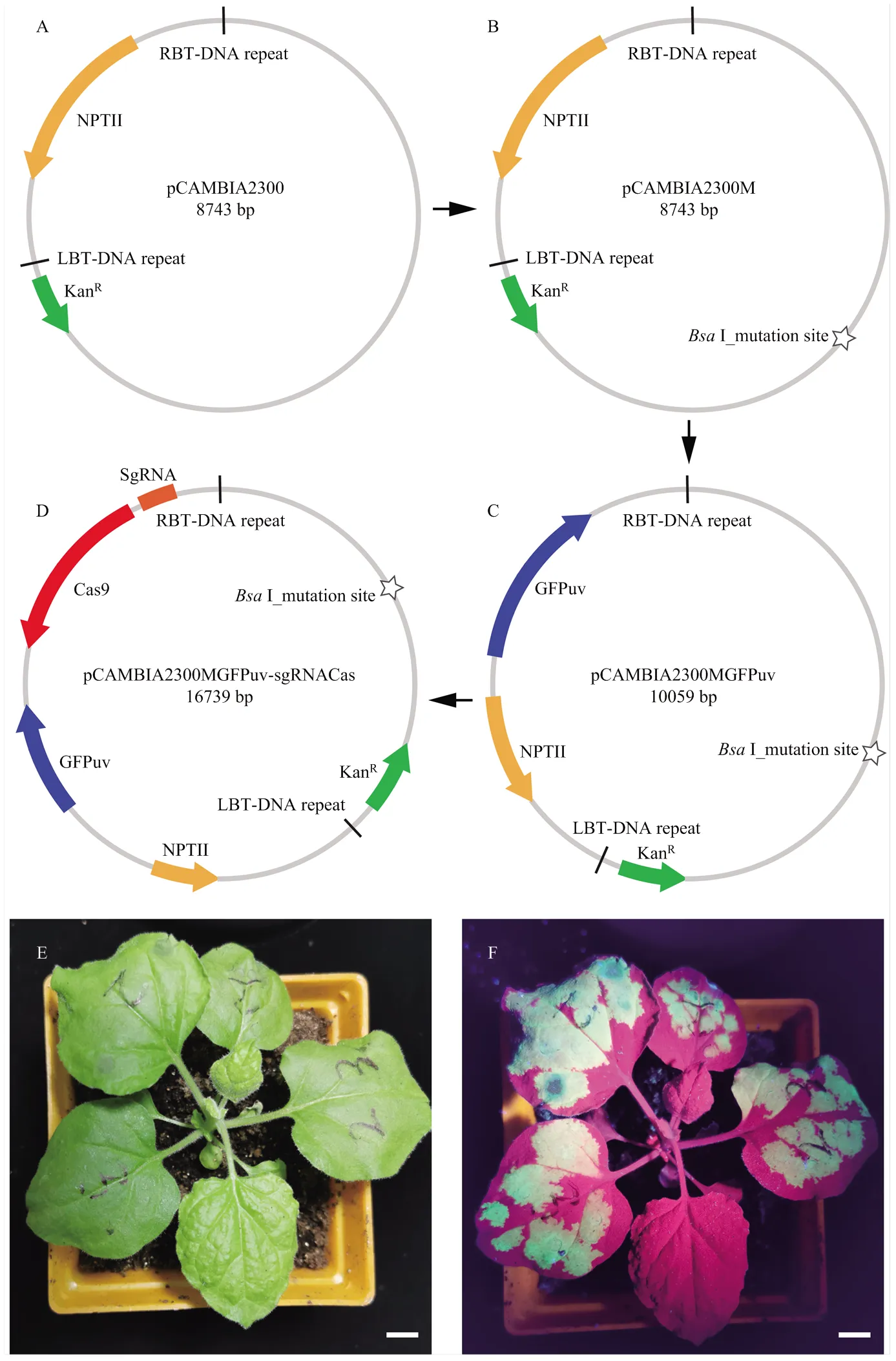
A:pCAMBIA2300原始载体示意图;B:pCAMBIA2300M是pCAMBIA2300突变BsaⅠ酶切位点后的载体示意图;C:pCAMBIA2300MGFPuv是pCAMBIA2300M加入GFPuv表达框架示意图;D:pCAMBIA2300MGFPuv-sgRNACas是pCAMBIA2300MGFPuv加上Cas9和sgRNA的示意图;E和F是瞬时转化的烟草植株,其中,E是明场下照片,F是黑暗条件在便携紫外灯下的照片,比例尺是1 cm
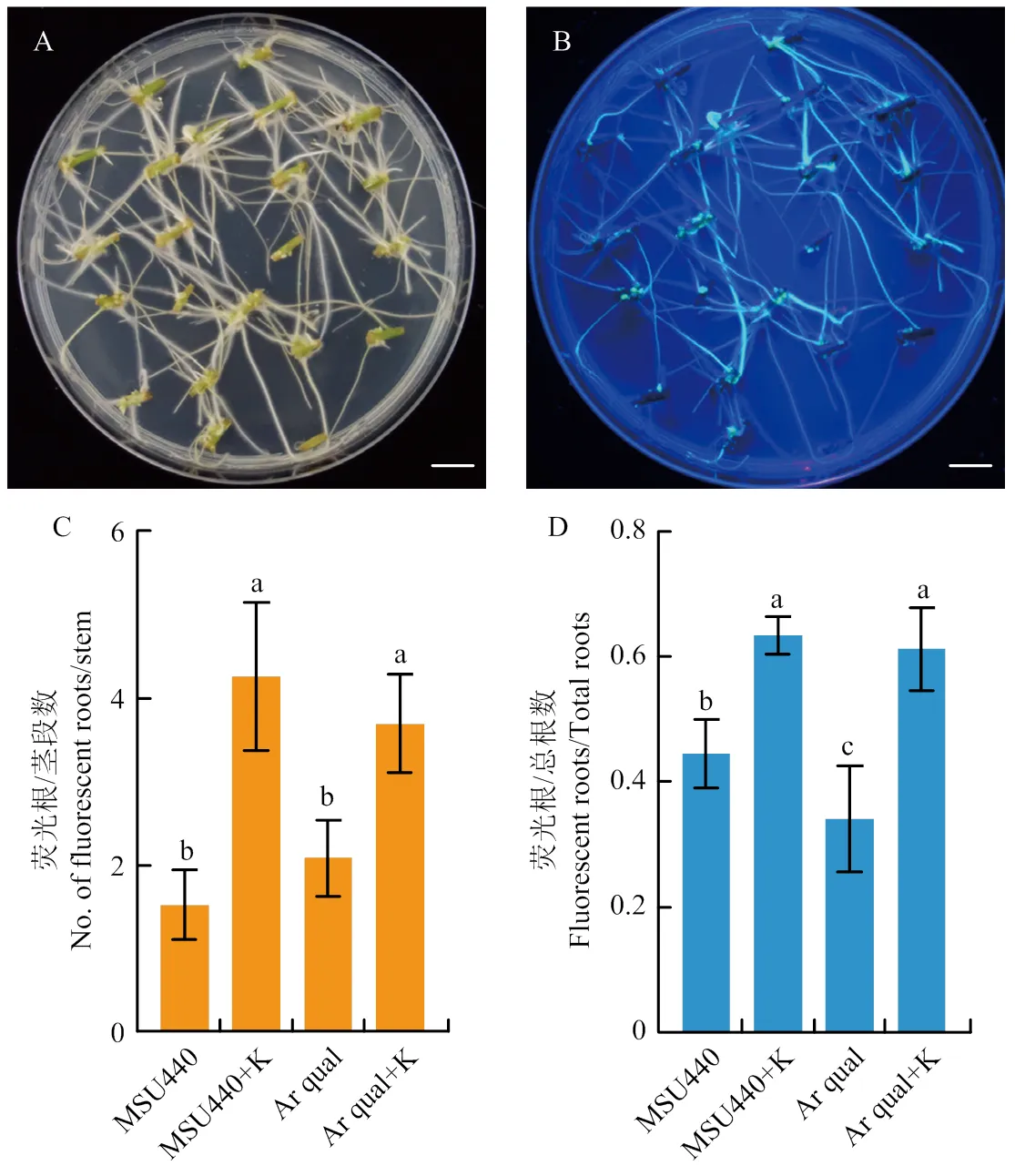
A和B是马铃薯茎段产生毛状根的照片,A是明场下照片,B是黑暗条件在便携紫外灯下的照片,比例尺是1 cm;MSU440和Ar qual在不加和加入50 mg·L-1 Kan条件下,每个茎段产生荧光根的数目(C)和荧光根占产生的总毛状根的比例(D);试验重复7次,误差线代表生物学重复之间的标准差,误差线顶部的小写字母代表图基多重比较所得的显著差异(P<0.05)
为了确认这些编辑载体在毛状根中的编辑效率,分别从每个载体转化的2种材料中随机选取48条荧光根提取基因组DNA。首先使用载体Cas9-sgRNA区域的特异引物进行扩增,发现所有荧光根均能扩出条带,表明紫外灯下筛选出来的荧光根均为阳性。进一步使用每个靶基因对应的靶点检测引物扩增靶向区域,电泳结果显示,部分荧光根出现大片段缺失,但每个靶基因的大片段缺失的数目并不相同(图4和表3)。初步表明,每个靶基因的2个靶点均可进行编辑,但编辑效率存在差异。最后,挑选出没有大片段缺失株系,使用包含Hi-TOM接头的靶点扩增引物进行二次扩增,并进行混合测序和突变分析。结果显示,大部分靶点均可以发生编辑,并且存在多种变异类型,但大部分变异是缺失突变(deletion),缺失长度为1—45 bp,插入突变的长度主要是1 bp(图5)。统计每个靶点的平均突变率发现,不同靶点的突变率差异较大,但相同靶点在A056和PG6359中的突变率差异较小(表4)。因此可以说,突变效率主要受靶点选择的影响,受不同遗传背景的影响相对较小。
2.4 GFPuv荧光筛选载体在马铃薯遗传转化筛选中的应用
在马铃薯毛状根转化体系中,通过GFPuv荧光蛋白筛选能够高效准确地鉴定出阳性根。为了进一步确定GFPuv是否可以在马铃薯常规转基因中用于筛选阳性愈伤和阳性苗,将构建的GFPuv荧光筛选载体pCAMBIA2300MGFPuv-sgRNACas遗传转化二倍体材料PG6359。分化培养1个月左右的茎段可以看到较大的愈伤组织(图6-A),在紫外灯下看到部分愈伤组织有绿色荧光(图6-B)。经过分化和生根培养,获得2株转基因株系,PCR检测发现均为阳性株系(图6-C),在紫外灯下可以看到转基因苗发出绿色荧光(图6-D—E和图6-G—H),而非转基因株系在紫外灯下是红色的(图6-F和图6-I)。进一步经过PCR鉴定证实这些荧光苗均是转基因阳性株系。表明GFPuv荧光蛋白可以在马铃薯遗传转化的分化和生根阶段进行阳性愈伤和阳性苗的筛选。
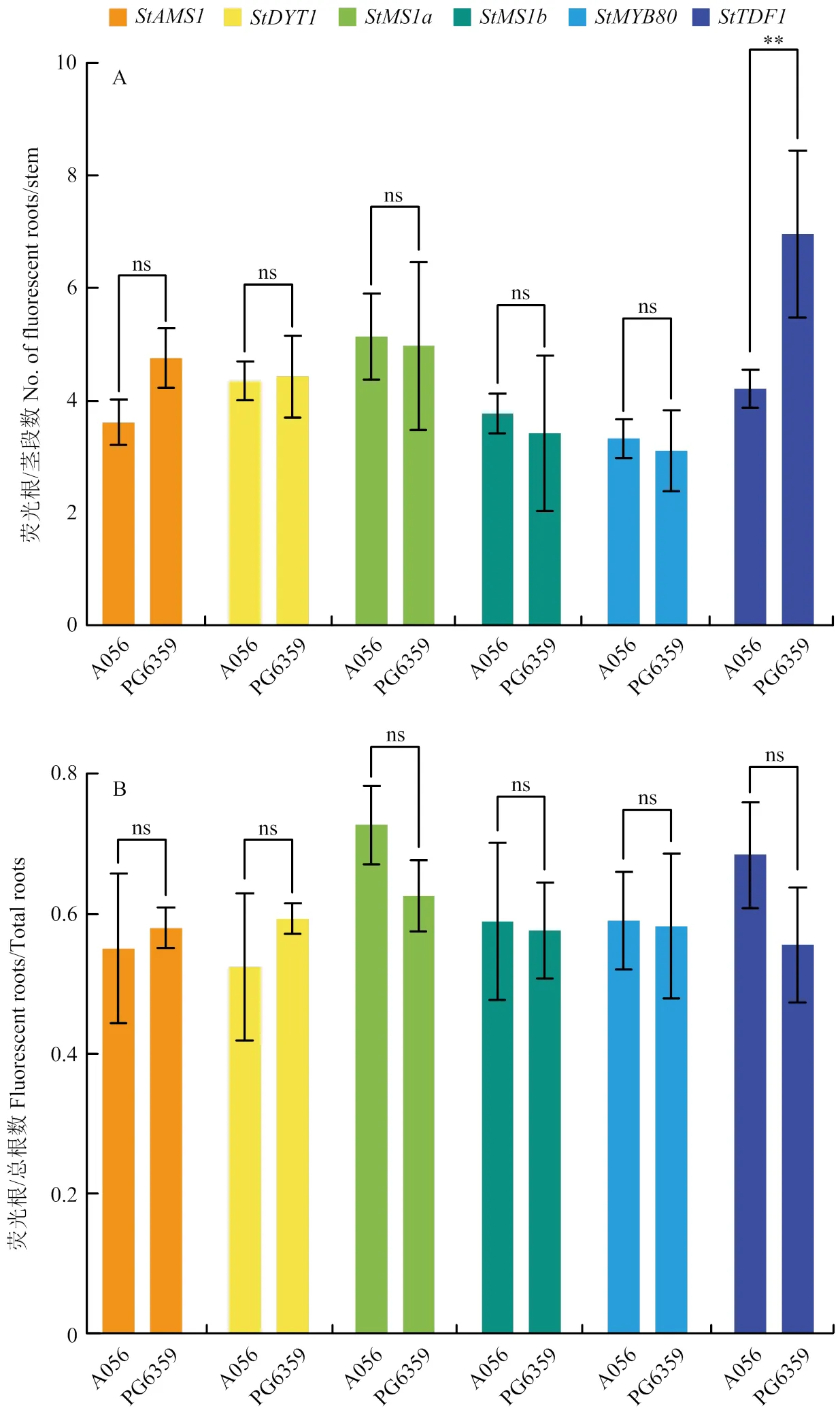
6个马铃薯花药发育相关基因StAMS、StDYT1、StMS1a、StMS1b、StMYB80和StTDF1对应的编辑载体转化A056和PG6359,每个茎段产生荧光根的数目(A)和荧光根占产生的总毛状根的比例(B)。试验重复5次,误差线代表生物学重复之间的标准差;ns代表T检验无差异,**代表T检验所得的极显著差异(P<0.01)
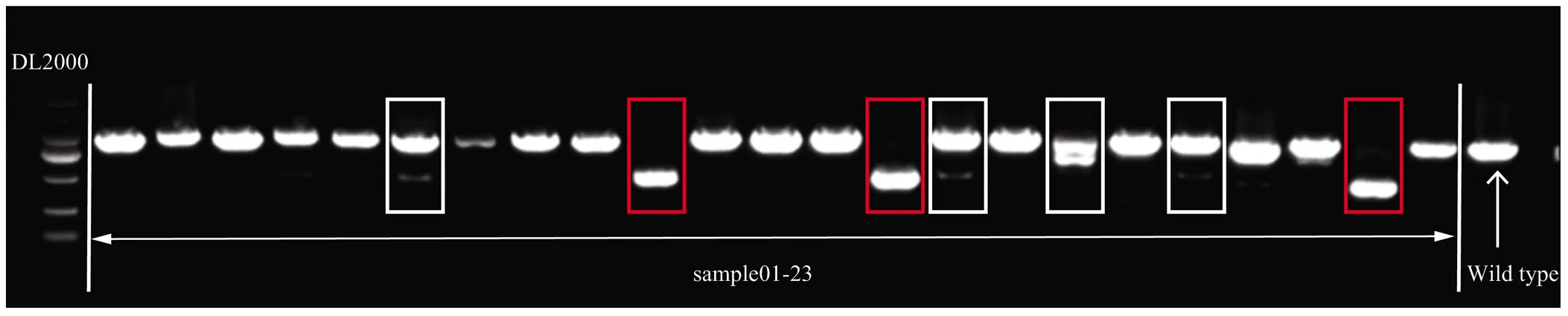
红色框代表纯合大片段缺失株系,白色框代表杂合大片段缺失株系

表3 荧光根的基因编辑位点PCR鉴定的统计分析

图5 StMS1a的一个Hi-TOM测序结果展示
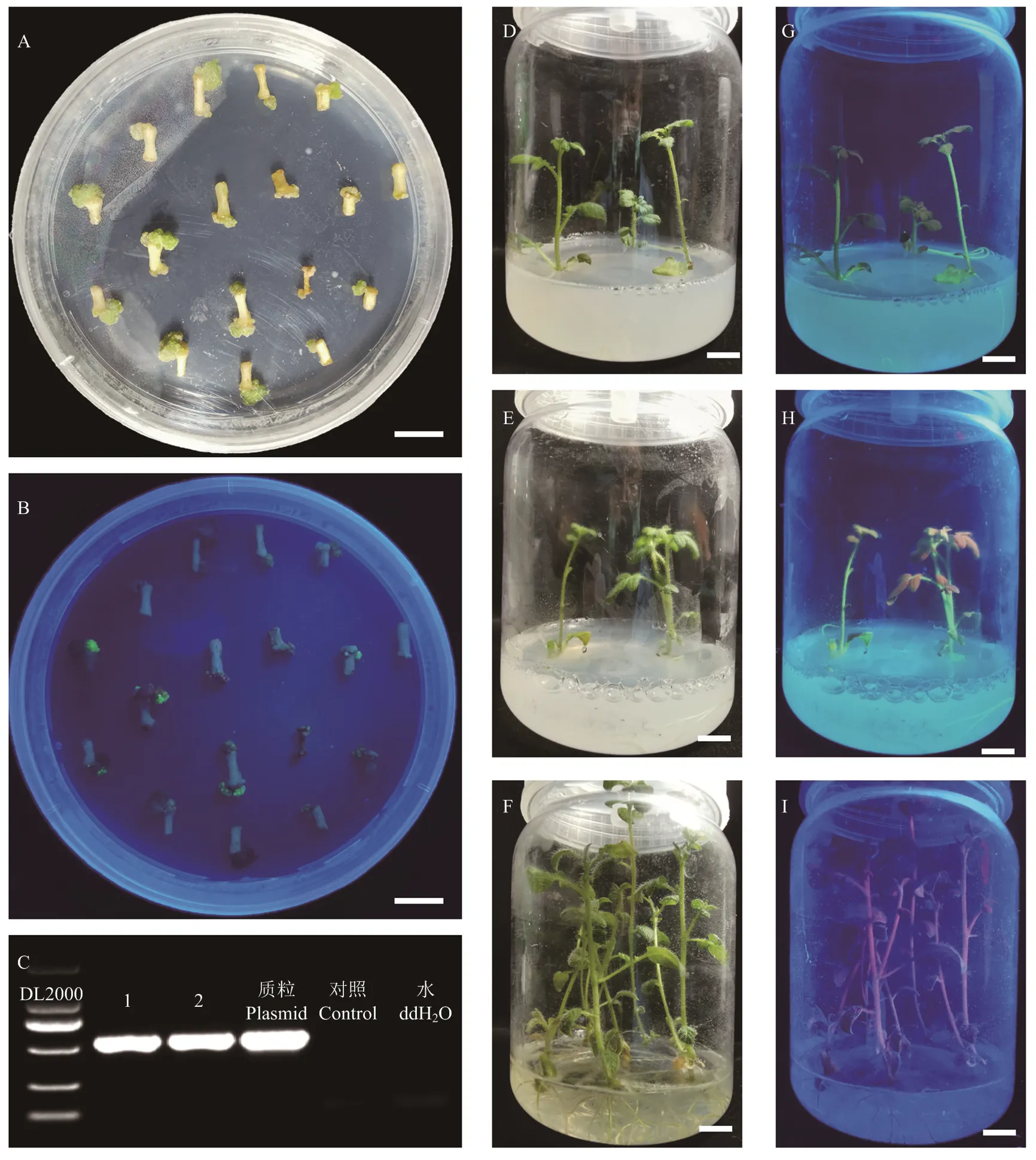
A、B:分化阶段的马铃薯茎段;C:转基因的PCR鉴定,其中1、2是阳性株系,质粒是转基因用的pCAMBIA2300MGFPuv-sgRNACas载体,对照是非转基因株系;D、G:转基因阳性株系1;E、H:转基因阳性株系2;F、I:非转基因对照。A和D—F是明场下照片,B和G—I是黑暗条件在便携紫外灯下的照片,比例尺是1 cm
3 讨论
3.1 毛状根转化体系是植物基因编辑靶点验证和遗传转化的重要途径
本研究在马铃薯毛状根转化体系中,使用GFPuv荧光蛋白筛选的基因编辑载体对马铃薯6个花药发育相关基因、、、、和进行编辑,结果显示,相同靶点在不同马铃薯材料中的编辑效率差异不明显,但不同靶点的编辑效率差异较大。因此,认为马铃薯材料的差异对基因编辑效率不会造成影响,而基因编辑成功的关键是靶位点的选择。然而,靶位点通常是利用网站进行预测选择,但预测靶点的具体编辑效率需要通过遗传转化才能获悉。对于遗传转化周期长、转化效率低的物种,编辑效率更加需要验证,但通过遗传转化验证是不现实的。毛状根转化体系操作简单、周期较短,通常20 d左右就可以产生大量的毛状根,目前,已经有很多植物建立了毛状根转化体系,并且用于基因编辑的靶点验证[23],因此,毛状根转化体系将是植物基因编辑靶点验证的重要途径。此外,有研究者在马铃薯中通过毛状根再生获得了基因编辑的植株,这一结果为马铃薯提供了新的遗传转化途径[22]。与此同时,朱健康团队在非无菌条件下切割植物根茎交界处,使用发根农杆菌侵染伤口,获得阳性根后再培养产生转化植株,利用该转化体系在一些很难或不可能转化的植物(橡胶草、小冠花、甘薯、臭椿、辽东楤木和重瓣臭茉莉)上获得了转化植株,然而,这个毛状根再生体系目前仅在部分具有根吸吮能力的植物上进行了验证,未来通过操纵植物的根吮吸能力将会用于更多物种的遗传转化和基因编辑[24]。
3.2 GFPuv荧光在植物遗传转化的辅助筛选中具有诸多优点
转基因技术已经成为植物功能研究的基本手段,同时也是作物遗传改良的重要途径。转基因技术的发展离不开筛选标记的更新迭代,其中的可视化报告基因让转基因筛选更加高效便捷。GFP作为可视化报告基因,已经在动植物及微生物检测基因转化效率中被广泛应用,同时也用于亚细胞定位、转基因表达分析等分子生物学研究[25]。GFP荧光可以在不破坏转化细胞状态的情况下进行观察,因此,被广泛用于植物遗传转化效率评估和转化细胞筛选。然而,在遗传转化中GFP筛选存在许多问题,一些转基因材料的荧光仅能被观察到几天,一些物种的叶绿色素自发荧光、色素积累会影响GFP的观察,同时较老叶片中GFP荧光会发生淬灭[26]。中国农业科学院农业基因组研究所杂交马铃薯育种课题组用包含GFP筛选标记的pKSE402基因编辑载体转化马铃薯,仅在发根中能观测到不是特别明显的荧光,获得的阳性株系观察不到荧光。此外,有学者利用GFP作为筛选工具,在马铃薯基因组中检测基因编辑效率,所获得的阳性株系仅能在叶片背面观察到微弱的荧光[27]。然而,本研究经过改造获得一个包含GFPuv荧光标记的基因编辑载体,该载体在马铃薯毛状根转化体系中可以清晰地观察到绿色荧光根,同时转化马铃薯茎段可以观察到绿色荧光愈伤组织,绿色荧光愈伤再生获得的阳性株系在紫外灯下可以观察到整株水平的稳定荧光。推测可能是马铃薯的组织结构不会影响GFPuv荧光的观察,因此认为GFPuv荧光是马铃薯遗传转化中比较好用的可视化标记。此外,本研究所用含GFPuv的载体瞬时转化烟草时,同样可以观察到强烈的荧光信号,该结果与Yuan等[28]结果一致。他们将GFPuv蛋白在2种草本植物(拟南芥和烟草)和2种木本植物(杨树和柑橘)中进行瞬时和稳定转化,所获转化株系均能观察到明亮的荧光;同时转基因植株在完整植株水平下的可视化也非常稳定,但GFPuv的表达不会影响植株的正常生长发育[28]。普通GFP与GFPuv的发射光波长均是510 nm左右,普通GFP的激发光波长通常是500 nm左右。然而,GFPuv的激发光波长是398 nm,在365 nm的便携紫外手电筒下就可以被观察到,所需的观测设备价廉易获取[8-9, 28]。基于这些特性,GFPuv在遗传转化的辅助筛选中的应用将会更加广泛。
4 结论
GFPuv荧光是一种新型的可视化筛选标记,可用于马铃薯的发根转化和常规转基因的筛选,同时发现发根农杆菌遗传转化体系是基因编辑靶点效率验证的重要途径。
[1] WALDRON C, MURPHY E B, ROBERTS J L, GUSTAFSON G D, ARMOUR S L, MALCOLM S K. Resistance to hygromycin B. Plant Molecular Biology,1985, 5(2): 103-108.
[2] BRUKHIN V, CLAPHAM D, ELFSTRAND M, von ARNOLD S. Basta tolerance as a selectable and screening marker for transgenic plants of Norway spruce. Plant Cell Reports, 2000, 19(9): 899-903.
[3] JEFFERSON R A. The GUS reporter gene system. Nature, 1989, 342(6251): 837-838.
[4] JEFFERSON R A, KAVANAGH T A, BEVAN M W. GUS fusions: beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. The EMBO Journal, 1987, 6(13): 3901-3907.
[5] OW D W, DE WET J R, HELINSKI D R, HOWELL S H, WOOD K V, DELUCA M. Transient and stable expression of the firefly luciferase gene in plant cells and transgenic plants. Science, 1986, 234(4778): 856-859.
[6] SHANER N C, CAMPBELL R E, STEINBACH P A, GIEPMANS B N G, PALMER A E, TSIEN R Y. Improved monomeric red, orange and yellow fluorescent proteins derived fromsp. red fluorescent protein. Nature Biotechnology, 2004, 22(12): 1567-1572.
[7] HARPER B K, MABON S A, LEFFEL S M, HALFHILL M D, RICHARDS H A, MOYER K A, STEWART C N. Green fluorescent protein as a marker for expression of a second gene in transgenic plants. Nature Biotechnology, 1999, 17(11): 1125-1129.
[8] SHIMIZU A, SHIRATORI I, HORII K, WAGA I. Molecular evolution of versatile derivatives from a GFP-like protein in the marine copepod. PLoS ONE, 2017, 12(7): e0181186.
[9] CHIN D P, SHIRATORI I, SHIMIZU A, KATO K, MII M, WAGA I. Generation of brilliant green fluorescent petunia plants by using a new and potent fluorescent protein transgene. Scientific Reports, 2018, 8(1): 16556.
[10] 李颖, 李广存, 李灿辉, 屈冬玉, 黄三文. 二倍体杂种优势马铃薯育种的展望. 中国马铃薯, 2013, 27(2): 96-99.
LI Y, LI G C, LI C H, QU D Y, HUANG S W. Prospects of diploid hybrid breeding in potato. Chinese Potato Journal, 2013, 27(2): 96-99. (in Chinese).
[11] LI D W, LU X Y, ZHU Y H, PAN J, ZHOU S Q, ZHANG X Y, ZHU G T, SHANG Y, HUANG S W, ZHANG C Z. The multi‐omics basis of potato heterosis. Journal of Integrative Plant Biology, 2022, 64(3): 671-687.
[12] LINDHOUT P, MEIJER D, SCHOTTE T, HUTTEN R C B, VISSER R G F, van ECK H J. Towards F1hybrid seed potato breeding. Potato Research, 2011, 54(4): 301-312.
[13] ZHANG C Z, YANG Z M, TANG D, ZHU Y H, WANG P, LI D W,ZHU G T, XIONG X Y, SHANG Y, LI C H, HUANG S W. Genome design of hybrid potato. Cell, 2021, 184(15): 3873-3883.
[14] GÓMEZ J F, TALLE B, WILSON Z A. Anther and pollen development: A conserved developmental pathway. Journal of Integrative Plant Biology, 2015, 57(11): 876-891.
[15] WAN X Y, WU S W, LI Z W, DONG Z Y, AN X L, MA B, TIAN Y H, LI J P. Maize genic male-sterility genes and their applications in hybrid breeding: progress and perspectives. Molecular Plant, 2019, 12(3): 321-342.
[16] JIANG Y L, AN X L, LI Z W, YAN T W, ZHU T T, XIE K, LIU S S HOU Q C, ZHAO L N, WU S W, LIU X Z, ZHANG S W, HE W, LI F, LI J P, WAN X Y. CRISPR/Cas9-based discovery of maize transcription factors regulating male sterility and their functional conservation in plants. Plant Biotechnology Journal, 2021, 19(9): 1769-1784.
[17] 曹贞菊, 李飞, 陈明俊, 罗小波, 李标, 尹旺. 农杆菌介导几种不同马铃薯外植体转化研究. 种子, 2021, 40(9): 52-56.
CAO Z J, LI F, CHEN M J, LUO X B, LI B, YIN W. Study on-mediated transformation of several potato explants. Seed, 2021,40(9): 52-56. (in Chinese)
[18] 蒋继滨, 高冬丽, 朱曦鉴, 李灿辉. 二倍体马铃薯基因编辑载体快速验证体系的建立. 种子, 2019, 38(10): 29-33.
JIANG J B, GAO D L, ZHU X J, LI C H. Establishment of a rapid verification system for diploid potato gene editing vector. Seed, 2019, 38(10): 29-33. (in Chinese)
[19] 叶明旺, 张春芝, 黄三文. 二倍体栽培马铃薯高效遗传转化体系的建立. 中国农业科学, 2018, 51(17): 3249-3257.
YE M W, ZHANG C Z, HUANG S W. Construction of high efficient genetic transformation system for diploid potatoes. Scientia Agricultura Sinica, 2018, 51(17): 3249-3257. (in Chinese)
[20] 张西英, 张爱萍, 刘江娜. 马铃薯遗传转化体系的优化建立及其主要影响因素. 基因组学与应用生物学, 2019, 38(7): 3174-3179.
ZHANG X Y, ZHANG A P, LIU J N. Optimization establishment of the genetic transformation system of potato and its main influencing factors. Genomics and Applied Biology, 2019, 38(7): 3174-3179. (in Chinese)
[21] LIU Q, WANG C, JIAO X Z, ZHANG H W, SONG L L, LI Y X, GAO C X, WANG K J. Hi-TOM: A platform for high-throughput tracking of mutations induced by CRISPR/Cas systems. Science China Life Sciences, 2019, 62(1): 1-7.
[22] BUTLER N M, JANSKY S H, JIANG J M. First-generation genome editing in potato using hairy root transformation. Plant Biotechnology Journal, 2020, 18(11): 2201-2209.
[23] KIRYUSHKIN A S, ILINA E L, GUSEVA E D, PAWLOWSKI K, DEMCHENKO K N. Hairy CRISPR: Genome editing in plants using hairy root transformation. Plants (Basel), 2021, 11(1): 51.
[24] CAO X S, XIE H T, SONG M L, LU J H, MA P, HUANG B Y, WANG M G, TIAN Y F, CHEN F PENG J, LANG Z B, LI G F, ZHU J K. Cut-dip-budding delivery system enables genetic modifications in plants without tissue culture. The Innovation, 2023, 4(1): 100345.
[25] 李勤霞, 刘亚楠, 张译文, 程敏, 薛晓东. 绿色和红色荧光蛋白基因在二穗短柄草中的应用. 分子植物育种, 2022: https://kns.cnki. net/kcms/detail/46.1068.S.20221010.1626.026.html.
LI Q X, LIU Y N, ZHANG Y W, CHENG M, XUE X D. Application of green and red fluorescent protein gene in. Molecular Plant Breeding, 2022: https://kns.cnki.net/kcms/detail/46. 1068.S.20221010.1626.026.html. (in Chinese)
[26] HRAŠKA M, RAKOUSKÝ S, ČURN V. Green fluorescent protein as a vital marker for non-destructive detection of transformation events in transgenic plants. Plant Cell, Tissue and Organ Culture, 2006, 86(3): 303-318.
[27] TOINGA-VILLAFUERTE S, JANGA M R, ISABEL VALES M, RATHORE K S. Green fluorescent protein gene as a tool to examine the efficacy of-delivered CRISPR/Cas9 reagents to generate targeted mutations in the potato genome. Plant Cell, Tissue and Organ Culture (PCTOC), 2022, 150(3): 587-598.
[28] YUAN G L, LU H W, TANG D, HASSAN M M, LI Y, CHEN J G, TUSKAN G A, YANG X H. Expanding the application of a UV-visible reporter for transient gene expression and stable transformation in plants. Horticulture Research, 2021, 8: 234.
The Modification of Gene Editing Vector for Efficient GFPuv Fluorescence Screening and Its Application in Potato Genetic Transformation
Du Jingya1,2, Chen Kaiyuan2, Pu Jin2, Zhou Huiying3, Zhu Guangtao3, Zhang Chunzhi2, Du Hui
1College of Life Sciences, Henan University, Kaifeng 475004, Henan;2Agricultural Genomics Institute, Chinese Academy of AgriculturalSciences, Shenzhen 518000, Guangdong;3Joint Academy of Potato Sciences, Yunnan Normal University, Kunming 650500
【Objective】The improvement and innovation of screening markers contributes to the development of transgenic technology, among which the visual screening markers are widely modified for better effect. Recent studies revealed that an enhanced Yellow Green Fluorescent like Protein (eYGFPuv (GFPuv)) obtained by mutation can emit strong and stable green fluorescence under 365 nm UV light irradiation and be easily observed. Constructing the gene editing vector with GFPuv fluorescence screening marker and carrying out experiment application and verifications in potato genetic transformation will provide technical support for the screening of positive transgenic plants in potato transformation, and lay the foundation for using genome editing technology to create potato male sterile lines in the future. 【Method】By using homologous recombination, the GFPuv expression framework and gene editing element Cas9_sgRNA were successively recombined into pCAMBIA2300 vector, and then with this new designed vector the-mediated transient expression assay was conducted in tobacco plants. Six editing vectors with potato anther development conservative genes were constructed using this modified vector. Thestrains Ar qual and MSU440 harbouring these vectors were transformed into the potato stem segments respectively, and then the-induced hairy roots with green fluorescence were observed and counted under the portable UV lamp. The transformation efficiency and editing efficiency of these vectors were analyzed using hairy root transformation system in two different potato genotypes. In the end, the modified vectors were applied to produce transformed potato plants with modifications on target genes. 【Result】A novel gene editing vector pCAMBIA2300MGFPuv-sgRNACas harbouring a GFPuv fluorescence marker was successfully constructed, and the transient transformation in tobacco plants confirmed that the GFPuv expression framework was expressed successfully. The hairy roots with green fluorescence were screened after the transformation with two kinds of, and an additional supplement of kanamycin (Kan) significantly increased the proportion of positive fluorescent roots. Although the transformation rates of the two strains were not significantly different, the hairy roots of MSU440 formed faster. Furthermore, the transformation rates and editing rates of editing vectors for six potato anther development conservative genes in two different potato genotypes were the same, but the editing rates of six target sites differed significantly. Potato genetic transformation using the modified vector confirmed that GFPuv fluorescence could be used for the screening of transgenic callus and plants in potato. 【Conclusion】The hairy root transformation system mediated byis an essential approach to verifying the efficiency of gene editing, and GFPuv fluorescence can be used in the screening of transgenic plants in potato transformation.
potato; GFPuv; genome editing; hairy root; genetic transformation
2023-02-07;
2023-04-07
国家重点研发计划政府间国际科技创新合作专项(2019YFE0120500)、中国博士后科学基金面上项目(2021M700168)、云南自然科学研究计划杰出青年项目(202001AV070003)、中央引导地方科技发展资金(23ZYQJ304)
杜静雅,E-mail:DuJingyaa@outlook.com。通信作者杜慧,E-mail:duhui01@caas.cn
10.3864/j.issn.0578-1752.2023.11.015
(责任编辑 李莉)

