微生物表面活性素合成调控和高效生产研究进展
刘青, 刘波, 徐欣欣, 张红兵, 张宇宏*, 张伟
(1.河北经贸大学生物科学与工程学院,石家庄 050061; 2.中国农业科学院生物技术研究所,北京 100081)
表面活性素(surfactin)是一类由芽孢杆菌属微生物次级代谢产生的脂肽,与传统化学合成的表面活性剂相比,由菌株生产的表面活性剂因具有可持续获得、可生物降解、毒性低、对环境兼容性好、在高温和高盐等极端环境下结构稳定等优点而备受关注[1-4]。表面活性素可作为食品添加剂及乳化剂用于食品领域[5],亦可替代化学表面活性剂提高石油采油率[6-7],还可开发成生物农药以防治病虫害[8]、促进植物生长[9],另外在日化及医学领域也有广阔的应用前景[10-12]。但目前来看,微生物表面活性素产量低、生产成本高,严重限制了其实际应用范围[13]。本文主要对发酵工艺优化、新型生产原料开发、定向进化及基因工程理性设计多种策略进行综述,以期为解决微生物表面活性素产量低等问题提供理论参考。
1 表面活性素的结构及性质
表面活性素是由长链β-羟基脂肪酸链连接7个氨基酸组成的环肽,肽链上第7位氨基酸羧基与脂肪酸链的β-羟基形成内酯键。环肽包含2个亲水氨基酸(谷氨酸、天冬氨酸)和5个疏水氨基酸(亮氨酸、缬氨酸)[2,14]。L-Glu1-L-Leu2-D-Leu3-LVal4-L-Asp5-D-Leu6-L-Leu7是表面活性素典型的氨基酸顺序(图1)。因脂肪酸链的长度及肽链上氨基酸位置、种类的变化,使表面活性素有众多同系物及异构体。
表面活性素最早由Arima等[14]在枯草芽孢杆菌中发现,其在低于临界胶束浓度(critical micelle concentration,CMC)下可将水的表面张力从72.0 mN·m-1降至27.9 mN·m-1,是迄今已报道的表面活性最好的生物表面活性剂之一。表面活性素具有强大的自聚集能力,在极低水平下可由肽环之间的强氢键形成胶束团聚体,随着表面活性素脂肪链长度的增加,其表面活性增强,溶液中趋向于形成更大的聚集体[16-17]。
表面活性素的长链脂肪酸可渗入细胞膜内部,使磷脂双分子层形成渗透环境,造成细胞膜的溶解和破坏,可有效作用于革兰氏阳性菌和阴性菌的细胞膜,具有抗菌活性且不产生耐药性[18]。表面活性素还能分解病毒脂质包膜,且可通过形成离子通道分解病毒衣壳,从而具有抗病毒能力[19]。表面活性素对细胞膜的破坏是非特异性的,因此还具有溶血效应[20]。
2 表面活性素的来源及合成调控
2.1 表面活性素的来源
表面活性素源自芽孢杆菌属微生物的次级代谢,目前已知可以产生表面活性素的菌种有枯草芽胞杆菌、解淀粉芽胞杆菌、多粘芽胞杆菌、侧孢短芽胞杆菌、巨大芽胞杆菌、短小芽胞杆菌、萎缩芽胞杆菌、蜡质芽抱杆菌、地衣芽孢杆菌和贝莱斯芽孢杆菌等[21-25]。从环境中分离的野生型菌株其表面活性素产量在20~600 mg·L-1[26-28];经各种策略改造后产量显著提高,突变菌株或优化发酵条件后菌株的表面活性素产量增加至1 000~2 000 mg·L-1[29-30];通过基因工程理性设计的菌株产量增加尤为明显,如野生型B.subtilisTHY-7菌株经人工嵌合启动子Pg3替换原始启动子后,表面活性素产量由550 mg·L-1增加到9.7 g·L-1[27]。
2.2 表面活性素的合成调控
表面活性素的合成途径主要包括前体物质(脂肪酸和氨基酸)的生物合成及结构组装[31]。微生物通过初级代谢,如糖酵解、三羧酸循环、磷酸戊糖途径、蛋白质代谢、脂质代谢等途径合成相应前体;然后进行结构组装。表面活性素的组装过程分为启动、起始、肽链延伸及环化、释放,由非核糖体肽合成酶系(non-ribosomal peptide synthetase,NRPS)完成,用于合成表面活性素的NRPS是由多模块组成的多结构域蛋白,包含AA、AB、AC、AD 4个亚基,分别由srfA基因簇上的srfAA、srfAB、srfAC和srfAD编码,该基因簇总长达27 kb[32]。NRPS催化的表面活性素合成过程如图2所示。SrfAA和SrfAB蛋白均含有3个功能模块;SrfAC蛋白仅含有1个功能模块。每个模块负责1种氨基酸的识别和缩合[33],且每个模块至少包括腺苷酰化结构域、肽酰载体蛋白结构域和缩合结构域;模块3和6中还另含有异构域,如将L-Leu异构为D-Leu[34]。SrfAA负责脂化反应(谷氨酸与脂肪酸)[35]及组装L-Glu、L-Leu和D-Leu;SrfAB的3个模块按顺序组装L-Val、L-Asp和D-Leu;SrfAC组装剩下的L-Leu残基;SrfAC的末端连接1个Ⅰ型硫酯酶TEI,负责环化和释放。srfAD编码II型硫酯酶,执行表面活性素组装过程的监视和修复功能[36]。sfp基因位于srfA操纵子下游30.5 kb左右,是参与表面活性素合成的另一要素,该基因编码的SFP酶具有磷酸泛酰巯基乙胺基转移酶(phosphopantetheinyl transferase,PPTase)功能,可催化非核糖体肽和载铁蛋白前体的形成,并以此激活表面活性素合成酶,属PPTase超家族[37]。在sfp基因缺失或有缺陷的情况下,表面活性素将无法合成[31]。
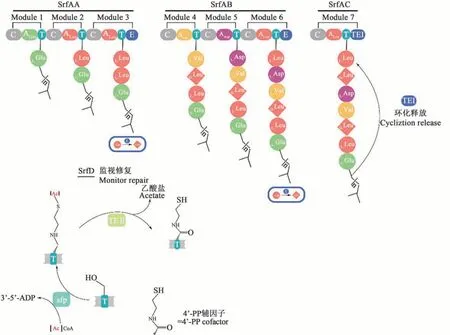
图2 NRPS 催化的表面活性素合成过程示意图(根据参考文献[33]修改)Fig.2 Schematic diagram of surfactin synthesis catalyzed by NRPS(modified on reference[33])
表面活性素的调控是多重级联反应过程[38],与芽孢杆菌天然感受态形成、芽孢形成、细胞游动性、生物膜形成等生物活性相关[39]。在调控过程中,芽孢杆菌信息素ComX与膜蛋白组氨酸激酶ComP结合,使其自磷酸化后,将磷酸基团转移给调控蛋白ComA。磷酸化的ComA与基因簇srfA的启动子结合,激活srfA转录。感受态刺激因子(competence and sporulation factor,CSF)也参与调控表面活性素的合成。CSF由phr基因编码,Phr前体肽在胞外通过寡肽透性酶Opp运至胞内,与Rap蛋白结合,导致其丧失磷酸酶活性,无法对磷酸化ComA进行脱磷酸化,使ComA处于活性状态,从而有利于srfA转录。全局调控因子CodY对srfA转录具有负调控作用。CodY与srfA的启动子结合,占据DNA与正调控蛋白的结合位点导致srfA转录受到抑制,敲除codY基因能显著提高表面活性素的产量[40-41]。
3 表面活性素的应用
在食品领域,表面活性素的抗菌活性能有效控制食品中有害微生物的滋生,可作为生物防腐剂应用于食品防腐保鲜领域[5,42-43]。作为两亲性分子,表面活性素具有乳化、洗涤、发泡、增溶、杀菌、润湿、渗透、分散、低毒等特性,可有效应用于化妆品,如增溶剂、肥皂、洁面乳等产品[44-46]。表面活性素的抗菌性、抗氧化性及不产生耐药性使其具有显著的医学应用价值,可抑制白色念珠菌,并抑制细菌与感染部位的粘附,在预防真菌感染和皮肤疾病方面具有潜在作用[12,47]。
表面活性素可降低油/水界面张力,改变油藏的润湿性以及乳化原油,提高原油的流动性,增加原油的采收率[48]。研究发现,Bacillus licheniformisL20生产的表面活性素可将原油采收率提高19.58%,表明生物表面活性剂的润湿和乳化机制在微生物提高原油采收率工艺中发挥了重要作用[49]。表面活性素驱油已成为一种绿色高效的采油方法,但其在固体表面的吸附问题仍有待解决[50-51]。表面活性素在农业领域也具有广泛的应用前景,如对黄瓜枯萎病有明显的防治效果[52];可促进大白菜叶际定殖[53];有利于不结球白菜生长及增强光合作用,并能提高植株对微量元素的吸收,不仅可作为作物的叶面有机营养剂直接施用,还可作为水溶性肥料的增效剂[54]。
4 表面活性素的高效合成策略
目前,微生物表面活性素产量低且价格昂贵,为解决这个问题,主要通过发酵工艺优化、新型生产原料开发、定向进化及基因工程理性设计4种策略提高其产量。
4.1 发酵工艺优化
发酵条件优化可提高菌株的表面活性素产量。目前优化主要集中在发酵方式及发酵培养基组分。研究发现,通过泡沫分离、添加金属离子[55]、使用厌氧生物反应器[56]、采用分批发酵[29]、优化培养基组分[28,57]、使用两段进料工艺及优化矿物盐培养基[58]等均可提高表面活性素的产量。Yi等[29]采用重复分批发酵、低成本泡沫分馏、可重复使用的固定化细胞和高效能的开放式(非无菌)发酵技术,使表面活性素产量达7 887.3 mg。Liu等[28]利用响应面法优化解淀粉芽孢杆菌培养基,使表面活性素产量增加1.52倍。
4.2 新型生产原料的开发
利用廉价的工农业废弃物作为生产原料,可降低表面活性素的生产成本,同时降低废弃物处理成本,减少环境污染,实现绿色循环生产。研究表明,以秸秆[59]、大豆荚和甘蔗渣[60]、橄榄磨废料[61]进行固体发酵,均可生产表面活性素;以合成废水、生物柴油生产过程中的副产物甘油为原料进行液体发酵,表面活性素产量与以LB为培养基时的产量相差不大[26]。Zhou等[62]研究发现,Bacillus velezensisBS-37在甘油培养基中生长36 h,表面活性素产量达1 000 mg·L-1以上。
4.3 定向进化
在表面活性素的实际生产过程中,开发高效廉价的生物合成过程(发酵工艺优化及新型生产原料开发)对产量增长贡献有限,通过菌种改造获得高产表面活性素的菌株更具有实际生产意义,如对菌株进行定向进化、基因工程理性设计等。
定向进化主要包括化学诱变和物理诱变。郭芳芳等[63]通过多种化学试剂(氯化锂、亚硝基胍、甲基磺酸乙酯和链霉素)进行复合诱变,筛选到1株表面活性素产量比出发菌株提高44.56倍的突变体。陆雅琴[57]通过紫外诱变及溴麝香草酚蓝(bromothymol blue, BTB)高效筛选体系,成功筛出高产量突变菌株。Zhu等[64]利用常压室温等离子体(atmospheric room temperature plasma, ARTP)进行突变,以聚二乙炔(polydiacetylene, PDA)囊泡作为传感器的高通量筛选方法获得高产菌株,其生产的表面活性素产量是出发菌株的5.4倍。
4.4 基因工程理性设计
定向进化的工作量大,高通量筛选方法建立较难,存在回复突变及菌种退化等问题。通过基因工程手段对表面活性素的代谢途径进行理性设计改造是提高表面活性素产量的有效方法。表面活性素产量可提高2~20倍(表1)。主要包含启动子替换工程、前体物质合成途径设计、转录调控基因改造、分泌途径改造等。

表1 基因理性设计策略优化后表面活性素的产量Table 1 Surfactant production under different rational design strategies of gene
4.4.1 启动子替换工程 表面活性素的合成基因簇长达27 kb,利用过表达方式来提高表面活性素的产量难度较大,而启动子可以决定基因表达水平,因此替换PsrfA成为提高产量的有效手段。替换启动子主要是选择天然强诱导型启动子及人工嵌合诱导启动子,通常是蔗糖、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside, IPTG)作诱导剂及厌氧型启动子。Sun等[65]通过同源重组将B.subtilisfmbR的启动子PsrfA替换成强诱导型启动子PspaC,使表面活性素产量提高为野生型的10倍;Jiao等[27]通过替换天然强组成型启动子PgroE及蔗糖诱导型启动子PsacB和PsacP后,通过人工嵌合诱导启动子Pg3使菌株表面活性素产量达到9.74 g·L-1。Hoffmann等[70]提出了1种在缺氧条件下自诱导合成表面活性素的新方法,枯草芽孢杆菌在厌氧生长过程中硝酸盐和亚硝酸盐还原酶均高水平表达,因此将菌株JABs24原生启动子PsrfA分别替换为PnarG和PnasD后,可在厌氧条件下诱导合成表面活性素。
通过替换启动子PsrfA并不都会提高表面活性素产量。研究表明,PgroE替换天然启动子PsrfA后,菌株并不能合成表面活性素[27];用强组成型启动子Pveg替换野生型启动子PsrfA后,有的重组菌株表面活性素产量远低于原始菌株[71]。
4.4.2 前体物质合成途径设计 在表面活性素合成过程中,脂肪酸及氨基酸前体的生物合成是第一步,前人对氨基酸及脂肪酸供应改变是否会影响表面活性素产量进行了相关研究。Wang等[31]对4种氨基酸生物合成分支代谢途径上的核心基因通过CRISPRi进行抑制,L-Glu酰化是表面活性素缩合反应的第一步,抑制与L-Glu代谢相关的基因yrpC、racE、murC后,表面活性素的产量增加尤为显著,且yrpC和racE共抑制效果最好;此外,抑制与L-Leu和L-Val代谢相关的bkdAA和bkdAB,不仅提高了表面活性素的产量,还增加了C14亚型的比例。
关于对脂肪酸前体供应增加的研究,主要有敲除相关基因消除其竞争途径及过表达脂肪酸合成途径相关基因。Hu等[72]通过敲除pps和pks消除其竞争途径并过表达酰基载体蛋白(acyl carrier protein,ACP)硫酯酶,两步强化B. subtilis168生产表面活性素的脂肪酸前体供给途径,使表面活性素产量达4.02 g·L-1。王苗苗等[67]通过过表达β-羟基脂肪酸合成的限速酶yngH基因,以增强乙酰辅酶A羧化酶活性,增加脂肪酸前体供应,使表面活性素产量达13.3 g·L-1;之后在此基础上分别通过强化脂肪酸生物合成关键基因以及该途径全部基因,并对发酵条件进行优化,使表面活性素产量达34 g·L-1[68]。
4.4.3 转录调控基因的改造 表面活性素的合成需要多种调控因子参与,可通过过表达或敲除这些调控因子的基因来提高表面活性素产量。研究表明,过表达与表面活性素合成相关的芽孢杆菌信息素ComX基因和感受态刺激因子CSF基因,其表面活性素产量为野生型的6.4倍[26];OppA可能在表面活性素合成调控中间接发挥作用[73];敲除编码全局转录调控因子基因codY、降解支链氨基酸的lpdV基因[40]、产孢基因spoIVB或过表达Leu合成基因leuABCD-K并补加Leu[69]均可提高表面活性素的产量。此外敲除降解支链氨基酸的lpdV基因可使C14亚型比例增加2.5倍。B. subtilis3NA因spo0A基因发生无义突变和AbrB的延伸成为非产孢菌株,JABs32菌株是B. subtilis3NA的1种高产表面活性素的变体[58]。Klausmann等[70]在B. subtilis168衍生菌KM1016中构建spo0A基因缺失和AbrB延伸的突变体,在分批补料培养中表面活性素产量达18.27 g·L-1。Wu等[25]采用系统工程方法来高表面活性素产量,删除与生物膜形成相关的基因和非核糖体肽合成酶/多酮合成酶途径相关的基因,过表达潜在的自我抵抗相关蛋白(SwrC,AcrB),增强支链α-酮酰辅酶A的供应,过表达整个脂肪酸合成酶复合物,增强srfA的转录,将前体乙酰辅酶A从细胞生长转移到表面素的生物合成,最终使表面活性素产量达12.8 g·L-1。
4.4.4 分泌途径的改造 对表面活性素分泌途径的改造,可通过强化表达参与其分泌的跨膜蛋白来增加产出,但目前其分泌机制并不清楚。研究表明,表面活性素的自我抗性基因yerP与其分泌有关[74]。Li等[30]利用脂质体和跨膜转运抑制剂发现,B. subtilisTHY-7中的表面活性素外流主要依赖于质子驱动力(proton motive force,PMF),过表达3种假定的以PMF为能量源的脂肽转运蛋白YcxA、KrsE和YerP,分别使表面活性素产量增加89%、52%和145%。
5 展望
微生物表面活性素具有多种优势属性,在多个领域有巨大的应用潜力。目前微生物表面活性素在实验室研究阶段已取得一定进展,但其大规模产业化仍受限于发酵工艺、生产菌种和生产成本等因素,有待进一步优化。在发酵工艺上,发酵液的泡沫分离及下游的提取纯化方面等问题亟待解决。此外,廉价生产原料的开发也是降低生产成本、促进工业化生产的有效方法。生产菌株可从两方面入手研究。在定向进化方面,可以通过开发高通量筛选方法减少高产菌株筛选的工作量。在基因工程理性设计方面,强启动子替换已明确可提高表面活性素产量,可继续探索效果更好的启动子;或改变氨基酸前体合成途径对脂肪酸长度产生的影响,进而影响表面活性素的性质;还可研究脂肪酸前体的从头合成途径及其参与合成的方式,从而提升表面活性素产量,同时有助于开发表面活性素的新同系物。

