艾司洛尔治疗脓毒症休克的临床效果及其对血清内皮细胞特异性分子1、缺氧诱导因子1α水平的影响
黎慧慧 翁少英 许书慧
[1 海口市第四人民医院重症科,海南省海口市 571100; 2 海口市人民医院(中南大学湘雅医学院附属海口医院)重症科,海南省海口市 570208]
脓毒症是由感染导致的一种全身炎症反应综合征,可导致多器官功能障碍,重症患者常因组织灌注不足而发生脓毒性休克[1]。目前临床上脓毒症休克的标准治疗方法是液体复苏和去甲肾上腺素治疗,其虽然可改善患者的休克状态,但时常引起过度复苏、血流动力学恢复不足和心肌受损[2]。脓毒症患者由于体内长时间存在大量儿茶酚胺,心脏受损严重,因此其并发心肌功能不全的概率高达50%,病死率居高不下,预后不良[3]。艾司洛尔作为一种超短效β受体阻滞剂,可以有效拮抗儿茶酚胺引起的心肌毒副作用,稳定和控制脓毒症休克患者心率,改善患者预后[4]。但有关艾司洛尔对脓毒症休克患者炎症因子水平影响的研究较少。缺氧诱导因子1α(hypoxia inducible factor 1α,HIF-1α)是机体缺氧状态下的重要转录调节因子之一,可参与和调控多种炎症介质产生,其与机体发生缺氧性病理改变存在密切联系[5]。内皮细胞特异性分子1(endothelial cell specific molecule 1,ESM-1)是由内皮细胞分泌的一种特异性可溶性蛋白多糖,可调控炎症进程,且有研究表明其与脓毒症休克患者的预后存在密切联系[6]。本研究探讨艾司洛尔治疗脓毒症休克的临床效果,以及其对患者血流动力学指标和血清炎症因子指标(ESM-1、HIF-1α)水平的影响。
1 资料与方法
1.1 临床资料 选择2015年1月至2017年12月在海口市第四人民医院治疗的92例脓毒症休克患者为研究对象。纳入标准:(1)符合《2012国际严重脓毒症及脓毒性休克诊疗指南》[7]中脓毒症休克的诊断标准,即充分液体复苏后仍持续存在组织低灌注(低血压、乳酸增高或少尿);(2)早期目标导向治疗后仍不能有效控制心率(心率仍>95次/min);(3)去甲肾上腺素用量不超过2 μg/(kg·min);(4)患者病例资料完整且配合研究;(5)患者本人或家属签署知情同意书。排除标准:(1)入组24 h内死亡或不愿继续接受治疗者;(2)对最小剂量艾司洛尔持续静脉泵入不耐受,出现严重心动过缓(心率低于50次/min)和/或低血压[平均动脉压(mean arterial pressure,MAP)<65 mmHg];(3)伴有严重呼吸衰竭、心源性休克、慢性心力衰竭或急性心肌梗死;(4)有严重精神疾病或心肾功能不全;(5)患有糖尿病且长期服用影响血乳酸水平的降糖药。按照随机数字表法将患者分为研究组和对照组,各46例。两组患者的性别、年龄、治疗前急性生理学与慢性健康状况评价Ⅱ(Acute Physiology and Chronic Health Evaluation Ⅱ,APACHEⅡ)评分、治疗前序贯器官衰竭评估(Sequential Organ Failure Assessment,SOFA)评分、感染来源差异均无统计学意义(均P>0.05),见表1。本研究获得海口市第四人民医院医学伦理委员会批准。
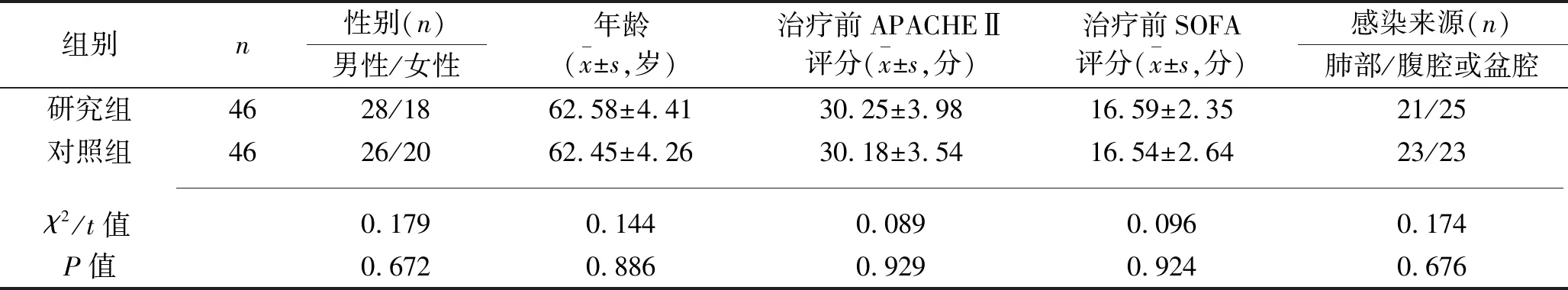
表1 两组患者一般资料的比较
1.2 治疗方法 于入院后4 h内对所有患者进行经锁骨下静脉穿刺并置入双腔中心静脉导管,根据脉搏指示连续心输出量监测法监测患者的连续心输出量和血流动力学。给予两组早期目标导向治疗,在治疗原发疾病、营养支持、抗感染治疗(首次使用广谱抗菌药物,随后根据微生物培养和药敏试验结果给予针对性治疗)及其他对症治疗的基础上,使用晶体液进行容量复苏,中心静脉压控制在8~12 cmH2O。若患者血红蛋白水平<70 g/L,给予输注浓缩红细胞,使血红蛋白水平达到目标值(70~90 g/L)。对于充分液体复苏后血压值仍较低的患者,给予去甲肾上腺素,使MAP≥65 mmHg。在此基础上,对照组持续24 h静脉泵入等渗溶液,泵入速度为5 mL/h。研究组持续24 h静脉泵入盐酸艾司洛尔注射液(北京泰德制药股份有限公司,国药准字H20093381),初始注射剂量为0.05 mg/(kg·h),根据患者心率适当调整药物泵入速度,5 min调整1次,最大剂量为0.2 mg/(kg·h),目标为4 h内将患者心率控制在95 次/min以下或心率较入组时下降20%以上,但不低于55次/min。
1.3 观察指标 (1)血流动力学指标及氧合指数:分别于治疗前和治疗12 h、24 h、48 h后,采用肺热稀释法测定患者的心输出量,并记录患者的MAP、心率、氧合指数。(2)血乳酸水平:分别于治疗前及治疗12 h、24 h、48 h后采集患者动脉血5 mL,使用血乳酸检测仪(上海益联医学仪器发展有限公司,型号:LT1710)检测血乳酸水平。(3)治疗结果:记录两组患者的机械通气时间、住院时间、ICU入住时间。(4)APACHEⅡ评分和SOFA评分:分别于治疗前和治疗1周后对患者进行APACHEⅡ评分、SOFA评分,APACHEⅡ评分、SOFA评分越高分别代表患者病情越重、预后越差。(5)血清ESM-1和HIF-1α水平:分别于治疗前和治疗24 h后采集患者空腹静脉血8 mL,置于肝素抗凝管,使用高速离心机(Beckman Coulter公司)以15 000 r/min离心15 min分离血清,使用 FX-6MG型酶联免疫光谱分析仪(北京康高特仪器设备有限公司)及ELISA试剂盒(北京索莱宝科技有限公司,批号:2015-21)检测血清ESM-1和HIF-1α水平。
1.4 统计学分析 采用SPSS 20.0软件进行统计学分析。计量资料以(x±s)表示,组内比较采用配对t检验,组间比较采用两独立样本t检验。计数资料以例数和百分比表示,组间比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 治疗前后两组患者血流动力学指标、氧合指数和血乳酸水平的比较 治疗前,两组患者的MAP、心率、氧合指数、血乳酸水平差异均无统计学意义(均P>0.05)。治疗12 h、24 h、48 h后,两组患者的MAP、氧合指数较治疗前上升,心率、血乳酸水平较治疗前下降,且研究组上述指标均优于对照组(均P<0.05)。见表2。
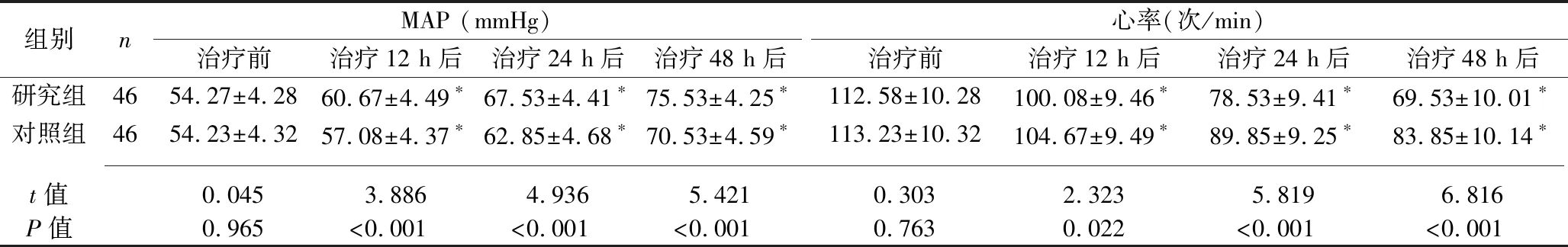
表2 两组患者治疗前后血流动力学指标、氧合指数和血乳酸水平的比较(x±s)
2.2 两组患者治疗结果的比较 研究组患者的机械通气时间、住院时间、ICU入住时间均短于对照组(均P<0.05),见表3。
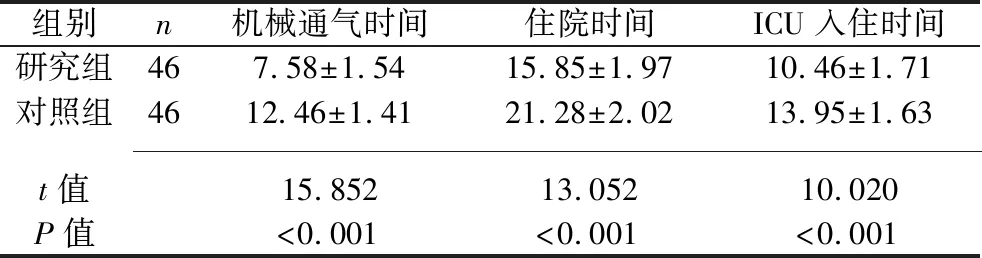
表3 两组患者治疗结果的比较(x±s,d)
2.3 治疗前后两组患者APACHEⅡ评分和SOFA评分的比较 治疗前,两组患者的APACHEⅡ评分和SOFA评分差异均无统计学意义(均P>0.05)。治疗后,两组患者的APACHEⅡ评分和SOFA评分均较治疗前下降,且研究组的上述评分均低于对照组(均P<0.05)。见表4。
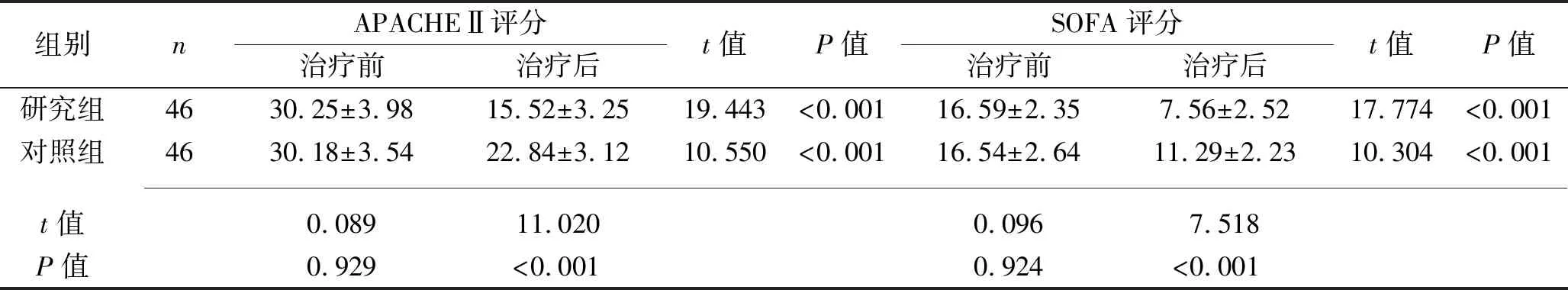
表4 治疗前后两组患者APACHEⅡ评分、SOFA评分的比较(x±s,分)
2.4 治疗前后两组患者血清ESM-1、HIF-1α水平的比较 治疗前,两组患者血清ESM-1、HIF-1α水平差异均无统计学意义(均P>0.05)。治疗后,两组患者血清ESM-1、HIF-1α水平均较治疗前下降,且研究组上述指标水平均低于对照组(均P<0.05)。见表5。
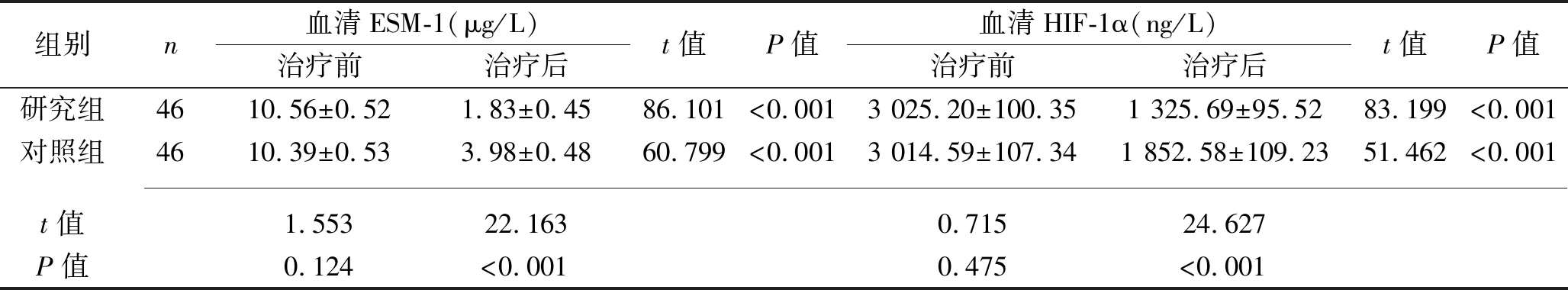
表5 治疗前后两组患者血清ESM-1、HIF-1α水平的比较(x±s)
3 讨 论
脓毒症是由感染引起的一种全身性炎症反应,严重脓毒症常导致脓毒症休克和多器官功能障碍综合征[8]。目前临床上治疗脓毒症休克的标准方法是液体复苏和去甲肾上腺素治疗。液体复苏可以改善患者相对血容量不足和全身炎症反应,但液体负荷过大也会引起左心室舒张功能不全、肺毛细血管通透性增加,甚至增加肺水肿的发生风险[9]。在液体复苏时应用去甲肾上腺素可以逆转休克、恢复患者血管张力,但临床上采用标准方法治疗后仍有20%左右的脓毒症休克患者存在循环不稳定的情况,推测可能与脓毒症并发心功能不全有关[10]。脓毒症相关心功能不全主要与长时间的β受体过度激动和儿茶酚胺大量暴露有关,而β受体阻滞剂可以有效抑制儿茶酚胺风暴、控制心率和改善患者预后。
艾司洛尔作为重症医学领域常用的一种超短效β受体阻滞剂,可以降低机体交感神经张力,控制心率,且具有起效快、安全性高、便于调节的特点[11]。临床研究表明艾司洛尔还具有心脏保护作用,可改善机体组织氧代谢状况[12]。本研究结果显示,治疗12 h、24 h、48 h后,两组患者的MAP、氧合指数较治疗前上升,心率、血乳酸水平较治疗前下降,且研究组上述指标均优于对照组(均P<0.05);治疗1周后两组患者的APACHEⅡ评分和SOFA评分均较治疗前下降,且研究组评分均低于对照组(均P<0.05);研究组患者的机械通气时间、住院时间、ICU入住时间均短于对照组(均P<0.05)。说明在液体复苏的基础上使用艾司洛尔治疗可以显著改善脓毒症休克患者的血流动力学指标,控制患者的心率,从而改善患者的预后。这可能是因为脓毒症引起的心功能不全主要与儿茶酚胺大量暴露导致β受体过度激动有关,而β受体阻滞剂艾司洛尔可以有效拮抗儿茶酚胺风暴,达到控制患者心率、改善患者病情和预后的目的。血乳酸是机体无氧代谢的产物,可以作为反映组织缺氧或低灌注程度的指标之一。艾司洛尔可以通过降低心率,改善心功能、血流动力学和组织缺血缺氧状态,从而有效提高氧合指数和降低体内血乳酸水平。刘蕾等[13]的研究显示,儿茶酚胺可直接导致患者心率加快,是影响脓毒症休克患者预后的独立危险因素,使用艾司洛尔联合米力农治疗可显著降低脓毒症休克患者的心率,改善其心功能、全身炎症反应及生存率,与本研究结果相符。
HIF-1α是一种低氧依赖性蛋白,其表达水平主要受细胞内氧分压精确调控,且与细胞内氧浓度呈负相关,即缺氧时间越长,HIF-1α表达水平升高越显著[14]。有研究表明,除了缺氧,某些非缺氧因素如生长因子、炎性因子及血管活性物质也可以刺激HIF-1α的表达[15]。而脓毒症休克发生后,机体组织缺血缺氧的同时会释放大量炎症因子,从而刺激HIF-1α大量表达。ESM-1作为一种特异性可溶性循环蛋白多糖,与炎性疾病的发生和发展有密切联系,其可能是一种新型炎症标志物。近来有研究显示,体内促炎细胞因子直接参与调控ESM-1的合成与分泌,且ESM-1表达水平受肿瘤坏死因子α、白细胞介素1等炎症介质的影响[16]。 Pauly等[17]在150例疑似严重脓毒症的患者中发现,严重脓毒症患者确诊后第1天、第3天和第8天的外周血ESM-1水平高于脓毒症患者及系统性炎症反应综合征患者,所有患者第1天外周血ESM-1水平与30 d和6个月全因死亡率相关,说明外周血ESM-1具有作为预后标志物的潜在价值,同时提示ESM-1可能参与脓毒症的发展,且可用于脓毒症的预后评估。Bultema等[18]研究发现,牙髓炎组织的缺血缺氧状态会诱导HIF-1α水平升高,提示HIF-1α与炎症的发生和发展存在紧密联系。本研究结果显示,治疗24 h后,两组患者血清ESM-1、HIF-1α水平较治疗前下降,且研究组上述指标低于对照组(P<0.05)。Zhao等[19]的研究显示,β受体阻滞剂可以通过激活磷脂酰肌醇-3-激酶/p110β信号通路减少促炎因子的表达,从而改善脓毒性心肌病患者的预后。还有研究表明,β受体阻滞剂可通过抑制核因子κB的表达水平来减少促炎因子的生成[20]。由此推测,艾司洛尔可能是通过抑制磷脂酰肌醇-3-激酶/p110β信号通路及核因子κB的表达水平来有效调节炎症因子水平和HIF-1α、ESM-1的表达水平,从而改善患者预后。
综上所述,在液体复苏的基础上使用艾司洛尔治疗脓毒症休克患者疗效显著,可有效控制患者心率,降低血清炎症因子ESM-1、HIF-1α水平,适于临床应用推广。但本研究病例数较少,具有一定的局限性,未来还需要进一步开展大样本随机对照试验验证本研究结果。

