Natalizumab减轻小鼠创伤性脑损伤炎症反应的作用研究*
谭雅夫, 刘 畅, 王圣泳, 黎东翘, 罗 昱, 余永佳, 赖海燕, 冯大勤△
广西医科大学第一附属医院 1神经内科 2神经外科,南宁 530021
据统计,全球每年约有1000万人发生创伤性脑损伤(traumatic brain injury,TBI)[1]。我国作为全球最大的发展中国家拥有最多的人口数量,使得TBI的发生率和患者数量要远高于其他国家,而TBI导致的不良预后给患者的家庭和社会带来沉重的负担。因此,探索TBI的发病机制和新的治疗策略是改善患者预后的重要途径。从TBI的发病机制来看,除了外伤引起的原发性脑损伤,伤后的炎症反应是导致继发性脑损伤的重要原因[2-3],特别是外周血中白细胞亚群如T细胞和B细胞对脑组织的浸润均能导致患者神经功能的进一步恶化[4]。然而,大量的临床研究表明非甾体抗炎药(NSAIDS)、TNF-α抑制剂和IL-1抑制剂等对TBI后的炎症反应并无明显的抑制作用[5]。因此,TBI后的抗炎策略需要进一步的探索。众所周知,Natalizumab(抗CD49d单克隆抗体,VLA-4α链)是一种用于治疗多发性硬化和克罗恩病的生物制剂,主要通过抑制粘附过程从而防止出现新病灶,并有减轻已有病灶炎症反应的作用,以达到减少复发的目的。已有研究表明,Natalizumab通过直接拮抗α4整合素来阻止免疫细胞对血管内皮的粘附和淋巴细胞在组织中的趋化作用,并通过抑制α4β7整合素与血管细胞粘附分子-1的结合来减轻炎症反应[6-7],使其有望成为TBI后抗炎治疗的潜在药物。在本实验中,我们通过TBI小鼠模型来探索Natalizumab对小鼠神经功能损伤的治疗效果,希望能为TBI后的抗炎治疗提供新的选择和思路。
1 材料与方法
1.1 TBI小鼠模型
选取32只6周龄C57BL/6小鼠随机均分为实验组和对照组。术前采用10%水合氯醛腹腔注射麻醉小鼠。待小鼠麻醉后,置于立体定位仪,手术部位备皮消毒。在麻醉小鼠头皮正中行10 mm切口,随后用牙科钻在小鼠右侧顶骨中部开颅。将控制性皮质冲击损伤(CCI)设备(eCCI型号6.3,美国)的捕获器端部延伸至其全部冲击距离,并定位于暴露的硬脑膜表面,复位,冲击硬脑膜。以6 m/s速度、1.5 mm变形深度的撞击器致小鼠脑损伤[8]。最后关闭缝合小鼠头皮切口。
1.2 实验分组与处理
小鼠TBI后3 h,16只实验组小鼠以12 μg/体重(g)的剂量于腹腔注射Natalizumab(eBioscience)。16只对照组小鼠按同样的方法和剂量注射IgG同型对照抗体(Bio X Cell)。
1.3 小鼠神经系统功能评价
7只实验组和7只对照组小鼠分别于TBI后第1天、3天、7天、14天、21天,采用改良神经功能缺损评分(mNSS)来评估TBI小鼠模型的神经功能缺损情况[9]。
1.4 Morris水迷宫实验
构建TBI小鼠模型后,7只实验组和7只对照组小鼠在第21~25天,采用Morris水迷宫评价小鼠的空间、学习和记忆能力[10]。每天对小鼠在固定的时间点进行4次评估,即4个象限评估,每次间隔30 min。每只小鼠都面朝墙壁,被轻放于水面。小鼠被允许90 s找到平台,并在上面停留10 s,然后记录找到平台的时间,即为潜伏期时间,以此来反应认知功能。
1.5 小鼠脑水肿程度评估
在TBI后第3天采用干湿重法对小鼠脑水肿程度进行评估。待3只实验组和3只对照组小鼠深麻醉后取脑标本,随后用电子分析天平对脑组织进行称重,记为湿重(WW)。100℃烘干24 h后,按相同方法称取干重(DW),脑含水(%)=(WW-DW)/WW×100%。
1.6 免疫荧光检测
3只实验组和3只对照组小鼠于腹腔注射10%水合氯醛麻醉,经心脏灌注4%多聚甲醛(PFA)。取出脑组织并在4%多聚甲醛中4℃固定过夜,于30%蔗糖磷酸盐缓冲溶液中脱水。然后将脑组织嵌入Tissue-Tek O.C.T中,并冷冻在液氮上。用冰冻切片机Leica CM 1900制备10 μm冠状切片,于-20℃保存。染色时,切片在室温下风干1 h,然后用1×PBS冲洗。含0.1% Triton X的封闭溶液封闭切片,使其在室温下封闭1 h。切片与一抗于4°C孵育过夜。1×PBS洗涤3次,二抗室温孵育1 h。用1×PBS洗涤3次,然后封片,于荧光显微镜下观察荧光并计数。
1.7 免疫印迹(Western blot)检测
从3只实验组和3只对照组小鼠脑组织中分离损伤的同侧半球,用研柱在含有蛋白酶抑制剂S8820(Sigma)的冰冷RIPA缓冲液中均质组织。于4℃,12000 r/min离心20 min,收集上清。上清样品经SDS-聚丙烯酰胺凝胶电泳分离,转移到膜上。然后用小鼠抗β-actin,兔抗IL-1β和鼠抗NOX2等抗体孵育膜。采用Image J软件分析条带灰度值估算蛋白的相对表达量。
1.8 统计学方法
所有实验数值均采用SPSS 23.0软件进行分析,计量资料用平均值±标准差表示。多组间均数的比较采用单因素方差分析(one-way ANOVA),组间两两比较采用Tamhane’s T2或者Bonferreoni检验,两组均数的比较采用两独立样本t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 Natalizumab改善TBI小鼠神经功能和认知功能障碍
构建TBI小鼠模型后的3 h,我们分别于实验组和对照组小鼠的腹腔注射相同剂量的Natalizumab和IgG。在第3、7、14、21天采用mNSS评分对实验组和对照组小鼠进行评分。结果如图1A所示,从注射Natalizumab的第3天开始实验组小鼠评分要明显低于对照组,实验组小鼠在第7、14、21天的神经功能缺损评分分别为(1.556±0.527)、(1.333±0.500)和(1.111±0.333),阴性对照组第7、14、21天的神经功能缺损评分分别为(2.875±1.356)、(2.250±1.035)和(2.250±0.886),差异均具有统计学意义(均P<0.05),且在第21天两组评分的差异达到最大值。这一结果提示TBI小鼠在使用Natalizumab治疗后其神经功能得到了一定程度的改善。随后,从第21天至25天,我们采用Morris水迷宫对实验组和对照组小鼠的认知功能进行了评估。在第24和25天,注射Natalizumab的实验组小鼠的潜伏期时间分别为(27.63±5.12)s和(19.92±6.07)s,对照组小鼠的潜伏期时间分别为(48.57±10.01)s和(45.50±6.38)s,差异均具有统计学意义(均P<0.05)(图1B),这一结果提示TBI小鼠在使用Natalizumab治疗后其认知障碍得到改善。
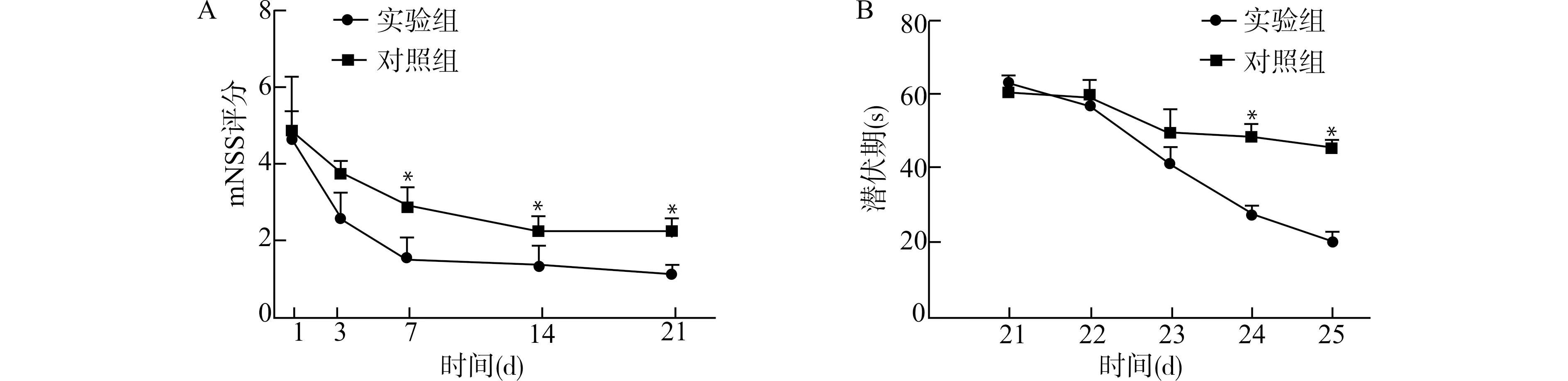
A:Natalizumab对TBI小鼠mNSS评分的影响;B:Natalizumab对TBI小鼠认知功能的影响;与实验组比较,*P<0.05图1 Natalizumab对TBI小鼠神经功能的影响Fig.1 Effects of Natalizumab on nerve function of TBI mice
2.2 Natalizumab改善TBI小鼠脑水肿
构建TBI小鼠模型后,我们分别于实验组和对照组小鼠的腹腔注射相同剂量的Natalizumab和IgG。随后在第3天获取小鼠完整的脑组织,采用干湿重法对小鼠的脑水肿程度进行评估。结果如图2所示,注射Natalizumab的实验组小鼠的脑组织含水百分比(78.98±0.13)明显低于对照组(80.36±0.17),差异具有统计学意义(P<0.05)。由此我们认为TBI小鼠在使用Natalizumab治疗后其脑水肿程度得到了一定程度的改善。

*P<0.05图2 Natalizumab对TBI小鼠脑水肿的影响Fig.2 Effect of Natalizumab on brain edema in TBI mice
2.3 Natalizumab降低T细胞和B细胞对TBI小鼠脑组织的浸润
构建TBI小鼠模型后,我们分别于实验组和对照组小鼠的腹腔注射相同剂量的Natalizumab和IgG。在第3天获取小鼠脑组织,经固定和切片后用T细胞表面标记CD3抗体和B细胞表面标记CD19抗体进行免疫荧光染色。显微镜下观察发现,注射Natalizumab的实验组小鼠脑组织中T细胞和B细胞的浸润数量分别为(3.3±0.6)和(5±1),对照组小鼠脑组织中T细胞和B细胞的浸润数量分别为(15.7±1.2)和(15±1),差异均具有统计学意义(均P<0.05)(图3、图4)。这一结果提示Natalizumab能够降低T细胞和B细胞对TBI小鼠脑组织的浸润程度。

A:免疫荧光检测TBI小鼠脑组织中CD3(标尺=100 μm);B:荧光显微镜下细胞计数;*P<0.05图3 Natalizumab对TBI小鼠脑组织T细胞浸润的影响Fig.3 Effect of Natalizumab on T cell infiltration in brain tissues of TBI mice
2.4 Natalizumab降低TBI小鼠脑组织NOX2和IL-1β表达
构建TBI小鼠模型后,我们分别于实验组和对照组小鼠的腹腔注射相同剂量的Natalizumab和IgG。随后于第3天获取损伤同侧的小鼠脑组织,经蛋白提取、抗体孵育等步骤,采用免疫印迹检测小鼠脑组织中炎症因子NOX2和IL-1β的表达情况。结果显示,注射Natalizumab的实验组小鼠脑组织中NOX2和IL-1β的蛋白相对表达量分别为(0.48±0.05)和(0.85±0.04),对照组小鼠脑组织中NOX2和IL-1β的蛋白相对表达量分别为(0.96±0.08)和(1.53±0.03),差异均具有统计学意义(均P<0.05)(图5、图6)。这一结果提示Natalizumab能够降低TBI小鼠脑组织中炎症因子NOX2和IL-1β的表达。

A:免疫印迹检测TBI小鼠脑组织中NOX2的表达;B:NOX2相对表达定量分析;*P<0.05图5 Natalizumab对TBI小鼠脑组织NOX2表达的影响Fig.5 Effect of Natalizumab on NOX2 expression in brain tissues of TBI mice
3 讨论
TBI是全世界面临的主要健康问题,目前临床上没有有效的治疗措施。在全世界范围内,每年TBI导致的直接或间接经济损失约4000亿美元[11]。TBI后首先引起脑实质受损、脑出血和轴突剪切,继而诱发炎症反应、氧化应激、代谢紊乱和中枢神经细胞死亡,最终造成神经损伤、局部血流供应障碍、血脑屏障破坏以及周围脑组织肿胀等二次脑损伤(secondary brain insult,SBI)[12]。而TBI的后遗症包括人格改变、认知功能下降、精神异常、癫痫发作和运动功能障碍等,这些后遗症严重影响到脑外伤患者的生活质量[13]。TBI后的原发性损伤可引起不可逆转且不可治疗的脑损伤,继发性损伤对脑组织损伤演变及临床预后亦有重要影响。

A:免疫印迹检测TBI小鼠脑组织中IL-1β的表达;B:IL-1β相对表达定量分析;*P<0.05图6 Natalizumab对TBI小鼠脑组织IL-1β表达的影响Fig.6 Effect of Natalizumab onIL-1β expression in brain tissues of TBI mice
在继发性脑损伤中神经炎症反应是重要的病理生理过程[14]。促炎性因子主要包括TNF-α、IL-1β和IL-6。IL-1β在其中扮演着重要的角色,可触发TBI诱导的神经炎症级联反应,并且脑组织对IL-1β和IL-6信号尤为敏感,这与神经系统中多种神经细胞表达这些细胞因子的受体有关[15]。TBI亦可引起炎性巨噬细胞趋化及炎性因子的释放,继而导致神经元细胞死亡和神经功能缺陷等。因此,抑制神经炎症反应可能是治疗或缓解TBI的有效手段[16],而已有报道,在TBI后靶向抑制免疫细胞的功能和浸润可起到重要的神经保护作用[17]。已有大量研究表明,小胶质细胞是中枢神经免疫系统中最重要的免疫细胞,参与到TBI后急性和慢性炎症反应中,促进炎症结局向特定方向发展。TBI后强大的炎症刺激导致早期小胶质细胞的活化和中性粒细胞募集,引起巨噬细胞浸润,可建立一个减轻有害结果的保护环境。但同时活化的小胶质细胞也能释放各种有害物质,如促炎细胞因子、活性氧和兴奋性神经递质,从而加重神经损伤[18]。TBI后早期通过激活小胶质细胞可以促进细胞碎片的清除和神经再生,但小胶质细胞的长时间激活会导致病理性促炎状态,进一步加重神经元和星形胶质细胞损伤,可使病灶进行性扩大。小胶质细胞在TBI后的双重作用与其不同表型之间的平衡密切相关。在不同的发展阶段,神经元通过细胞间信号传导可对小胶质细胞亚型进行调控[19]。同时,时机和强度以及特异性免疫组成等因素均会影响最终结果,因此免疫调控在TBI发展过程中起到重要作用[20]。由于TBI后小胶质细胞的作用具有复杂性和多面性,提醒我们在治疗策略上应避免仅仅抑制小胶质细胞的活化,还需调控小胶质细胞不同表型之间的平衡,继而促进中枢神经系统的重塑和修复。鉴于目前对小胶质细胞及其亚型的消极或积极作用的研究仍处于初级阶段,且尚无定论,寻求更有效的治疗方法值得我们进一步探索。Natalizumab是一种针对免疫细胞VLA-4α链的单克隆抗体,目前已广泛应用于多种自身免疫性疾病的治疗,例如多发性硬化或克罗恩病患者使用Natalizumab后已显示出良好的治疗效果[21]。除此之外,有关脑缺血小鼠模型的研究中显示,Natalizumab可阻断脑缺血后免疫细胞对脑组织的侵袭作用,从而起到对神经元的保护作用[22]。目前国内外未见有Natalizumab在创伤性脑损伤方面应用的相关报道。在本实验中,我们通过构建TBI小鼠模型,发现应用Natalizumab后TBI小鼠的神经功能障碍得到改善,并减轻了脑水肿程度,降低了免疫细胞对小鼠脑组织的浸润和炎症因子的表达。据此,我们认为Natalizumab有望成为潜在的TBI治疗药物,并期待进一步的研究和探索,希望本实验能为TBI的治疗提供新的选择和思路。

