脱氮除磷菌株固定条件的优化及净水能力的研究
郝梓添,付小巧,李烨,方雯靖,刘小艳,邢春玉
(天津天狮学院,天津 301700)
随着社会经济的高速发展,水污染问题日渐突出,对我国的工农业发展和国民经济造成了严重的影响,如何有效地控制水体中的氮、磷仍是当前亟待解决的问题[1-3]。对富营养化水体进行修复的方法主要有物理、化学、生物等方法,其中微生物技术凭借着对环境污染小和操作难度低等优势被广泛使用,这在一定程度上解决了物理或化学技术成本高、治理效果不理想、易引起二次污染等问题[4]。
固定化微生物技术是20 世纪80 年代发展起来的新兴技术,并显现出良好的应用前景,近年来已逐渐发展成为一种主要的生物修复手段。该技术是采用物理或化学的方法将菌株固定在有限空间区域[5],与游离微生物技术相比,固定化微生物具有密度高、不易流失[6],清除氮磷效果好,对环境耐受力强等优点,在净化富营养水体的试验中具有重要的研究价值[7-8]。慕庆峰等[9]将一株假单胞菌(Pseudomonas putida)进行固定并应用于湿地水体修复,对水体中氮、磷具有良好的去除效果。尹艳娥等[10]以活性炭纤维(ACF)固定微生物用于污染水体的治理,其对氨氮和亚硝酸盐有较好的去除作用,去除率可以达到60%-90%。刘娥等[11]将2%SV 与6%CaCl2交联24 h 作为最适条件,包埋蛋白核小球藻和光和细菌,研究结果表明菌藻结合且合理固定可显著提高对养殖废水的净化效率。
固定化微生物载体材料可以对固定化效果产生直接影响,因此材料的选择至关重要。通常选择成本低,容易获得,且不会被微生物降解的材料[12]。聚乙烯醇(PVA)具有机械强度好、成本低等特点,常被选作微生物固定的载体材料。海藻酸钠(SA)具有良好的生物相容性、经济环保且可降解,但其力学性能较差[13],使用存在一定局限性,因此常和PVA 一起使用。
本研究以反硝化聚磷菌为研究对象,采用海藻酸钠(SA)和聚乙烯醇(PVA)对菌株进行包埋,形成固定化微球,以清除富营养化水体中总氮、总磷为评价指标,通过正交试验,探讨菌株包埋固定的最优条件。将固定化微球投放入富营养化水体中,通过监测TN、TP、COD 等指标,评价固定化微球的使用性能。
1 材料与方法
1.1 试验材料
1.1.1 试验所用菌株 实验室筛选的具有脱氮除磷能力的反硝化聚磷菌菌株(Bacillussp.)A16。
1.1.2 培养基及模拟废水(1)BPM 培养基(g·L-1):蛋白胨10 g、牛肉膏3 g、NaCl 5 g、蒸馏水1 000 mL、pH7.0、121 ℃灭菌20 min。
(2)模拟废水(g·L-1):葡萄糖0.28 g、(NH4)2SO40.3 g、K2HPO40.06 g、微量元素2 mL、蒸馏水1 000 mL、pH 7.0。
1.2 试验方法
1.2.1 菌株扩大培养及菌体收集 无菌条件下,将A16 菌株接种于BPM 培养基,30 ℃,160 r·min-1条件下培养至对数期。取对数期菌液,5 000 r·min-1,离心10 min,得到菌体沉淀,称取菌体湿质量,加入无菌水,制成10 mL 菌悬液。
1.2.2 SA 和PVA 浓度的确定(质量体积比,m·v-1)PVA 浓度为1.0%时,SA 浓度分别设置为1.0%、2.0%、3.0%、4.0%,将混合的凝胶用注射器滴入经NaHCO3调节至pH 为7.0 的2.0%CaCl2饱和H3BO3溶液中,固化30 min,观察微球形态,测定破碎率、弹性等指标,确定SA 的使用浓度。
固定SA 浓度为2.0%,控制单一变量为PVA 浓度,考查PVA 浓度为1.0%、2.0%、3.0%、4.0%时成球效果,按上述同样的方法制备微球并测定破碎率、弹性等指标,确定PVA 的使用浓度。
为排除当SA、PVA 浓度均为1.0%时,有可能是因为PVA 浓度过低而形成不规则易粘连微球的不确定性,再次选择SA 浓度为1.0%时,考查PVA浓度为1.0%、2.0%、3.0%、4.0%时微球成型效果。
1.2.3 固定化微球性能测试 (1)成球难易:颗粒能否形成大小均匀的圆球形,且不出现拖尾现象。
(2)破碎率:取50 个固定化微球,置于盛有100 mL 蒸馏水的锥形瓶中,30 ℃、160 r·min-1条件下震荡24 h,记录微球的破碎个数并计算破碎率。
(3)弹性:按压小球后是否可恢复原状且速度较快。
1.2.4 固定化脱氮除磷菌微球的制备 称取2.0 g SA 和4.0 g PVA,置于烧杯中,加入90 mL 热蒸馏水,待充分溶解后,冷却至30 ℃,形成SA-PVA 凝胶。将菌悬液与SA-PVA 凝胶混合,充分搅拌至混合均匀,用10 mL 注射器缓慢滴入经NaHCO3调节至pH 值为7.0 左右的具有一定浓度的CaCl2饱和H3BO3溶液中,形成直径约为3 mm 的固定化微球,固化30 min 后除去CaCl2硼酸溶液,用无菌水反复冲洗,收集微球。固定化微球存储于4 ℃冰箱内,备用。
用去离子水代替菌悬液,按上述方法制备空白微球。
1.2.5 正交试验设计 在单因素试验的基础上,以去除废水中的总氮、总磷能力为评价指标进行3 因素3 水平正交试验设计L9(34),考查菌体添加量、CaCl2浓度、固化时间对固定化微球成球效果及清除氮磷能力的影响。因素水平表见表1。

表1 正交试验因素水平表

表2 PVA、SA 浓度对成球效果的影响
1.2.6 固定化微球对模拟废水的修复 将按照优方案固定的微球(如图1 所示)投放到模拟废水中,观测微球的实际净水能力。具体操作步骤为:将100 g 微球投放到盛有250 mL 模拟废水的锥形瓶中,将锥形瓶置于摇床上,30 ℃、80 r·min-1条件下震荡,每8 h检测水体中TN、TP 和COD 的含量,并计算去除率。

图1 固定化脱氮除磷菌株微球
1.2.7 水体指标的测定方法及数据处理 总氮和总磷的测定分别采用碱性过硫酸钾消解紫外分光光度法和钼锑抗分光光度法,COD 的测定采用重铬酸钾法[14]。采用sigmaplot 14.0 进行绘图,SPSS20.0 进行方差分析。
2 结果与分析
2.1 固定化微球性能评价
试验中先确定PVA 浓度为1.0%,控制单一变量为SA 浓度。SA 浓度为1.0%时,形成不规则微球,易粘连,微球弹性差,24 h 破碎率为48.0%,如图2-A所示;SA 浓度为2.0%时,形成规则微球,弹性较好,24 h 破碎率为12.0%;SA 浓度为3.0%和4.0%时,均形成带尾不规则微球,弹性较差,24h 破碎率分别为8.0%和6.0%,如图2-B、图2-C 所示。由此确定,SA的最佳使用浓度为2.0%。

图2 不同浓度SA 成球效果
固定SA 浓度为2.0%,控制单一变量为PVA 浓度。结果表明,当PVA 浓度为1.0%、2.0%、3.0%、4.0%时,均可形成规则微球,如图3 所示。从20 cm 高处自由下落弹跳高度分别为8.2 cm、8.6 cm、10.3 cm、14.2 cm,24 h 破碎率分别为12.0%、14.0%、10.0%和8.0%。由此得出,固定化微球最佳的PVA浓度为4.0%。

图3 不同浓度PVA 成球效果
为排除SA、PVA 浓度均为1.0%时,因PVA 浓度过低而形成不规则、易粘连微球的不确定性,再选择SA 浓度为1.0%,控制单一变量为PVA 浓度。当PVA 浓度为1.0%、2.0%、3.0%、4.0%时,均不能形成规则微球。由此确定,SA 浓度为1.0%时均不能形成规则微球。固定化微球的最佳条件为:SA 浓度为2.0%,PVA 浓度为4.0%。
SA 和PVA 形成的网格结构构成了固定化微球的基本骨架。当SA 浓度增大时,微球强度增加,但弹性差,结构致密,导致传质性能降低。PVA 浓度偏低时,成球性较差,当浓度增大时,微球弹性良好,但成球性差,传质性能也会降低[15]。因此,SA 与PVA 联合使用可以避免成球困难和传质阻力大的不足。
2.2 正交试验结果分析
表3 为正交试验结果与极差分析,其中k1,k2,k3 代表试验结果平均值,R 代表该列的极差。结果表明,试验号为2、5、8 的成球效果最好。各因素对TN、TP 去除的影响由主到次排列为:A>B>C(即菌体添加量(g·L-1)>CaCl2浓度(%)>固化时间(min))。根据极差分析可以得出,对TN 去除较优的方案为A3B2C2,即菌体添加量为6 g·L-1,CaCl2浓度为2%,固化时间为30 min;对TP 去除较优的方案为A3B2C1,即微生物用量为6 g·L-1,CaCl2浓度为2%,固化时间为45 min。根据方差分析结果可知,在总氮去除方面菌体添加量、CaCl2浓度各水平间表现出明显的差异(P<0.05),固化时间各水平之间差异不显著。在总磷去除方面,菌体添加量各水平间表现出显著差异(P<0.05),CaCl2浓度和固化时间各水平之间差异不显著。由此可见,菌体添加量是固定化微球清除氮磷能力的关键影响因素。
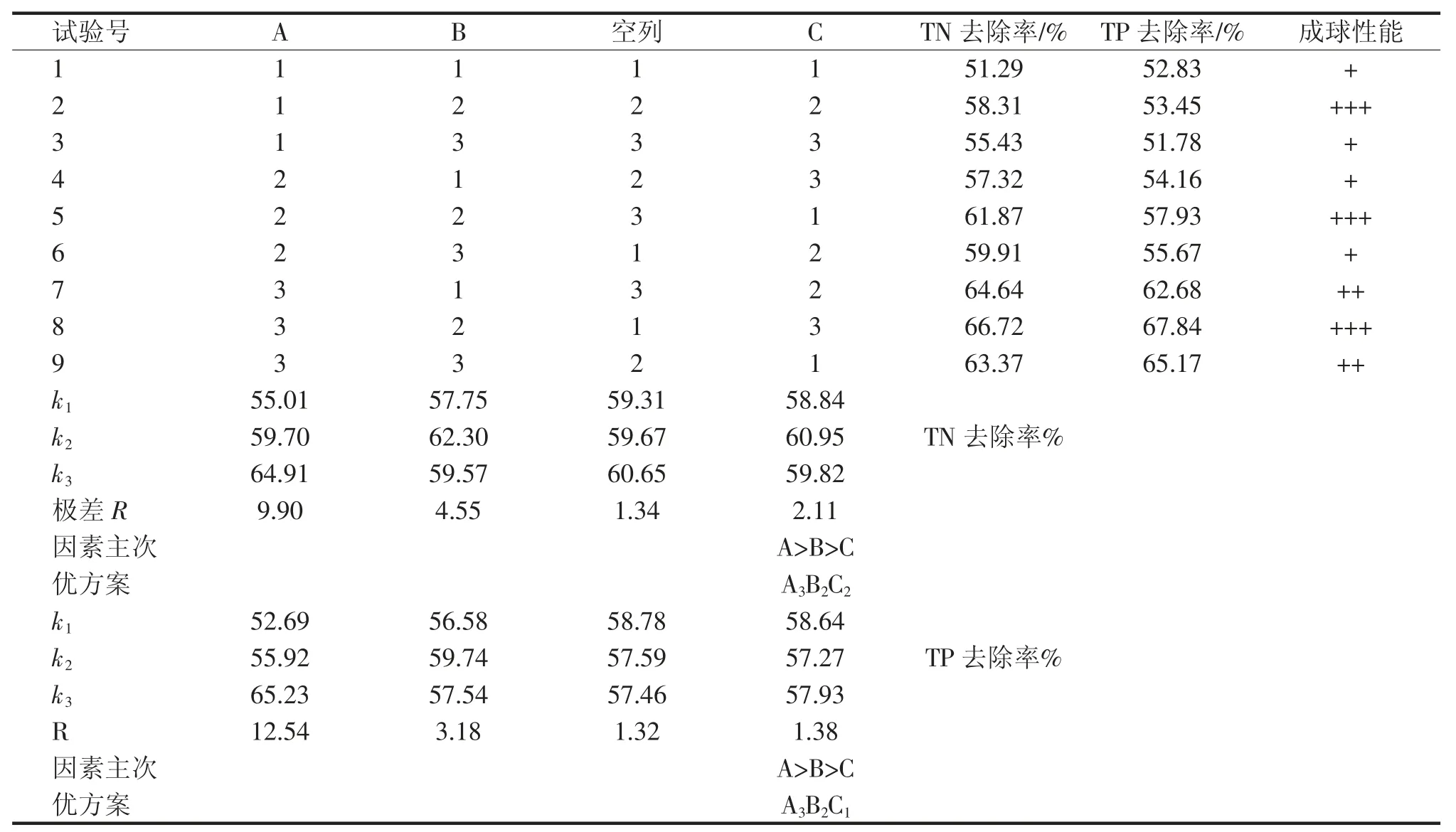
表3 正交试验结果
2.3 验证试验结果分析
由表4 可知,方案A3B2C2对总氮的去除率为68.73%,对总磷的去除率为70.54%;方案A3B2C1对总氮、总磷的去除率分别为67.94%和68.23%。因此,选定脱氮除磷菌株固定化的优方案为A3B2C2,即菌体添加量为6 g·L-1,CaCl2浓度为2.0%,固化时间为30 min,SA 用量为2%,PVA 用量为4%。
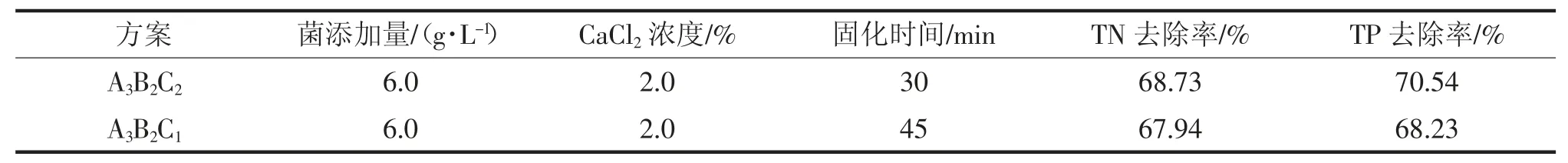
表4 验证试验结果
图4 显示了3 种因素对TN、TP 去除率的影响趋势。由图4 可知,菌体添加量越大,清除总氮、总磷的能力越强,但菌体添加量不可过高。研究发现,当达到6 g·L-1时,对TN、TP 的去除能力趋于平缓,原因可能是微生物包埋固化在SA+PVA 微球内,生存空间有限,密度过高,菌体繁殖会受到限制[16]。因此,在现有研究条件下,控制菌体湿质量6 g·L-1的浓度较为合理。CaCl2浓度为2%时,TN、TP 的去除效果较好,当浓度升高时去除能力开始下降,过量的CaCl2会导致凝胶结构紧密,从而影响营养盐的进入,造成传质性能降低[17]。固化时间达到30 min 时,微球对TN、TP 的去除效果最好,随着固化时间的延长,过饱和的Ca2+会造成微球过度固化,影响传质,同时过多的Ca2+也会影响微生物的生长[18],进而影响对氮、磷的去除能力。
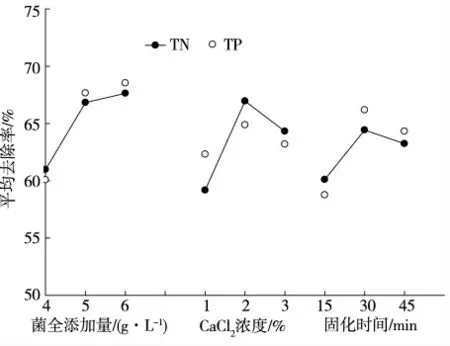
图4 3 种因素对TN、TP 去除率的影响趋势
本研究使用CaCl2-H3BO3作为交联剂,CaCl2溶液中Ca2+与SA 中的-COONa 作用形成-COOCaOOC-的结构。PVA 通过硼酸溶液中的B(OH)4-进行交联作用,形成-OB(OH)O-结构[19]。PVA 与硼酸反应的速度较慢,因此容易聚集成团[20],使用含有CaCl2的饱和H3BO3溶液作为交联剂,可以避免PVA 颗粒聚集,增强成球能力。
2.4 固定化微球对模拟废水的净化
将固定化微球投放到模拟富营养化水体中,对TN、TP、COD 的清除情况见图5。从图5 可以看出,微球在24 h 对TN、TP、COD 的去除率达到较高水平,TN 去除率在32 h 达到最大值(69.53%);TP 去除率在40 h 达到最高值(70.50%),之后去除能力保持平稳;COD 清除率在48 h 达到最大值(73.26%)。结果表明,固定化微球可以在较长时间内对富营养化水体保持良好的净化能力。

图5 固定化微球对模拟废水的净化效果
3 讨论与结论
(1)通过对固定化微球弹性、破碎率、成球效果等指标的研究结果表明,当PVA 为1.0%时,在不同浓度的SA 条件下,成球效果均不够理想。低浓度时,破碎率将近50%,这也证实SA 凝胶脆性大,单独使用成球效果不佳[21]。PVA 与SA 的复合使用,弥补了SA 单独使用的不足,提高了凝胶的机械性能[22],破碎率明显降低。因此,当SA 浓度为2.0%、PVA浓度为4.0%时,固定化微球成球良好,且具有较好性能。(2)正交试验结果表明,菌体添加量为6 g·L-1、CaCl2浓度为2%、固化时间为30 min 时,对水体中总氮、总磷具有较好的清除效果,清除率分别达到68.73%和70.54%。CaCl2浓度低时,交联度低,微球机械强度差,菌体包埋不充分,容易流失;浓度高时,造成交联结构紧密,传质性能下降。因此,CaCl2浓度为选择2%较为合适。固化时间对微球成球性能的影响表现为固化时间短,造成Ca2+置换Na+反应不充分,导致微球容易破碎。固化时间长,SA 凝胶结合位点达到饱和,颗粒网络结构过于紧密,导致菌体酶活性降低[23],脱氮除磷效率下降。因此,固化时间控制在30 min 较为合适。(3)固定化微球在模拟废水中对TN、TP、COD 的去除试验表明,24 h 即可达到较高的净化水平,在72 h 内微球对水体的净水能力保持平稳,对富营养化水体总氮、总磷、COD 各项指标清除率最高可达到69.53%、70.50%、73.26%。

