维生素D代谢途径中基因多态性与肺癌的研究进展
李由 王世雄 张昊川 邓镇凯 黄河


【摘要】 肺癌是当今全球恶性肿瘤中发病率和死亡率较高的一种,尽管已经研究了各种各样的方法干预肺癌的进展,但医治效果仍欠佳,加上多数患者确诊时已失去最佳手术时机,或因预防策略不足,肺癌患者收效是微弱的。维生素D(VitD)作为一种脂溶性维生素,其熟为人知的作用是调节钙磷代谢,用来治疗骨质疏松等代谢性骨病。近年来,随着医疗发展和研究的深入,发现VitD参与多种生物途径,并与癌症的发病机制息息相关。体内和体外实验已经公开了VitD发挥免疫调节和抗肿瘤的功能。本文从VitD参与肺癌的作用机制、VitD系统中基因的多态性与肺癌的关系及未来靶向治疗等方面展开综述。
【关键词】 维生素D 肺癌 免疫细胞 基因多态性
Research Progress of Gene Polymorphism in Vitamin D Metabolic Pathway and Lung Cancer/LI You, WANG Shixiong, ZHANG Haochuan, DENG Zhenkai, HUANG He. //Medical Innovation of China, 2023, 20(12): -188
[Abstract] Lung cancer is one of the malignant tumors with high morbidity and mortality in the world today. Although various methods have been studied to interfere with the progress of lung cancer, the curative effect is still unsatisfactory. In addition, most patients have lost the best opportunity for surgery when they are diagnosed, or because of insufficient preventive strategies, the effect of lung cancer patients is weak. Vitamin D (VitD), as a lipid-soluble vitamin, is well known for its role in regulating calcium and phosphate metabolism, and is used to treat metabolic bone diseases such as osteoporosis. In recent years, with the development of medical treatment and the deepening of research, it has been found that VitD participates in many biological pathways and is closely related to the pathogenesis of cancer. In vivo and in vitro experiments have revealed that VitD plays an immunomodulatory and antitumor role. This article reviews the mechanism of VitD's participation in lung cancer, the relationship between gene polymorphism in VitD system and lung cancer, and the future targeted therapy.
[Key words] VitD Lung cancer Immunocyte Gene polymorphism
First-author's address: Shenzhen Second People's Hospital, Guangdong Province, Shenzhen 518035, China
doi:10.3969/j.issn.1674-4985.2023.12.043
肺癌是发生率较高的恶性肿瘤之一,死亡率也非常高。最新统计显示2020年全球范围内约有220万人被新诊断患有肺癌[1],发现的时候大部分已经发展至中晚期阶段,已丧失最佳手术时机,且新诊断出的肺癌患者中约85%为非小细胞肺癌,其恶性程度非常高,5年生存率较低[2]。虽然治疗肺癌可采用顺铂、阿霉素等多种化疗药物,但由于药物选择性不高、吸收不佳、毒副作用大,患者难以耐受,疗效较差,且极易产生耐药性[3-4]。因此,开发对自身免疫细胞毒性小、对肿瘤细胞选择性高、耐药能力低的新型药物成为当务之急。最近的资料显示,维生素D(VitD)及VitD受体(VDR)水平异常与癌症的发病机制有关,越来越多的证据也支持VitD/VDR轴在抑制肿瘤方面的重要性[5]。流行病学研究表明,VitD或VDR的缺乏可以增加多种癌症的风险[6]。有研究表明血液中25羟基维生素D[25(OH)D]
的含量增加10 nmol/L,癌症患者的总死亡率可降低4%左右,提示VitD能提高癌症患者的预后[7]。在另一項剂量反应研究中显示,25(OH)D浓度每增加10 nmol/L,肺癌风险可降低5%,这项研究表明25(OH)D浓度可能与肺癌风险降低有关[8]。最近国外多项荟萃分析表明,高水平的循环VitD可以降低肺癌的发病率及死亡率,且血清VitD的水平和肺癌的风险呈现出明显的负相关性,以上研究表明,VitD对肺癌起到保护作用[9-10]。此外,据报道VitD/VDR途径参与抑制肿瘤细胞的增殖、分化、凋亡及迁移能力,不仅能调节肿瘤细胞的能量代谢,还能调节其微环境的免疫细胞成分等[11]。因此,此综述中,我们从VitD与癌症可能的作用机制出发,回顾VitD及其基因多态性与肺癌的关系,从而得出肺癌诊断、预防及治疗方面的最新发现。
1 VitD的概述与流行病学
VitD是一种类固醇激素,它主要以1,25(OH)2D3
的活性形式存在人的机体内,主要通过紫外线照射皮肤产生,少量来源于食物。经过阳光照射皮肤产生的最初的VitD是无活性的,通过肝脏和肾脏的活化,分别代谢为25(OH)D3及1,25(OH)2D3,后者为活性形式,可增加小肠中钙的吸收及肾脏中钙和磷酸盐的吸收,它还有助于平衡骨骼中的钙盐沉积。最近的证据显示,VitD除了有调节钙磷代谢的作用之外,在其他途径如控制能量代谢、调节自身免疫等过程中发挥重要作用[12]。由于免疫细胞和癌细胞具有共同的途径,同时活性VitD是VDR高亲和力配体,因此可通过具有转录功能的VDR诱导健康和肿瘤细胞的基因表达管控其增殖、分化和凋亡,故而,VitD信号传导也会在肿瘤细胞的增殖、分化和凋亡等过程中发挥至关重要的作用。这些开创性的认识促使人们对VitD和癌症之间的关系进行更深入的研究。流行病学资料显示,VitD不足与多种肿瘤的高风险和不良预后存在显著相关[11]。Garland等[13]最早提出低水平血清25(OH)D可能与大肠癌的发生率有关,随后大量的荟萃分析亦证实了这一假说[14-15]。越来越多的研究显示低水平血清VitD与多种肿瘤的发生有关,包括乳腺癌、肝癌、白血病及肺癌等[16-19]。国外多项荟萃分析中也表明,VitD水平越高,癌症的发生风险越低[20-21]。这些新的研究证据有效地支持了VitD对癌症具有保护作用的假说。
2 VitD参与肺癌的相关作用机制
2.1 VitD代谢过程 维生素D3 80%~90%由紫外线照射皮肤合成,10%~20%由饮食摄入,在肝脏、肾脏中分别代谢为25(OH)D3及活性1,25(OH)2D3
(图1),其中代谢中的25-羟化酶、25(OH)D-1α-羟化酶和25(OH)D3-24-羟化酶均由细胞色素P450(CYP450)酶系统来编码[22]。1,25(OH)2D3通过与VDR及RXR(维甲酸X受体)联合后形成异二聚体,配体活化后的异二聚体复合物与TAGAP基因VDREs(VitD反应元件)结合从而诱导基因表达(图2),通过调节细胞免疫,调控细胞周期,诱导细胞凋亡等来发挥其重要生物学活性[23]。
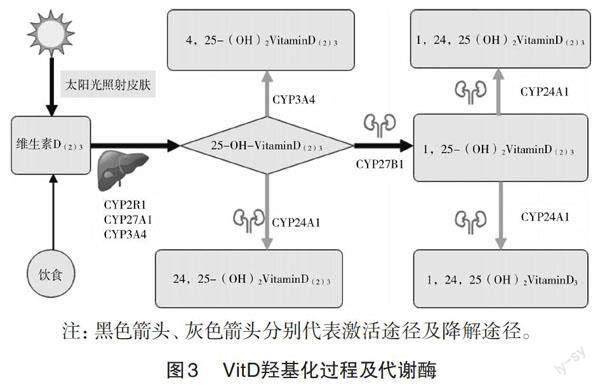
2.2 VitD的在肺组织中的代谢(图3) 参与VitD代谢的酶主要有25-羟化酶、25(OH)D-1α-羟化酶和25(OH)D3-24-羟化酶,都由CYP450编码,其中25-羟化酶主要由CYP2R1、CYP27A1及CYP3A4进行基因编码,25(OH)D-1α-羟化酶主要由CYP27B1编码[24],25(OH)D3-24-羟化酶则由CYP24A1编码,它们分别参与维生素D3的激活与降解,对维持维生素D3水平的平衡尤其重要[25]。现有的资料显示无活性VitD所需要的酶由CYP24A1和CYP3A4参与编码[26]。CYP450酶系统广泛分布于各种组织器官中,主要在肝脏中,也可存在肺部正常支气管上皮细胞,目前大量的研究证据表明VitD系统中基因的多态性与肺癌之间有非常紧密的联系。
2.3 VitD系统在肺癌中的作用机制 目前国内外学者对于VitD系统中的VDR、CYP24A1、CYP27B1、CYP27A1、CYP2R1及CYP3A4等在肺组织中的异常表达及其基因的多态性与肺癌的关系取得了一定的研究进展。
2.3.1 VitD/VDR途径与肺癌的关系 VDR为亲核蛋白,可分为膜受体及核受体,膜受体调节钙磷代谢,而核受体则调节蛋白质的合成,VDR分为DNA结合区(DBD)及配体结合区(LBD)2个重要功能区,在VitD代谢途径中,DBD是VDR发挥转录功能的主要成分,而LBD则促进异二聚体复合物的形成,进一步调控基因的转录和表达,从而抑制肺癌的增殖、侵袭及转移,并诱导细胞分化[27]。
2.3.2 VDR在肺癌中的异常表达 Kim等[28]在肺腺癌的研究中发现核VDR表达较高的患者有生存率升高的趋势。Pineda等[29]在肺癌的研究中也发现高核VDR表达与总生存期(OS)改善有关,而细胞质VDR表达与OS没有关联。Khazan等[30]研究发现VDR mRNA在肺癌中过度表达与预后不良相关。以上研究为检测肺癌组织中VDR的表达水平对预测肺癌患者存活率提供了理论依据。
2.3.3 VDR基因多态性与肺癌的易感性和预后 VDR基因多态性取决于它的多个酶切位点,并可能与肺癌的发生及预后相关,Cdx-2、Fok Ⅰ、Tag Ⅰ、Bsm Ⅰ、
Apa Ⅰ等是目前的研究热点。Zhou等[31]研究发现VDR Cdx-2型与肺鳞癌预后较好相关。Heist等[32]研究表明VDR Fok Ⅰ型与进展期肺癌预后不良相关。Pineda等[29]观察了194例来自西班牙南部的非小细胞肺癌(NSCLC)患者,结果显示,VDR rs11568820(Cdx-2)、VDR rs731236(Taq Ⅰ)和VDR rs7975232(Apa Ⅰ)多态性与NSCLC的生存率相关。Gnagnarella等[33]的综合荟萃分析顯示,与野生型的Bsm Ⅰ多形蛋白相比,发现纯合子和杂合子变体发生肺癌的风险显著降低;对Bsm Ⅰ
(rs1544410)、Taq Ⅰ (rs731236)、VDR Fok Ⅰ (rs2228570)、Apa Ⅰ (rs7975232)、Cdx2 (rs11568820)和肺癌风险相关性进行最全面的综合,结果显示Fok Ⅰ、Bsm Ⅰ、Cdx2、Apa Ⅰ和Taq Ⅰ与肺癌易感性相关。总之,VDR基因多态性与肺癌易感性及存活率有关,其研究结果的差异可能与遗传变异、种族差异、肺癌分期、样本量大小及研究方案的设计等因素相关,因关联性仍不十分明确,值得进一步深入研究。
2.3.4 CYP450酶系统在肺癌组织中的异常表达 CYP24A1、CYP27B1、CYP27A1、CYP2R1及CYP3A4均属于CYP450酶家族成员,是VitD代谢途径的5个重要的酶,其中与肺癌关联性研究最多的是CYP24A1、CYP27B1及CYP27A1。CYP24A1被认为是致癌基因,它可能通过消除1,25(OH)2D3的局部抗癌作用而促进肿瘤的侵袭性。研究表明,与正常组织相比,CYP24A1在肺癌组织中过度表达[34-35]。Shiratsuchi等[36]确定了CYP24A1的致癌潜力,其过表达与癌细胞的增殖潜力相关,且CYP24A1扩增的肺腺癌和Kras突变的肺腺癌中存在遗传互斥性。以上研究表明CYP24A1可能是治疗肺癌的一个新靶点,将会为CYP24A1抑制剂用于肺癌治疗提供依据。CYP27B1是唯一能激活VitD的酶,可以提高活性VitD的水平[37]。Kong等[38]研究发现,CYP27B1在NSCLC组织和正常组织中的表达有显著差异,且CYP27B1高表达与NSCLC较好的总生存率相关。Ge等[39]应用逆转录-定量聚合酶链反应分析NSCLC组织中CYP24A1 mRNA、CYP27B1和CYP27A1的表达,结果显示,NSCLC中CYP24A1 mRNA和CYP27B1表达均上调,CYP24A1表达与病理类型、分化程度和预后有关,CYP27B1表达与TNM分期、分化和预后显著相关,故CYP24A1和CYP27B1被视為NSCLC的独立预后因素,并可能成为辅助临床诊断、预后评估及治疗的新靶点。
2.3.5 CYP24A1、CYP27B1及CYP2R1基因多态性与肺癌的易感性和存活率 由于单核苷酸多态性(SNPs)在人类基因组中的遗传变异形式最为丰富,因此鉴定肺癌易感性相关的SNPs将有助于进行肺癌早期诊断及风险预测,对降低肺癌的死亡率有重要意义[40]。Wu等[41]研究发现CYP24A rs6068816纯合子的NSCLC风险可能降低54%,携带CT和TT基因型显示对NSCLC有更强的保护作用,并且发现CYP24A rs6068816与NSCLC风险之间关联的可能原因是CYP24A1可以逃避生长控制。Qu等[42]研究也得出了相似的结论。然而Pineda等[29]研究却显示,CYP24A1 rs6068816多态性的TT基因型比携带C等位基因的NSCLC患者疾病进展和死亡风险更高。Wu等[40]还发现CYP24A1 rs2181874突变纯合显著增加NSCLC风险。Xiong等[43]单位点分析表明,CYP24A1 rs6022999与肺癌风险显著相关,单体型GTAT及ATGC与肺癌风险降低相关,因此,rs6022999可能是中国人肺癌易感性遗传生物标记。由于大多数全基因组关联分析(GWAS)报道的风险相关变异体发现于非编码区,而非翻译区报道很少,Zhuo等[44]首次较为集中研究CYP24A1(rs4809957)3UTR(基因mRNAs的3个非翻译区)的SNPs与肺癌风险的关联,虽未发现与肺癌易感性有关联,却发现与肺癌的TNM分期和淋巴结转移相关,但需要继续扩大样本量和优化分组来进一步研究这种变异与肺癌的风险关联,以便找到更多可能的基因多态性调控位点来评估肺癌发生风险。Pineda等[29]发现CYP27B1(rs4646536)多态性与NSCLC生存率相关,并且可能作为NSCLC预后的重要标志物。最近一项研究表明,CYP2R1基因中SNP rs10741657与NSCLC患者死亡风险相关,且发现GG和AG基因型NSCLC患者OS优于AA基因型患者[44]。但目前文献尚缺乏对CYP27B1及CYP2R1基因多态性完整信息的总结。综上所述,CYP24A1、CYP27B1及CYP2R1基因多态性可作为NSCLC独立预后因子,并可能成为协助临床诊断、治疗和预后的新靶点,然而,它们参与NSCLC发病的确切机制尚不十分明确,仍需要额外大量研究样本来验证以上结论。
3 VitD抑制剂靶向治疗探索
CYP24A1是治疗肺癌的一个潜在靶点,研发特异性CYP24A1抑制剂是治疗肺癌的重要的方向。目前发现CYP24A1抑制剂四氢萘酮化合物KD-35联合1,25-D3会显著抑制结直肠癌(CRC)细胞系CaCO-2细胞的增殖[45-46]。另一种CYP24A1抑制剂阿司咪唑通过抑制CYP24A1表达和增强VDR表达以增强骨化三醇抑制不同癌细胞的增殖[47]。研究发现,阿司咪唑与化疗药物产生协同作用,并诱导NSCLC对化疗的敏感性和多药耐药性的逆转[48]。Chávez-López[47]等发现阿司咪唑和吉非替尼联合治疗肺癌可降低人肺癌细胞系A549细胞中的Eag Ⅰ mRNA水平和蛋白表达,并且诱导这些细胞中通道蛋白的亚细胞定位变化,能够更好地抑制肺癌细胞增殖,提高细胞系的存活,这项研究表明,阿司咪唑-吉非替尼联合用药可能是治疗肺癌患者较为有前途的新疗法。有研究发现金雀异黄素类似物可以有效抑制肺癌细胞的生长,且较少发生高钙血症[49]。大豆异黄酮及衍生物也是一种CYP24A1抑制剂,在体外实验中发现它可抑制肺癌A549及H1299细胞的增殖,但其用药浓度及潜在的副作用尚不十分明确[50]。VitD类似物也属于CYP24A1抑制剂的范畴,在抗癌领域中被广泛地研究,在多种肿瘤中已经被证实具有抗增殖、抑制转移、免疫调节等作用,其中MART-10[19-去甲-2α-(3-羟丙基)-1α,25(OH)2D3]被认为是癌症治疗非常有前途的候选物,但需要进一步的体内试验研究来验证[51-53]。然而,VitD类似物与肺癌关系的研究并不十分明确,仅有少部分研究在小鼠Levis肺癌(LLC)模型及在体外研究A549人肺癌模型中进行[54-55]。Biyani等[56]最新研究中以CYP24为阳性靶蛋白,以CYP27B1为反靶蛋白,鉴定了一种新的基于70-nt DNA适体的CYP24抑制剂即Apt-7,它与CYP24的亲和力比CYP27B1高5.8倍,它能选择性抑制CYP24,此外,Apt-7通过内吞作用在CYP24过表达的A549肺腺癌细胞中显示细胞内化,并在癌细胞中诱导抗增殖活性,这种新型适体Apt-7提供了一种识别和抑制CYP24的新探针,有助于肺癌的诊断和治疗。
CYP24抑制被認为是癌症潜在的治疗方法,但由于它的非特异性、耐药性和潜在的不良反应限制了其临床的运用。迄今为止,CYP24A1抑制剂和VitD类似物在肺癌治疗中的临床研究仍比较有限,CYP24A1的特异性抑制剂能否安全有效地应用于肺癌的临床治疗中,以及如何更好地与VitD协同治疗肺癌,尚需进一步深入的研究。总之,VitD系统基因多态性的研究将指导肺癌的诊断及个性化治疗,有助于肺癌预后评估及药物的研发,对进一步攻克肺癌至关重要。
参考文献
[1] SUNG H,FERLAY J,SIEGEL R L,et al.Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2021,71(3):209-249.
[2] SONGYANG Y,SONG T,SHI Z,et al.Effect of vitamin D on malignant behavior of non-small cell lung cancer cells[J].Gene,2021,768:145309.
[3] HUANG Y,LEI L,LIU Y.Propofol improves sensitivity of lung cancer cells to cisplatin and its mechanism[J/OL].Med Sci Monit,2020,26:e919786.https://pubmed.ncbi.nlm.nih.gov/32225124/.
[4] HASSAN W A,YOSHIDA R,KUDOH S,et al.Notch1 controls cell chemoresistance in small cell lung carcinoma cells[J].Thorac Cancer,2016,7(1):123-128.
[5] GRAZIANO S,JOHNSTON R,DENG O,et al.Vitamin D/vitamin D receptor axis regulates DNA repair during oncogene-induced senescence[J].Oncogene,2016,35(41):5362-5376.
[6] EL-SHARKAWY A,MALKI A.Vitamin D signaling in inflammation and cancer: molecular mechanisms and therapeutic implications[J].Molecules,2020,25(14):3219.
[7] LI M,CHEN P,LI J,et al.Review: the impacts of circulating 25-hydroxyvitamin D levels on cancer patient outcomes: a systematic review and meta-analysis[J].J Clin Endocrinol Metab,2014,99(7):2327-2336.
[8] CHEN G C,ZHANG Z L,WAN Z,et al.Circulating 25-hydroxyvitamin D and risk of lung cancer: a dose-response meta-analysis[J].Cancer Causes Control,2015,26(12):1719-1728.
[9] WEI H,JING H,WEI Q,et al.Associations of the risk of lung cancer with serum 25-hydroxyvitamin D level and dietary vitamin D intake: a dose-response PRISMA Meta-anlysis[J/OL].Medicine (Baltimore),2018,97(37):e12282.https://pubmed.ncbi.nlm.nih.gov/30212966/.
[10] SUN K,ZUO M,ZHANG Q,et al.Anti-tumor effect of vitamin d combined with calcium on lung cancer: a systematic review and Meta-analysis[J].Nutr Cancer,2021,73(11-12):2633-2642.
[11] CARLBERG C,VELLEUER E.Vitamin D and the risk for cancer: a molecular analysis[J].Biochem Pharmacol,2022,196:114735.
[12] CARLBERG C,MU?OZ A.An update on vitamin D signaling and cancer[J].Semin Cancer Biol,2022,79:217-230.
[13] GARLAND C F,GARLAND F C.Do sunlight and vitamin D reduce the likelihood of colon cancer?[J].Int J Epidemiol,1980,9(3):227-231.
[14] WU G,XUE M,ZHAO Y,et al.Low circulating 25-hydroxyvitamin D level is associated with increased colorectal cancer mortality: a systematic review and dose-response meta-analysis[J].Biosci Rep,2020,40(7):BSR20201008.
[15] XU Y,QIAN M,HONG J,et al.The effect of vitamin D on the occurrence and development of colorectal cancer: a systematic review and meta-analysis[J].Int J Colorectal Dis,2021,36(7):1329-1344.
[16] VOUTSADAKIS I A.Vitamin D baseline levels at diagnosis of breast cancer: a systematic review and Meta-analysis[J].Hematol Oncol Stem Cell Ther,2021,14(1):16-26.
[17] YI Z,WANG L,TU X.Effect of vitamin D deficiency on liver cancer risk: a systematic review and Meta-analysis[J].Asian Pac J Cancer Prev,2021,22(4):991-997.
[18] MADDHESHIYA S,SINGH S K,KUMAR I,et al.Bone mineral metabolism during chemotherapy in childhood acute lymphoblastic leukemia[J].J Pediatr Hematol Oncol,2021,43(5):172-175.
[19] FENG Q,ZHANG H,DONG Z,et al.Circulating 25-hydroxyvitamin D and lung cancer risk and survival: a dose-response meta-analysis of prospective cohort studies[J/OL].Medicine (Baltimore),2017,96(45):e8613.https://pubmed.ncbi.nlm.nih.gov/29137092/.
[20] XU J,YUAN X,TAO J,et al.Association of circulating 25-hydroxyvitamin D levels with colorectal cancer: an updated Meta-analysis[J].J Nutr Sci Vitaminol (Tokyo),2018,64(6):432-444.
[21] QIAN M,LIN J,FU R,et al.The role of vitamin D intake on the prognosis and incidence of lung cancer: a systematic review and Meta-analysis[J].J Nutr Sci Vitaminol (Tokyo),2021,67(5):273-282.
[22]李榕,韓宝惠.维生素D与肺癌[J].肿瘤,2010,30(5):443-446.
[23] SHRI P M,PREMKUMAR K,ASHA D S.Molecular docking study on vitamin D supplements to understand their interaction with VDR-RXRα heterodimer and VDRE of TAGAP gene[J].
J Biomol Struct Dyn,2022,24:1-10.
[24] CHENG J B,LEVINE M A,BELL N H,et al.Genetic evidence that the human CYP2R1 enzyme is a key vitamin D 25-hydroxylase[J].Proc Natl Acad Sci USA,2004,101(20):7711-7715.
[25] SHINKYO R,SAKAKI T,KAMAKURA M,et al.Metabolism of vitamin D by human microsomal CYP2R1[J].Biochem Biophys Res Commun,2004,324(1):451-457.
[26] FERN?NDEZ-ARAQUE A,GIAQUINTA-ARANDA A,MORENO-SAINZ C,et al.Haplotypes in the GC, CYP2R1 and CYP24A1 genes and biomarkers of bone mineral metabolism in older adults[J].Nutrients,2022,14(2):259.
[27] PIKE J W,MEYER M B,BISHOP K A.Regulation of target gene expression by the vitamin D receptor - an update on mechanisms[J].Rev Endocr Metab Disord,2012,13(1):45-55.
[28] KIM S H,CHEN G,KING A N,et al.Characterization of vitamin D receptor (VDR) in lung adenocarcinoma[J].Lung Cancer,2012,77(2):265-271.
[29] PINEDA LANCHEROS L E,P?REZ RAM?REZ C,S?NCHEZ MART?N A,et al.Impact of genetic polymorphisms on the metabolic pathway of vitamin D and survival in non-small cell lung cancer[J].Nutrients,2021,13(11):3783.
[30] KHAZAN N,KIM K K,HANSEN J N,et al.Identification of a vitamin-D receptor antagonist, MeTC7, which Inhibits the Growth of Xenograft and transgenic tumors in vivo[J].J Med Chem,2022,65(8):6039-6055.
[31] ZHOU W,HEIST R S,LIU G,et al.Polymorphisms of vitamin D receptor and survival in early-stage non-small cell lung cancer patients[J].Cancer Epidemiol Biomarkers Prev,2006,15(11):2239-2245.
[32] HEIST R S,ZHOU W,WANG Z,et al.Circulating 25-hydroxyvitamin D, VDR polymorphisms, and survival in advanced non-small-cell lung cancer[J].J Clin Oncol,2008,26(34):5596-5602.
[33] GNAGNARELLA P,RAIMONDI S,ARISTARCO V,et al.
Ethnicity as modifier of risk for vitamin D receptors polymorphisms: comprehensive meta-analysis of all cancer sites[J].Crit Rev Oncol Hematol,2021,158:103202.
[34] KING A N,BEER D G,CHRISTENSEN P J,et al.The vitamin D/CYP24A1 story in cancer[J].Anticancer Agents Med Chem,2010,10(3):213-224.
[35] RAMNATH N,NADAL E,JEON C K,et al.Epigenetic regulation of vitamin D metabolism in human lung adenocarcinoma[J].J Thorac Oncol,2014,9(4):473-482.
[36] SHIRATSUCHI H,WANG Z,CHEN G,et al.Oncogenic potential of CYP24A1 in lung adenocarcinoma[J].J Thorac Oncol,2017,12(2):269-280.
[37] LATACZ M,SNARSKA J,KOSTYRA E,et al.Single nucleotide polymorphisms in 25-hydroxyvitamin D3 1-alpha-hydroxylase (CYP27B1) gene: the risk of malignant tumors and other chronic diseases[J].Nutrients,2020,12(3):801.
[38] KONG J,XU F,QU J,et al.Genetic polymorphisms in the vitamin D pathway in relation to lung cancer risk and survival[J].Oncotarget,2015,6(4):2573-2582.
[39] GE N,CHU X M,XUAN Y P,et al.Associations between abnormal vitamin D metabolism pathway function and non-small cell lung cancer[J].Oncol Lett,2017,14(6):7538-7544.
[40]屈若祎.CYP24A1基因單核苷酸多态性对女性肺癌发生及预后的作用及相关机制研究[D].沈阳:中国医科大学,2019.
[41] WU X,CHENG J,YANG K.Vitamin D-related gene polymorphisms, plasma 25-hydroxy-vitamin D, cigarette smoke and non-small cell lung cancer (NSCLC) risk[J].Int J Mol Sci,2016,17(10):1597.
[42] QU R,LI X,QUAN X,et al.Polymorphism in CYP24A1 is associated with lung cancer risk: a case-control study in Chinese female nonsmokers[J].DNA Cell Biol,2019,38(3):243-249.
[43] XIONG Q,JIAO Y,YANG P,et al.The association study between CYP24A1 gene polymorphisms and risk of liver, lung and gastric cancer in a Chinese population[J].Pathol Res Pract,2020,216(12):153237.
[44] ZHUO M,ZHUANG X,TANG W,et al.The Impact of IL-16 3'UTR Polymorphism rs859 on lung carcinoma susceptibility among Chinese han individuals[J].Biomed Res Int,2018,2018:8305745.
[45] KONG J,CHEN X,WANG J,et al.Genetic polymorphisms in the vitamin D pathway and non-small cell lung cancer survival[J].Pathol Oncol Res,2020,26(3):1709-1715.
[46] K?SA J P,HORV?TH P,W?LFLING J,et al.CYP24A1 inhibition facilitates the anti-tumor effect of vitamin D3 on colorectal cancer cells[J].World J Gastroenterol,2013,19(17):2621-2628.
[47] CH?VEZ-L?PEZ M G,Z??IGA-GARC?A V,HERN?NDEZ-GALLEGOS E,et al.The combination astemizole-gefitinib as a potential therapy for human lung cancer[J].Onco Targets Ther,2017,6(10):5795-5803.
[48] ELLEGAARD A M,DEHLENDORFF C,VIND A C,et al.
Repurposing cationic amphiphilic antihistamines for cancer treatment[J].EBioMedicine,2016,9:130-139.
[49]龐田田,李游山,白瑜,等.基于CYP24A1的癌症治疗研究进展[J].陕西理工学院学报(自然科学版),2016,32(3):65-70,77.
[50]江文斌.大豆异黄酮及衍生物对肺癌细胞增殖和凋亡的影响[D].南昌:南昌大学,2017.
[51] PAWLIK A,ANISIEWICZ A,FILIP-PSURSKA B,et al.
Divergent effect of tacalcitol (PRI-2191) on Th17 Cells in 4T1 tumor bearing young and old ovariectomized mice[J].Aging Dis,2020,11(2):241-253.
[52] YANG S W,TSAI C Y,PAN Y C,et al.MART-10, a newly synthesized vitamin D analog, represses metastatic potential of head and neck squamous carcinoma cells[J].Drug Des Devel Ther,2016,10:1995-2002.
[53] CHIANG K C,YEH T S,HUANG C C,et al.MART-10 represses cholangiocarcinoma cell growth and high vitamin D receptor expression indicates better prognosis for cholangiocarcinoma[J].Sci Rep,2017,7:43773.
[54] WIETRZYK J,CHODY?SKI M,FITAK H,et al.Antitumor properties of diastereomeric and geometric analogs of vitamin D3[J].Anticancer Drugs,2007, 18(4):447-457.
[55] MAJ E,FILIP-PSURSKA B,?WITALSKA M,et al.Vitamin D analogs potentiate the antitumor effect of imatinib mesylate in a human A549 lung tumor model[J].Int J Mol Sci,2015,16(11):27191-27207.
[56] BIYANI M,YASUDA K,ISOGAI Y,et al.Novel DNA aptamer for CYP24A1 inhibitionwith enhanced antiproliferative activity in cancer cells[J].ACS Appl Mater Interfaces,2022,14(16):18064-18078.
(收稿日期:2022-11-03) (本文编辑:陈韵)

