非酒精性脂肪性肝炎治疗靶点和靶向药物研发进展
李国超 于嫚 李晓菲 张九一
摘 要:介绍了治疗非酒精性脂肪性肝炎的相关靶点和靶向药物研发方面的进展,分别简述了过氧化物酶体增殖物激活受体、乙酰辅酶A羧化酶、胰高血糖素样肽-1、甲状腺激素受体β、法尼醇X受体、成纤维细胞生长因子19/21、凋亡信号调节激酶1和C-C趋化因子受体2/5等多种非酒精性脂肪性肝炎治疗新靶点,分析了靶点相关药物及其在治疗非酒精性脂肪性肝炎的研发进展及其优缺点。分析表明,通过探索非酒精性脂肪性肝炎的相关靶点及研发的靶向药物,有助于解除非酒精性脂肪性肝炎给人类健康带来的巨大威胁。基于此,对其发展前景进行展望,指出今后可以在以下方面对治疗非酒精性脂肪性肝炎进行深入研究:1)找到非酒精性脂肪性肝炎主要致病机理,从源头治疗非酒精性脂肪性肝炎;2)针对非酒精性脂肪性肝炎的不同靶点进行药物联合治疗;3)研发新的治疗技术(基因疗法、核酸药物以及抗体偶联药物等),将其应用到非酒精性脂肪性肝炎治疗领域。
关键词:药物化学;非酒精性脂肪性肝炎;发病机制;靶点;靶向药物
中图分类号:R914 文献标识码:A DOI: 10.7535/hbgykj.2023yx03009
Therapeutic targets and targeted drug development for
non-alcoholic steatohepatitis
LI Guochao YU Man LI Xiaofei ZHANG Jiuyi
(1.New Drug Research and Development Company of NCPC, Shijiazhuang, Hebei 050015, China; 2.National Engineering Research Center of Microbial Medicine, Shijiazhuang, Hebei 050015, China; 3.Hebei Industry Microbial Metabolic Engineering and Technology Research Center, Shijiazhuang, Hebei 050015, China; 4.School of Chemical and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
Abstract:The progress in the development of relevant targets and targeted drugs for the treatment of non-alcoholic steatohepatitis (NASH) was presented, and various NASH targets such as peroxisome proliferator-activated receptors, acetyl-CoA carboxylase, glucagon-like peptide-1, thyroid hormone receptor β, farnesoid X receptor, fibroblast growth factor receptor 19 and 21, apoptosis signal-regulating kinase-1, C-C chemokine receptor types 2 and 5, respectively, were briefly described. The research progress, advantages and disadvantages of target-related drugs in the treatment of NASH were analyzed. The analysis shows that the great threat to human health posed by NASH can be solved by exploring the relevant targets of NASH and developing targeted drugs. Based on this, the prospect of its development is prospected, and it is pointed out that in-depth research on the treatment of NASH can be conducted in the following aspects: 1) identifying the main pathogenic mechanism of NASH and treating NASH at the source; 2) drug combination therapy for different targets of NASH; 3) developing new therapeutic technologies such as gene therapy, nucleic acid drugs, and antibody-coupled drugs for the treatment of NASH.
Keywords:pharmaceutical chemistry; non-alcoholic steatohepatitis; pathogenesis; targets; targeted drug
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)是非酒精性脂肪性肝病的最嚴重亚型,是一种潜在的进展性肝病,患者肝脏肿大,肝脏脂肪变性,炎症反应增加,肝纤维化增加,可进一步发展为肝硬化、肝细胞癌,甚至导致死亡[1]。随着生活水平的提高,NASH已经成为当代社会高发的慢性病之一,全球范围内NASH的患病率为3%~5%,死亡率为25.56%[2]。估计到2030年,中国的NASH患者数将达到4 826万[3]。针对NASH晚期的治疗,目前尚无主流药物获批上市,肝移植可能是患者的唯一选择。NASH目前是肝移植的第二大适应症,患者移植后生存期显著延长,未来几年有望成为第一大适应症[4]。NASH给患者家庭和社会带来了沉重负担。NASH药物治疗的意义是尽可能降低患者的死亡率,减少肝脏及心血管等并发症发生率,有效避免NASH病变为肝硬化、肝细胞癌甚至导致死亡,减轻患者的临床症状以及提高生活质量。目前研发的药物在临床试验中存在瘙痒、肝损伤和心血管疾病风险等副作用,寻找高效安全的NASH治疗药物迫在眉睫。本文阐述了NASH的发病机制、治疗靶点以及相关靶点药物的研发进展,以期为今后NASH药物研发提供思路。
1 非酒精性脂肪性肝炎概述
NASH的发病机制非常复杂,被广泛接受的病理解释是二次打击假说,第1次打击是肝内脂类及脂肪堆积和变性,第2次打击是在此基础上的多种炎症因子和代谢副产物的积累[5]。研究进一步发现NASH是由多种风险因素(例如:脂质代谢紊乱、胰岛素抗性、氧化应激、纤维化、慢性炎症反应等)和多器官、多细胞类型相互作用的结果[6]。胰岛素抵抗是NASH发生的关键因素之一,饮食习惯以及遗传等因素可引起胰岛素抵抗,导致肝脏新生脂肪生成增加,对脂肪组织降解的抑制作用减弱,以及肝脏中脂肪酸积累[7]。甘油三酯合成以及脂肪分解紊乱导致脂肪细胞释放更多的游离脂肪酸,并由于脂肪细胞摄取受损而增加血糖水平,这会触发肝脏中脂肪酸的进一步合成,生成有毒的脂肪酸代谢物,导致肝脏中新生脂肪生成增加,这与NASH也有显著关系[8]。胰岛素抵抗还可以通过脂肪细胞释放促炎细胞因子,进一步促使炎症细胞进入肝脏,从而导致肝脏炎症。肝细胞脂肪含量和肝脏炎症环境也会加剧NASH发展[9]。
早期,治疗NASH的主要方式是改变生活方式和减肥手术[10-11]。然而,这种非侵入性和直接的疗法并不十分有效,尤其是对于伴有肝硬化和终末期肝病的NASH患者。国内NASH的主要治疗药物是针对肝损伤的保肝类药物,如:水飞蓟素、双环醇、多烯磷酰胆碱、甘草酸二铵、还原性谷胱苷肽、S-腺苷甲硫氨酸以及熊去氧胆酸等。目前还没有针对NASH的主流药物上市,Saroglitazar于2020年3月获得印度药品监督管理局的批准,成为全球首个获批的非肝硬化NASH治疗药物,但其疗效尚未得到明确阐明。
2 NASH治疗靶点
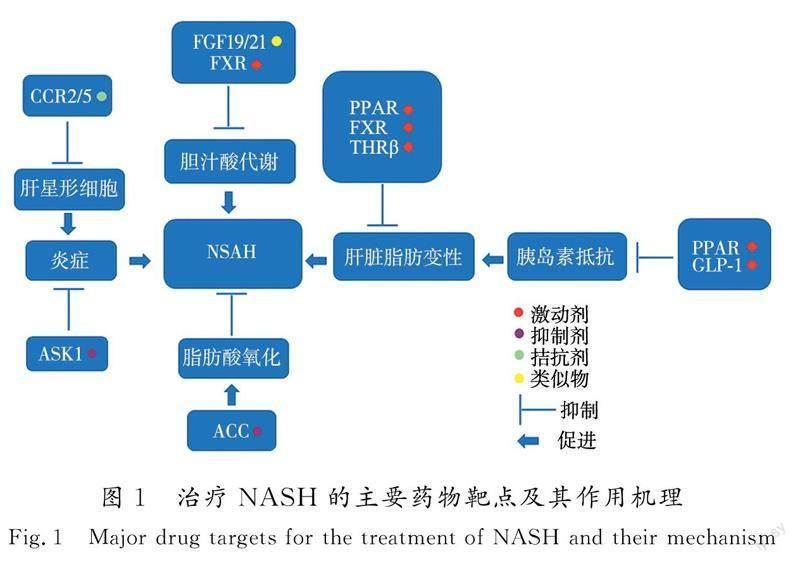
NASH复杂的发病机制导致了NASH药物研发的靶点相对较多,但基本是围绕调控能量代谢[10]、葡萄糖代谢、胆汁酸代谢、炎症[12]和纤维化[13]等进行NASH药物研发,多款药物已进入临床试验阶段,并且在临床研究中也看到了降低肝脏脂肪、改善炎症和纤维化的效果[14]。其中,与糖脂代谢调节相关的靶点包括:过氧化物酶体增殖物激活受体(peroxisome proliferator activated-receptor,PPAR)、乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)、胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)、甲状腺激素受体(thyroid hormone receptor,THR);与胆汁酸代谢调节相关的靶点包括:法尼醇X受体(farnesoid X receptor,FXR)、成纤维细胞生长因子19/21(fibroblast growth factor receptor 19/21,FGF19/21);与炎症反应相关的靶点包括:凋亡信号调节激酶1(apoptosis signal regulating kinase-1,ASK1)、C-C趋化因子受体2型和5型(C-C chemokine receptor types 2 and 5,CCR2/5)。以上只是基于已知靶点进行的大致分类,其中有的靶点作用机制不止一种。这些靶点被广泛认为是开发NASH治疗药物的重要靶点,相关靶点及其作用机制如图1所示。
2.1 基于糖脂代谢调节的NASH治疗靶点
2.1.1 PPAR
PPAR是一类由配体激活的核转录因子,属于核受体超家族成员,是一类可以被过氧化物酶体增殖物激活的转录因子。其包括PPARα,PPARβ及PPARγ 3种亚型[15]:PPARα主要在肝脏中表达;PPARβ主要表达于骨骼肌,在脂肪组织和皮肤中也有表达;PPARγ在脂肪组织中高表达。当激活配体与特定的PPAR结合后,PPAR与维甲酸X受体(retinoid X receptor,RXR)形成异源二聚体,与DNA上特定的过氧化物酶体增殖物反应元件结合,从而导致其下游靶基因的转录[16]。PPAR在脂肪酸新陈代谢、炎症反应、细胞凋亡、平滑肌细胞迁移和增殖、动脉粥样硬化、胰岛素抵抗、糖代谢以及肥胖中都起到重要的调节作用[17-18]。PPAR通过调控丝裂原活化蛋白激酶信号通路、线粒体β氧化信号通路、核转录因子κB信号通路等参与NASH的发生发展[19-20],从而成为研发NASH治疗药物的重要靶点。
PPAR的3种亚型PPARα,PPARβ以及PPARγ在发挥生物学功能上有重叠,也有差异的地方。如果可以同时对这3个亚型有作用,可能会展现出比单一受体更优的治疗效果。
2.1.2 ACC
脂肪酸从头合成在NASH患者的脂肪酸代谢和肝细胞内甘油三酯积累中發挥着重要作用[21]。ACC可以将乙酰辅酶A转化为丙二酰辅酶A,这是脂肪酸从头合成的一个限速步骤[22]。丙二酰辅酶A进一步通过抑制肉碱棕榈酰转移酶调控肝脏内线粒体脂肪氧化[23]。ACC有2种亚型:ACC1主要存在于脂肪生成组织的胞质中,如肝脏和脂肪组织;ACC2则主要存在于氧化组织的线粒体中[24]。有研究发现ACC2基因敲除小鼠在高脂肪或高脂肪、高碳水化合物饮食条件下,体内脂肪酸氧化率较高,脂肪积累较少。
与野生型小鼠相比,ACC2基因敲除小鼠血液中非酯化脂肪酸和甘油三酯水平更低,代谢综合征得到改善,表明ACC2可以防止饮食诱导的肥胖,并维持全身和肝脏胰岛素敏感性,预防脂肪肝的发生[25],在控制脂肪酸氧化方面发挥重要作用,是治疗肥胖和相关疾病的潜在靶点[26]。
基于ACC1/ACC2在脂肪酸从头合成和脂肪酸β氧化中起核心作用,抑制ACC酶活性可以通过降低肝脏脂肪合成以及增加脂肪酸氧化来治疗NASH。
ACC1/ACC2活性抑制会产生一个普遍的副作用——高脂血症,临床上在针对此靶点进行药物开发时必须将此方面的因素考虑进去,需要进行联合给药或是采取其他方法以消减其副作用带来的不利影响。
2.1.3 GLP-1
GLP-1是一种对血糖控制和体重调节具有重要作用的肠促胰岛素激素,由肠道L细胞分泌产生,能够通过葡萄糖依赖的途径刺激胰岛素分泌[27]。GLP-1参与多种代谢途径的调控,包括依据葡萄糖浓度变化来调节胰岛素的分泌,减少胃排空,抑制食物摄入等[28]。GLP-1具有减少炎症和细胞凋亡的作用[29],并可通过诱导胰岛素分泌以及降低胰高血糖素分泌来有效降低血糖[30]。GLP-1类似物可降低脂肪肝小鼠模型中的肝脏脂肪变性和胰岛素抵抗[31],还可以改善2型糖尿病患者的血糖控制和降低体重[32]。2型糖尿病是NASH发病的主要危险因素之一,此外,肝脏和脂肪组织中的胰岛素抵抗已被视为NASH发病率和死亡率的关键驱动因素[33]。这使得GLP-1成为NASH治疗的极具吸引力的分子靶标。
NASH和2型糖尿病同属于代谢类的慢性病,有着紧密联系的致病机理,GLP-1作为治疗2型糖尿病的成熟靶点,其用药安全性展现出一定优势。
2.1.4 THRβ
甲状腺激素是哺乳动物代谢活动的重要调节剂,机体可以通过THR激活改变胆固醇和脂肪酸水平[34]。THR也是一种核受体,存在2种亚型:THRα和THRβ。其中,THRα在骨和心脏中高表达,而THRβ主要在肝脏表达[35]。研究发现,THRβ在NASH患者肝脏中的表达显著下降[36]。这是因为THRβ可以降低血脂,通过影响低密度脂蛋白胆固醇、血清甘油三酯和其他代谢因子来影响代谢过程,这些改变可以降低NASH患者的肝脏脂肪含量和肝脏脂肪毒性[37]。口服给与饮食诱导肥胖并伴有纤维化的晚期NASH模型小鼠THRβ激动剂,可以显著降低肝脏重量、肝脏脂肪变性、肝纤维化[38]。
THRβ受体在肝脏维持正常功能中发挥重要作用,其靶向药物在临床试验治疗中也取得了积极结果,此靶点的药物极有可能在NASH治疗中率先取得突破。
2.2 基于胆汁酸代谢调节的NASH治疗靶点
2.2.1 FXR
FXR是一种核受体,在肝脏和小肠中高表达,天然配体为胆汁酸[39]。FXR被活化后通过调节成纤维细胞生长因子19等基因的表达,减少肝脏中脂肪的生成以及糖异生,清除极低密度脂蛋白,改善胰岛素抗性等,还可以调节胆汁酸合成、脂质代谢、糖代谢、炎症以及纤维化等代谢通路[40-41]。NASH患者肝脏中FXR的表达水平与病情严重程度呈现负相关性[42]。有研究发现,激活FXR可以逆转肥胖Zucker大鼠模型的胰岛素抗性并缓解脂代谢异常[43]。FXR也逐渐成为NASH治疗的靶点。
靶向FXR已用于治疗多种肝脏疾病,但产生的副作用又限制其在临床上的应用,因此在NASH治疗领域应特别注意。
2.2.2 FGF19/21
FGF19/21配体是一种肠道激素,在回肠上皮细胞中表达,需要通过辅受体与FGF受体结合进行信号传递,在调节胆汁酸代谢中起核心作用,可以控制胆酸合成、脂肪生成和能量稳态[44]。FGF19主要在肠道中表达,参与胆汁酸代谢[45];FGF21在肝脏中高度表达,可以对抗高血糖、高游离脂肪酸和低氨基酸供应,通过在中枢神经系统和脂肪组织中调节能量、葡萄糖和血脂来保持体内平衡[46]。FGF19/21类似物可在多种NASH模型小鼠中降低肝脏脂肪变性[47],使得FGF19/21受到NASH药物研发者的关注。
基于FGF19/21研发的药物可以使肥胖症和2型糖尿病患者的体重减轻并减少NASH患者的脂肪变性。在实验动物体内,FGF19/21展现出降低血糖的作用,但是似乎并不能改善人类的血糖。此靶点还存在各种安全问题,包括低密度脂蛋白胆固醇的升高、血压升高等,这些副作用限制了针对此靶点单一用药治疗NASH。
2.3 基于抗炎的NASH治疗靶点
2.3.1 ASK1
ASK1是細胞凋亡信号调节激酶丝裂原活化蛋白激酶家族的成员,负责调控c-Jun氨基末端激酶和p38信号通路[48]。ASK1还是炎症信号通路中的一个关键分子,在肥胖人群和NASH患者肝脏中ASK1信号通路异常活化[49]。ASK1可促进脂质和葡萄糖代谢的调节,并驱动肝脏中的炎症反应,抑制ASK1活性可以改善NASH的进展[50]。多项研究表明,抑制ASK1可改善NASH动物模型的炎症和纤维化[51],ASK1成为NASH治疗颇具吸引力的靶点。
但有证据表明,一些癌症与ASK1介导的级联反应密切相关。未来,以ASK1为靶点治疗NASH的临床试验应该充分考虑其肿瘤发生的影响。
2.3.2 CCR2/5
CCR2/5及其各自的配体,即C-C趋化因子配体2型(C-C chemokine motif ligand 2,CCL2)和5型(C-C chemokine motif ligand 5,CCL5),在肝脏募集炎症细胞和肝星形细胞激活中发挥作用[52]。巨噬细胞介导的炎症反应和肝星形细胞激活是NASH多个阶段进展的关键驱动因素[52]。有研究证明CCR2/5敲除或药物抑制CCR2/5小鼠免疫细胞活化较低,肝纤维化减少[53-54]。CCR2/5拮抗剂可通过减少单核细胞浸润和改变肝脏巨噬细胞亚群来改善纤维化,并且CCR2/5拮抗剂已被证明能有效减少NASH动物模型肝纤维化[52]。因此,CCR2/5成为NASH药物开发的治疗靶点。
以CCR2/5为靶点治疗NASH的局限在于影响上游代谢机制导致纤维化进展,需要与改善脂肪变性的相关靶点药物联合使用。
3 NASH药物研发进展
3.1 基于糖脂代谢调节的NASH靶向药
3.1.1 PPAR激动剂
2020年,印度药品监督管理局批准PPARα/γ双重激动剂Saroglitazar上市,该药成为世界上第1款治疗非肝硬化性NASH的药物。Saroglitazar是一种新型的非噻唑烷二酮类和非纤维酸衍生物,通过激活PPARα/γ调控脂质和葡萄糖代谢[55]。一项Ⅱ期临床试验数据表明,Saroglitazar能够显著降低患者谷丙转氨酶的水平,并明显改善肝脏脂肪病变程度[56]。
Lanifibranor是Inventiva公司开发的泛PPAR激动剂,Ⅱb期临床研究结果显示其达到了主要终点,显著降低了脂肪变性、活动等级、纤维化评分。此外,Lanifibranor也达到了关键的次要终点,包括NASH消退、纤维化无恶化和肝纤维化改善[57]。2020年11月,美国食品药品监督管理局表示他们进行的一项关键性Ⅲ期临床试验的临床策略足以支持Lanifibranor新药申请,并授予该药治疗NASH的“突破性疗法”称号。
PPARα激动剂已被广泛用于治疗高甘油三酯血症,但对NASH治疗无显著影响。PPARγ激动剂具有降低血糖的功能,用于治疗糖尿病,但对NASH的治疗效果不佳。因PPARα/β双重激动剂在临床实验中没有达到NASH缓解且纤维化不恶化的治疗目标而被中止[55]。PPAR泛激动剂以一种均衡有效的方式靶向所有3种PPAR亚型,平衡激活PPARα,PPARβ和PPARγ,显示出优于其他PPAR激动剂的临床效果。因此,PPAR泛激动剂是未来基于PPAR靶点治疗NASH的研发方向。
3.1.2 ACC抑制剂
GS-0976是一种小分子ACC抑制剂,可抑制ACC1和ACC2的酶活性[58]。在细胞水平和动物水平可以减少脂肪酸合成并促进脂肪酸氧化。当长期给药GS-0976,可以减少饮食诱导的肥胖大鼠模型肝脏脂肪变性,改善胰岛素敏感性,在不影响食物摄入的情况下减少体重增加[59]。临床前和初步临床数据均证明有必要对GS-0976治疗NASH作进一步研究。
Gemcabene也是一种ACC抑制剂,可以减少肝脏中甘油三脂和胆固醇的合成。一项研究显示,Gemcabene能够调节NASH疾病模型小鼠的脂质代谢,减少脂肪生成,显著降低肝脏炎症的水平[60]。在临床试验中Gemcabene可以显著降低高脂血症患者的低密度脂蛋白胆固醇水平[61]。NASH的发病与血脂代谢异常密切相关,因此Gemcabene可作为治疗NASH的潜在药物。但Gemcabene的临床Ⅱ期试验被Gemphire Therapeutics公司宣布终止,原因是缺乏疗效和出于安全因素考虑。
ACC抑制剂诱导的高甘油三酯血症可以通过与其他药物联用被缓解。此外,ACC1选择性抑制也可能会减少甘油三酯升高的副作用,但其对心血管的长期影响需要进一步检测研究。
3.1.3 GLP-1受体激动剂
生物化学修饰可以增强GLP-1受体激动剂的效力和持续作用。GLP-1受体激动剂已成功用于2型糖尿病的临床治疗。目前多个GLP-1受体激动剂已进入NASH临床试验研究阶段。Semaglutide是一种新型的GLP-1受体激动剂,一项Ⅱ期临床试验表明Semaglutide使NASH患者症状缓解的比例明显高于对照组。虽然Semaglutide减轻了患者肝脏脂肪变性和肝损伤,但并未显著改善纤维化严重程度[62]。
胰岛素抵抗常见于NASH患者,并且通常与高血压、高脂血症和肥胖等代谢综合征的其他特征共存。尽管通过改变生活方式来减轻体重仍然是治疗NASH的重要手段,但事实证明,患者实现和维持减肥目标具有挑战性。因此,通常需要将生活方式的改变与GLP-1受体激动剂治疗相结合。
3.1.4 THRβ激动剂
Resmetirom (MGL-3196)是一种以肝脏为导向,具有口服活性、选择性的THRβ激动剂。一项多中心、随机、双盲、安慰剂对照的Ⅱ期临床试验表明,Resmetirom使NASH患者的肝脂肪显著减少[63]。另一项Ⅱ期临床试验研究显示,THRβ激动剂VK2809治疗12周后,患者低密度脂蛋白胆固醇以及肝脏脂肪含量显著降低。
因此,THRβ激动剂在治疗NASH的临床试验中,具有降低肝脏脂肪含量、恢复肝功能以及治疗血脂异常的强大潜力,有希望被成功开发为NASH的治疗药物。
3.2 基于胆汁酸代谢调节的NASH靶向药
3.2.1 FXR激动剂
奥贝胆酸是鹅去氧胆酸的合成类似物,比天然胆汁酸具有更强的FXR激动效果[64]。在一项Ⅲ期临床试验中,奥贝胆酸在NASH没有恶化的情况下达到了纤维化改善的临时组织学终点,现在正在对患者进行长期临床结果的随访[65]。但是2020年6月美国食品药品监督管理局认为,奥贝胆酸在临床试验的中期组织学终点数据带来的获益具有不确定性,拒绝了其的上市申请。
EDP305是一种新型非胆汁酸结构的FXR激动剂,可有效改善模型小鼠的肝损伤和肝纤维化[66],但临床试验也显示出与奥贝胆酸相同的瘙痒副作用。该类药物可通过降低用药剂量、联合使用FXR激动剂或其他药物来缓解副作用[67]。FXR激动剂有希望改善NASH患者的肝脏组织学状况,但是用药安全问题需要进一步评估。这可能与FXR激动剂调节肝脏病理反应的机制研究尚不透彻有关。
FXR激动剂具有代谢调节和抗炎作用,但它如何影响肝脏纤维化的机制仍不清楚。因此,今后FXR激动剂的研究重点应放在深入了解FXR激动剂对肝纤维化的作用上,并在此基础上优化其药效。
3.2.2 FGF19/21类似物
人工合成的FGF19类似物M70可以调节多种代谢途径,表现出抗脂肪变性、抗炎症和抗纤维化特性,并且不会诱导模型动物肝脏肿瘤发生,使得M70成为潜在的、有前景的治疗NASH药物[45]。FGF19类似物NGM282可使NASH患者的肝脏脂肪含量快速、持续降低,肝脏组织学改善,达到了与减肥手术相似的效果[68]。一项Ⅱ期临床试验表明NGM282在治疗12周后改善了NASH的组织学特征,显著降低了NASH的病理诊断评分和纤维化评分,患者的丙氨酸氨基转移酶和天冬氨酸氨基转移酶表达显著降低,但低密度脂蛋白和胆固醇显著增加[69]。FGF19类似物可能会引发患者胃肠道相關的副作用,如腹泻、腹痛和恶心等。这可能与FGF19参与胆汁酸代谢有关。
一项Ⅱa期临床试验发现,FGF21类似物Pegbelfermin可使NASH患者的肝脏绝对脂肪含量显著降低[70]。另一个FGF21类似物Efruxifermin的Ⅱa期临床试验显示,其使患者肝脏脂肪相对减少了63%~72%,甘油三酯降低了39%~48%,并且血糖也得到改善[71]。FGF21类似物也会引起腹泻、恶心等胃肠道副作用,以及心血管和骨质流失等副作用。
最初开发FGF19/21类似物时,研究目标主要集中在改善2型糖尿病患者的高血糖,但在人体试验过程中其表现出了对脂质代谢强大、一致和持久的影响,于是其临床研发重点被逐渐转向对NASH的治疗。基于用药安全性的考虑,FGF19/21类似物未来的研发方向是寻找合适的联用药物,以改善其胃肠道、心血管以及骨代谢等相关副作用。
3.3 基于抗炎的NASH靶向药
3.3.1 ASK1抑制剂
Selonsertib是一种ASK1抑制剂。一项Ⅱ期临床试验表明,采用Selonsertib治疗6个月后,40%的NASH患者的肝纤维化得到改善。虽然在临床Ⅲ期研究中Selonsertib治疗未能减少NASH和晚期肝瘢痕患者的纤维化[72],但有公司表示将会继续进行ASK1抑制剂治疗晚期NASH的研发。此外,研究发现ASK1抑制剂与赖氨酰氧化酶样蛋白2抑制剂联合治疗,可以改善NASH患者的纤维化程度[73]。
抑制脂肪酸从头合成可以改善NASH,但过度抑制脂肪酸从头合成可能会使甘油三酯含量增加以及出现血小板减少等副作用。提高疗效的同时保证安全性对脂肪酸从头合成抑制剂的研究至关重要。因此,优化调节ASK1,辅助添加选择性和肝细胞特异性调节因子可能是ASK1抑制剂治疗NASH的一个发展方向。
3.3.2 CCR2/5拮抗剂
Cenicriviroc是一种口服的CCR2/5双拮抗剂,临床前和临床证据支持其抗炎症和抗纤维化特性。一项随机、双盲Ⅱb期临床试验表明,使用Cenicriviroc治疗的受试者在1年后纤维化得到改善的数量是使用安慰剂的2倍多[74]。目前正在开展Cenicriviroc Ⅲ期临床试验[75]。
但是CCR2/5以及其他趋化因子拮抗剂无法改善脂肪变性或肝细胞气球样变等症状,因此与强抗脂肪变性药物联合使用可能会更有效地改善NASH。这表明多靶点、多药物联合用药是治疗NASH的一种新研究思路。
4 讨 论
4.1 目前存在的问题
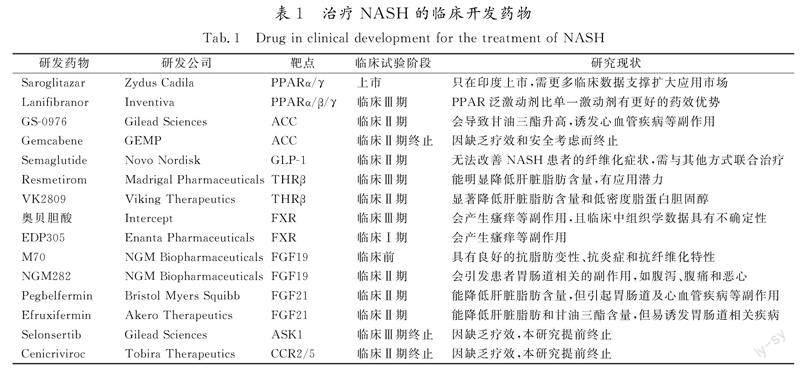
本文从糖脂代谢调节、胆汁酸代谢调节和抗炎3个角度来阐述治疗NASH的研发靶点和靶向药物的研究进展,并分析了各个靶点和靶向药物的优缺点及其应用前景。NASH是一种多因素疾病,病理机制非常复杂,涉及多种不同的信号通路,对目前研究较深入的8种靶点相关药物的研究进展情况进行汇总,见表1。
1)PPAR靶点药物Saroglitazar和Lanifibranor是治疗NASH领域研究较为成熟的药物。其中,Saroglitazar已成功在印度上市,Lanifibranor也处
于临床Ⅲ期,且研究发现PPAR泛激动剂的临床效果要优于单一激动剂。2)ACC靶点药物GS-0976和Gemcabene由于诱导高甘油三酯血症和心血管疾病等副作用较为明显,Gemcabene已终止试验,GS-0976的研究也较为艰难,需要与其他药物联用来减少副作用的产生。3)GLP-1 靶点药物Semaglutide无法改善NASH患者的纤维化症状,需与其他方式联合治疗。4)THRβ靶点药物Resmetirom和VK2809主要通过降低肝脏脂肪来实现治疗NASH的目的,目前这2种药物都处于临床阶段,具有较大的应用潜力。5)FXR靶点药物奥贝胆酸和EDP305会产生瘙痒等副作用,需要在治疗后期通过减少药量或者与FXR拮抗剂联用来减少副作用的影响。6)FGF19/21靶点药物具有强大的调控脂质代谢的能力,但需要对避免胃肠道、心血管以及骨代谢相关副作用作进一步的研究,使其药用价值更高。7)ASK1靶点药物Selonsertib存在副作用危害并且疗效不佳,出于安全性考虑被终止研究。8)CCR2/5靶点药物Cenicriviroc明显改善纤维化,但不能改善脂肪变性,需要与强抗脂肪变性的药物联合使用。
通过对以上靶点药物的分析和讨论,发现NASH药物的研发存在着较多问题需要解决,可概括为以下4个方面。
1)NASH是一种多因素疾病,其病理机制涉及多种不同的信号通路,非常复杂。NASH药物研发的难点在于机体内的各种信号通路相互交织,靶向其中某个靶点或者信号通路可能会有一定的调控作用,但往往无法改善NASH的临床症状。
2)在研的多种靶向药物主要针对糖脂代谢调节、胆汁酸代谢调节和抗炎来治疗NASH,只能在一定程度上缓解NASH的症状,却无法彻底治愈NASH患者。
3)在研的靶向药物普遍存在一定的副作用,并且有的靶向药物治疗效果单一,不能完全缓解NASH症状。在考虑疗效的同时,需要保证用药安全性,避免各种副作用的产生。
4)在药物研究的过程中缺少能够完全模拟人体病理特征的NASH动物模型,目前建立的众多NASH动物模型,尚没有一种模型可以完全模拟NASH的发病机制和病理特征,这也给NASH药物研发带来一定的挑战。
4.2 研究展望
综上所述,随着研究的不断深入,NASH药物研发不断取得新的进展,涌现出一些探索性的靶点治疗药物,但目前尚无一款新药能彻底治疗NASH。探索NASH的发病机制和研发靶向药物仍是未来研究的重要方向,建议关注以下3个方面。
1)研发新靶点 NASH是一种多因素疾病,NASH的发生涉及多种信号通路、多个靶点的相互作用,需要找到NASH最具有说服力的主要致病機制,寻找并开发与主要致病机制相关的靶向药物,从根本上治愈NASH。
2)應用联合疗法 目前某些单一靶点药物对NASH的治疗效果不太明显,治疗药物的选择需要结合个体以及针对疾病的不同发展阶段,所以选择不同靶点药物联合治疗的方案显现出更好的治疗效果。联合疗法有望成为治疗NASH最有效的方法之一。
3)发展新技术 基因疗法、核酸药物以及抗体偶联药物等新兴治疗手段是当今医药领域发展最迅猛、最前沿的技术,已经在多种代谢类疾病治疗领域取得突破性进展。如果将这些新兴技术应用到NASH治疗领域,相信会使NASH疾病的治疗效果得到明显提升。
参考文献/References:
[1] YOUNOSSI Z M.Non-alcoholic fatty liver disease-A global public health perspective[J].Journal of Hepatology,2019,70(3):531-544.
[2] YOUNOSSI Z M,KOENIG A B,ABDELATIF D,et al.Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence,incidence,and outcomes[J].Hepatolog,2016,64(1):73-84.
[3] ESTES C,ANSTEE Q M,ARIAS-LOSTE M T,et al.Modeling NAFLD disease burden in China,France,Germany,Italy,Japan,Spain,United Kingdom,and United States for the period 2016—2030[J].Journal of Hepatology,2018,69(4):896-904.
[4] HORN C L,MORALES A L,SAVARD C,et al.Role of cholesterol-associated steatohepatitis in the development of NASH[J].Hepatology Communications,2022,6(1):12-35.
[5] LENG Yingrong,ZHANG Meihui,LUO Jianguang,et al.Pathogenesis of NASH and promising natural products[J].Chinese Journal of Natural Medicines,2021,19(1):12-27.
[6] FRIEDMAN S L,NEUSCHWANDER-TETRI B A,RINEL-LA M,et al.Mechanisms of NAFLD development and therapeutic strategies[J].Nature Medicine,2018,24(7):908-922.
[7] BUGIANESI E,MOSCATIELLO S,CIARAVELLA M F,et al.Insulin resistance in nonalcoholic fatty liver disease[J].Current Pharmaceutical Design,2010,16(17):1941-1951.
[8] RAZA S,RAJAK S,UPADHYAY A,et al.Current treatment paradigms and emerging therapies for NAFLD/NASH[J].Frontiers in Bioscience (Landmark Edition),2021,26(2):206-237.
[9] OCKER M.Challenges and opportunities in drug development for nonalcoholic steatohepatitis[J].European Journal of Pharmacology,2020,870:172913.
[10]VILAR-GOMEZ E,MARTINEZ-PEREZ Y,CALZADILLA-BERTOT L,et al.Weight loss through lifestyle modification significantly reduces features of nonalcoholic steatohepatitis[J].Gastroenterology,2015,149(2):367-378.
[11]LASSAILLY G,CAIAZZO R,BUOB D,et al.Bariatric surgery reduces features of nonalcoholic steatohepatitis in morbidly obese patients[J].Gastroenterology,2015,149(2):379-388.
[12]STIENSTRA R,VAN DIEPEN J A,TACK C J,et al.Inflammasome is a central player in the induction of obesity and insulin resistance[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(37):15324-15329.
[13]LADE A,NOON L A,FRIEDMAN S L.Contributions of metabolic dysregulation and inflammation to nonalcoholic steatohepatitis,hepatic fibrosis,and cancer[J].Current Opinion in Oncology,2014,26(1):100-107.
[14]PATERNOSTRO R,TRAUNER M.Current treatment of non-alcoholic fatty liver disease[J].Journal of Internal Medicine,2022,292(2):190-204.
[15]WAGNER N,WAGNER K D.The role of PPARs in disease[J].Cells,2020,9(11):2367.
[16]POULSEN L L C,SIERSBAEK M,MANDRUP S.PPARs:Fatty acid sensors controlling metabolism[J].Seminars in Cell & Developmental Biology,2012,23(6):631-639.
[17]PALOMER X,BARROSO E,PIZARRO-DELGADO J,et al.PPARβ/δ:A key therapeutic target in metabolic disorders[J].International Journal of Molecular Sciences,2018,19(3):913.
[18]HEIKKINEN S,AUWERX J,ARGMANN C A.PPAR gamma in human and mouse physiology[J].Biochimica et Biophysica Acta,2007,1771(8):999-1013.
[19]BOECKMANS J,NATALE A,ROMBAUT M,et al.Anti-NASH drug development hitches a lift on PPAR agonism[J].Cells,2019,9(1):37.
[20]FRANCQUE S,SZABO G,ABDELMALEK M F,et al.Nonalcoholic steatohepatitis:The role of peroxisome proliferator-activated receptors[J].Nature Reviews Gastroenterology & Hepatology,2021,18(1):24-39.
[21]SOFTIC S,COHEN D E,KAHN C R.Role of dietary fructose and hepatic de novo lipogenesis in fatty liver disease[J].Digestive Diseases and Sciences,2016,61(5):1282-1293.
[22]楊柳,李锦忠,李敏然.脂肪生成抑制剂治疗非酒精性脂肪性肝病的研究进展[J].世界华人消化杂志,2022,30(16):735-742.YANG Liu,LI Jinzhong,LI Minran.Progress in research of lipogenesis inhibitors for treatment of nonalcoholic fatty liver disease[J].World Chinese Journal of Digestology,2022,30(16):735-742.
[23]BROWNSEY R W,ZHANDE R,BOONE A N.Isoforms of acetyl-CoA carboxylase:Structures,regulatory properties and metabolic functions[J].Biochemical Society Transactions,1997,25(4):1232-1238.
[24]ABU-ELHEIGA L,JAYAKUMAR A,BALDINI A,et al.Human acetyl-CoA carboxylase:Characterization,molecular cloning,and evidence for two isoforms[J].Proceedings of the National Academy of Sciences of the United States of America,1995,92(9):4011-4015.
[25]ABU-ELHEIGA L,OH W,KORDARI P,et al.Acetyl-CoA carboxylase 2 mutant mice are protected against obesity and diabetes induced by high-fat/high-carbohydrate diets[J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(18):10207-10212.
[26]ABU-ELHEIGA L,WU Hongmei,GU Ziwei,et al.Acetyl-CoA carboxylase 2-/- mutant mice are protected against fatty liver under high-fat,high-carbohydrate dietary and de novo lipogenic conditions[J].The Journal of Biological Chemistry,2012,287(15):12578-12588.
[27]MEIER J J.GLP-1 receptor agonists for individualized treatment of type 2 diabetes mellitus[J].Nature Reviews Endocrinology,2012,8(12):728-742.
[28]MASELLI D B,CAMILLERI M.Effects of GLP-1 and its analogs on gastric physiology in diabetes mellitus and obesity[J].Advances in Experimental Medicine and Biology,2021,1307:171-192.
[29]MLLER T D, FINAN B, BLOOM S R,et al.Glucagon-like peptide 1 (GLP-1)[J].Molecular Metabolism,2019,30:72-130.
[30]BAGGIO L L,DRUCKER D J.Biology of incretins:GLP-1 and GIP[J].Gastroenterology,2007,132(6):2131-2157.
[31]KNUDSEN L B,NIELSEN P F,HUUSFELDT P O,et al.Potent derivatives of glucagon-like peptide-1 with pharmacokinetic properties suitable for once daily administration[J].Journal of Medicinal Chemistry,2000,43(9):1664-1669.
[32]ARMSTRONG M J,HOULIHAN D D,ROWE I A,et al.Safety and efficacy of liraglutide in patients with type 2 diabetes and elevated liver enzymes:Individual patient data meta-analysis of the LEAD program[J].Alimentary Pharmacology & Therapeutics,2013,37(2):234-242.
[33]LI Qiuxuan,GAO Han,GUO Yuexin,et al.GLP-1 and underlying beneficial actions in alzheimer′s disease,hypertension,and NASH[J].Frontiers in Endocrinology,2021,12:721198.
[34]KOWALIK M A,COLUMBANO A,PERRA A.Thyroid hormones,thyromimetics and their metabolites in the treatment of liver disease[J].Frontiers in Endocrinology,2018,9:382.
[35]BRENT G A.Mechanisms of thyroid hormone action[J].The Journal of Clinical Investigation,2012,122(9):3035-3043.
[36]KRAUSE C,GROHS M,EL GAMMAL A T,et al.Reduced expression of thyroid hormone receptor β in human nonalco-holic steatohepatitis[J].Endocrine Connections,2018,7(12):1448-1456.
[37]ALKHOURI N.Thyromimetics as emerging therapeutic agents for nonalcoholic steatohepatitis:Rationale for the development of resmetirom (MGL-3196)[J].Expert Opinion on Investigational Drugs,2020,29(2):99-101.
[38]KANNT A,WOHLFART P,MADSEN A N,et al.Activation of thyroid hormone receptor-β improved disease activity and metabolism independent of body weight in a mouse model of non-alcoholic steatohepatitis and fibrosis[J].British Journal of Pharmacology,2021,178(12):2412-2423.
[39]TIAN Siyu,CHEN Shuming,PAN Chengxi,et al.FXR:Structures,biology,and drug development for NASH and fibrosis diseases[J].Acta Pharmacologica Sinica,2022,43(5):1120-1132.
[40]SUMIDA Y,YONEDA M,OGAWA Y,et al.Current and new pharmacotherapy options for non-alcoholic steatohepatitis[J].Expert Opinion on Pharmacotherapy,2020,21(8):953-967.
[41]BOECKMANS J,NATALE A,BUYL K,et al.Human-based systems:Mechanistic NASH modelling just around the corner?[J].Pharmacological Research,2018,134:257-267.
[42]MIN H K,KAPOOR A,FUCHS M,et al.Increased hepatic synthesis and dysregulation of cholesterol metabolism is associated with the severity of nonalcoholic fatty liver disease[J].Cell Metabolism,2012,15(5):665-674.
[43]CIPRIANI S,MENCARELLI A,PALLADINO G,et al.FXR activation reverses insulin resistance and lipid abnormalities and protects against liver steatosis in Zucker (fa/fa) obese rats[J].Journal of Lipid Research,2010,51(4):771-784.
[44]KLIEWER S A,MANGELSDORF D J.Bile acids as hormones:The FXR-FGF15/19 pathway[J].Digestive Diseases,2015,33(3):327-331.
[45]ZHOU Mei,LEARNED R M,ROSSI S J,et al.Engineered FGF19 eliminates bile acid toxicity and lipotoxicity leading to resolution of steatohepatitis and fibrosis in mice[J].Hepa-tology Communications,2017,1(10):1024-1042.
[46]TILLMAN E J,ROLPH T.FGF21:An emerging therapeutic target for non-alcoholic steatohepatitis and related metabolic diseases[J].Frontiers in Endocrinology,2020,11:601290.
[47]KEINICKE H,SUN Gao,MENTZEL C M J,et al.FGF21 regulates hepatic metabolic pathways to improve steatosis and inflammation[J].Endocrine Connections,2020,9(8):755-768.
[48]ICHIJO H,NISHIDA E,IRIE K,et al.Induction of apoptosis by ASK1,a mammalian MAPKKK that activates SAPK/JNK and p38 signaling pathways[J].Science,1997,275(5296):90-94.
[49]CHALLA T D,WUEEST S,LUCCHINI F C,et al.Liver ASK1 protects from non-alcoholic fatty liver disease and fibrosis[J].EMBO Molecular Medicine,2019,11(10):e10124.
[50]ZHANG Peng,WANG Pixiao,ZHAO Lingping,et al.The deubiquitinating enzyme TNFAIP3 mediates inactivation of hepatic ASK1 and ameliorates nonalcoholic steatohepatitis[J].Nature Medicine,2018,24(1):84-94.
[51]ROWE I A,WONG V W S,LOOMBA R.Treatment candidacy for pharmacologic therapies for NASH[J].Clinical Gastroenterology and Hepatology,2022,20(6):1209-1217.
[52]LEFERE S,DEVISSCHER L,TACKE F.Targeting CCR2/5 in the treatment of nonalcoholic steatohepatitis (NASH) and fibrosis:Opportunities and challenges[J].Expert Opinion on Investigational Drugs,2020,29(2):89-92.
[53]SEKI E,DE MINICIS S,INOKUCHI S,et al.CCR2 promotes hepatic fibrosis in mice[J].Hepatology,2009,50(1):185-197.
[54]SEKI E,DE MINICIS S,GWAK G Y,et al.CCR1 and CCR5 promote hepatic fibrosis in mice[J].The Journal of Clinical Investigation,2009,119(7):1858-1870.
[55]JAIN M R,GIRI S R,TRIVEDI C,et al.Saroglitazar, a novel PPARα/γ agonist with predominant PPARα activity,shows lipid-lowering and insulin-sensitizing effects in preclinical models[J].Pharmacology Research & Perspectives,2015,3(3):e00136.
[56]GAWRIEH S,NOUREDDIN M,LOO N,et al.Saroglitazar,a PPAR-α/γ agonist,for treatment of NAFLD:A randomized controlled double-blind phase 2 trial[J].Hepatology,2021,74(4):1809-1824.
[57]SVEN M F,PIERRE B,MANAL F A,et al.A randomised,double-blind,placebo-controlled,multi-centre,dose-range,proof-of-concept,24-week treatment study of lanifibranor in adult subjects with non-alcoholic steatohepatitis:Design of the NATIVE study[J].Contemporary Clinical Trials,2020,98:106170.
[58]ALKHOURI N,LAWITZ E,NOUREDDIN M,et al.GS-0976 (firsocostat):An investigational liver-directed acetyl-CoA carboxylase (ACC) inhibitor for the treatment of non-alcoholic steatohepatitis (NASH)[J].Expert Opinion on Investigational Drugs,2020,29(2):135-141.
[59]HARRIMAN G,GREENWOOD J,BHAT S,et al.Acetyl-CoA carboxylase inhibition by ND-630 reduces hepatic steatosis,improves insulin sensitivity,and modulates dyslipidemia in rats[J].Proceedings of the National Academy of Sciences of the United States of America,2016,113(13):e1796-e1805.
[60]ONICIU D C,HASHIGUCHI T,SHIBAZAKI Y,et al.Gemcabene downregulates inflammatory,lipid-altering and cell-signaling genes in the STAMTM model of NASH[J].PLOS One,2018,13(5):e0194568.
[61]STEIN E,BAYS H,KOREN M,et al.Efficacy and safety of gemcabene as add-on to stable statin therapy in hypercholesterolemic patients[J].Journal of Clinical Lipidology,2016,10(5):1212-1222.
[62]NEWSOME P N,BUCHHOLTZ K,CUSI K,et al.A placebo-controlled trial of subcutaneous semaglutide in nonalcoholic steatohepatitis[J].The New England Journal of Medicine,2021,384(12):1113-1124.
[63]HARRISON S A,BASHIR M R,GUY C D,et al.Resmetirom (MGL-3196) for the treatment of non-alcoholic steatohepa-titis:A multicentre,randomised,double-blind,placebo-controlled,phase 2 trial[J].The Lancet,2019,394(10213):2012-2024.
[64]Anon.Obeticholic acid[C/OL]// LiverTox:Clinical and Research Information on Drug-induced Liver Injury.Bethesda (MD):National Institute of Diabetes and Digestive and Kidney Diseases,2012:NBK548806. https://pubmed.ncbi.nlm.nih.gov/31644113/.
[65]YOUNOSSI Z M,RATZIU V,LOOMBA R,et al.Obeticholic acid for the treatment of non-alcoholic steatohepatitis:Interim analysis from a multicentre,randomised,placebo-controlled phase 3 trial[J].The Lancet,2019,394(10215):2184-2196.
[66]AN Ping,WEI Guangyan,HUANG Pinzhu,et al.A novel non-bile acid FXR agonist EDP-305 potently suppresses liver injury and fibrosis without worsening of ductular reaction[J].Liver International,2020,40(7):1655-1669.
[67]陳立新,林创珍,郁冰清,等.奥贝胆酸治疗非酒精性脂肪肝的疗效和机制——胆汁酸药物的利和弊[J].中国临床新医学,2021,14(8):756-761.CHEN Lixin,LIN Chuangzhen,YU Bingqing,et al.Efficacy and mechanisms of obeticholic acid in treatment of non-alcoholic fatty liver disease:Pros and cons of bile acid drugs in non-alcoholic fatty liver disease[J].Chinese Journal of New Clinical Medicine,2021,14(8):756-761.
[68]DEPAOLI A M,ZHOU Mei,KAPLAN D D,et al.FGF19 analog as a surgical factor mimetic that contributes to meta-bolic effects beyond glucose homeostasis[J].Diabetes,2019,68(6):1315-1328.
[69]HARRISON S A,ROSSI S J,PAREDES A H,et al.NGM282 improves liver fibrosis and histology in 12 weeks in patients with nonalcoholic steatohepatitis[J].Hepatology,2020,71(4):1198-1212.
[70]SANYAL A,CHARLES E D,NEUSCHWANDER-TETRI B A,et al.Pegbelfermin (BMS-986036),a PEGylated fibroblast growth factor 21 analogue,in patients with non-alcoholic steatohepatitis:A randomised,double-blind,placebo-controlled,phase 2a trial[J].The Lancet,2018,392(10165):2705-2717.
[71]HARRISON S A,RUANE P J,FREILICH B L,et al.Efruxifermin in non-alcoholic steatohepatitis:A randomized,double-blind,placebo-controlled,phase 2a trial[J].Nature Medicine,2021,27(7):1262-1271.
[72]HARRISON S A,WONG V W S,OKANOUE T,et al.Selonsertib for patients with bridging fibrosis or compensated cirrhosis due to NASH:Results from randomized phase Ⅲ STELLAR trials[J].Journal of Hepatology,2020,73(1):26-39.
[73]LOOMBA R,LAWITZ E,MANTRY P S,et al.The ASK1 inhibitor selonsertib in patients with nonalcoholic steatohepa-titis:A randomized,phase 2 trial[J].Hepatology,2018,67(2):549-559.
[74]FRIEDMAN S L,RATZIU V,HARRISON S A,et al.A randomized,placebo-controlled trial of cenicriviroc for treatment of nonalcoholic steatohepatitis with fibrosis[J].Hepatology,2018,67(5):1754-1767.
[75]ANSTEE Q M,NEUSCHWANDER-TETRI B A,WONG V W S,et al.Cenicriviroc for the treatment of liver fibrosis in adults with nonalcoholic steatohepatitis:Aurora Phase 3 study design[J].Contemporary Clinical Trials,2020,89:105922.

