可溶性盐对石灰岩文物风化的影响
丁会娟


摘 要:文章通过实验的方法探讨了可溶性盐对石灰岩文物风化过程的影响。研究结果表明,可溶性盐对石灰石风化有明显的促进作用,而且浓度越高,促进作用越明显。
关键词:可溶性盐;石灰岩;风化;影响
DOI:10.20005/j.cnki.issn.1674-8697.2023.08.006
0 引言
石灰岩文物大多数是不可移动文物遗存①,体积较大,并且处于露天环境下,不能或不宜整体移动,不可以像其他馆藏文物一样收藏于馆内,比如石像、石雕、石碑等石灰岩文物②。气温的反复变化以及各种水溶胶和生物的活动使石灰岩文物在结构构造或化学成分上逐渐发生变化,使石灰岩由整块变成碎块,由坚硬变得疏松,甚至组成岩石的矿物也发生分解,在当时环境下产生稳定的新的矿物。这种温度、大气、水溶液和生物的作用,使石质文物岩体发生物理状态和化学组成成分或结构变化③。在引起石灰岩文物风化的诸多因素中,可溶性盐对石灰岩文物风化的影响较大。
1 石灰岩的风化
石灰岩文物中的可溶性盐有NaCl、KCl、Na2CO3等,它们易溶于水,造成石质结构改变④。可溶性盐在石灰岩文物中富集是造成石灰岩文物表面风化、结构破坏及强度降低的重要原因之一。使用可溶性盐对石灰岩进行劣化模拟试验,在可溶性盐反复结晶过程中,对样品进行实时变形监测,并对循环过程中质量衰减、强度变化、孔隙分布等进行测试与分析⑤。结果表明:可溶性盐的发育是导致石灰岩文物表面粉化脱落的重要因素⑥,严重降低了石灰岩文物本体的价值。可溶性盐结晶导致岩石颗粒间胶结作用被破坏,岩石孔隙率增大,岩石内部结构劣化,严重影响岩石的刚度与强度等力学参数。对比可溶性盐与难溶性盐,可溶性盐晶体发育对岩石破坏力度更为显著。此外,一些微溶性盐,尤其是硫酸盐⑦,对石灰岩文物风化也有较大影响。硫酸盐除了在文物表面结壳外,还能使岩石产生裂隙。其过程是盐晶在岩石孔隙中生成—晶体长大成簇—对孔隙壁产生压力—继续长大使裂隙撑大变宽。总之,石灰岩的物理风化改变了其力学结构,使其变得疏松,坚硬程度明显降低。
石灰岩的化学风化有溶解作用⑧、水化作用、水解作用、氧化作用、碳酸化作用、空气污染物作用。化学风化是造成石灰岩风化的主要原因,它会使石灰岩文物逐渐分解。首先,岩石中可溶性物质被溶解或水化后致使岩石的孔隙增加⑨,降低了颗粒间的结合力,因而降低了岩石的坚实程度,更易遭受物理破坏的作用而破碎。同时,溶解度的大小还取决水的温度、压力、pH值等。其次,岩石中的低价元素与大气中或水中的氧作用,被氧化成高价元素,使矿物成分发生变化,而且颜色也会发生一定的变化。最后,空气中的有害气体,尤其是酸性气体,对石质文物危害极大。石质文物受SO2侵蚀,表面形成一层坚硬的外壳,最后由于一些外界因素脱落。文物被酸雨侵蚀风化生成的CaSO4⑩,虽然难溶于水,但在一定范围浓度的NaCl溶液中k,CaSO4的溶解度随着NaCl浓度的增加而增大。CaSO4在石灰岩表面形成一层致密的膜l,从而阻止了酸雨对石灰岩文物的进一步侵蚀。可是,在有NaCl存在的条件下,石灰岩文物表面生成的CaSO4会不停地溶解,从而使酸雨对文物的侵害反复进行。设计具体实验探究可溶性盐对石灰岩风化过程的影响,为文物保护工作提供理论依据。
2 实验部分
2.1 实验仪器
数控超声波清洗机(昆山市超声仪器有限公司)、即热式恒温加热磁力搅拌器(郑州长城科工贸有限公司)、精密pH值计(上海精密科学仪器有限公司)、烧杯(500ml)、量筒(100ml、5ml)、玻璃棒、滤纸、药匙、砂纸、电子天平(上海精密科学仪器有限公司)、自制反应池、色差仪、X射线无损分析仪、扫描电子显微镜。
2.2 实验药品及材料m
用3mol/L的H2SO4配制pH值分别为1、2、3、4、5的H2SO4溶液,称取不同量的氯化钠晶体,加入不同酸度的硫酸液中,使氯化钠溶液的浓度为0.001mol/L、0.010mol/L、0.1mol/L、0.15mol/L、0.30mol/L、0.6mol/L。三块体积相差不大的石灰岩。
2.3 实验内容
2.3.1 测定不同pH值下,不同氯化钠溶液中石灰岩试块质量的变化
①进行石灰岩质量变化测定实验之前,要耐心地打磨石灰岩试块的六个面,直至露出其本体,打磨一定要彻底,不能让石灰岩被风化部分或上次反应生成的硫酸钙残留留在石灰岩表面影响实验结果,因为反应生成的硫酸钙会使测得的数据不准确。
②石灰岩试块打磨完成后,用自来水冲掉上面的粉末,然后將其置于超声波清洗机中,超声波清洗三次n。超声处理完之后,先用自来水冲洗三次,然后再用蒸馏水冲洗三次,用滤纸吸干表面的水分。
③将石灰岩试块放于恒温箱中,温度调至100℃,每隔20min称量一次试块的质量,直至其质量恒重为止,记录质量为m1。
④设置三组pH值分别为1、2、3的H2SO4溶液,配制同一pH值的酸液500mL,量取100mL倒入编号1、2、3、4的四个500ml的烧杯中,分别加入同一pH值的H2SO4溶液100ml,然后在1、2、3、4号烧杯中对应加入0.0000g、0.0059g、0.0585g、0.585g氯化钠,使氯化钠溶液浓度为0.00mol/L、0.001mol/L、0.010mol/L、0.1mol/L。
⑤将已经烘干的凉至常温的石灰岩试块分别沿烧杯壁轻轻放入四个不同溶液的烧杯中,大面贴于烧杯底面,记录放入时间,然后将四个烧杯分别置于25℃的恒温水浴中,观察并记录反应现象。
⑥反应进行12h后,将试块缓慢地从烧杯中取出,用蒸馏水冲洗石灰岩试块表面的溶液,反复操作三次,用滤纸吸干表面的水分。
⑦同步骤③相同的操作,最后记录质量为m2。
⑧不同pH值和不同浓度氯化钠溶液下石灰岩试块的质量变化如表1~表3所示。
2.3.2 实验现象o
①pH值为1时的一系列反应,1号烧杯中放入石灰岩试块后,溶液变浑浊,并且有大量大气泡溢出。待反应进行10min后,上表面只有少量的气泡外溢,反应剧烈程度与刚开始相比明显变缓;20min后,上表面已无气泡冒出,由于试块一面贴于烧杯底部,下表面不能与溶液充分反应,所以所有反应实验终止时间以上表面为参考;25min后气泡不再溢出,反应停止;12h后,摇晃烧杯,溶液变浑浊,取出试块,用蒸馏水冲洗干净,观察试块表面生成白色膜,使石灰岩表面的透明鳞片状结构被遮盖。2号烧杯中放入石灰岩试块后,前10min反应现象与1号烧杯相同;待反应10min后,2号烧杯中反应现象仍比较剧烈,上表面还有气泡往外溢,反应剧烈程度与刚开始相比明显变稍缓;30min后,上表面已无气泡冒出,反应停止;12h后,同烧杯1操作相同,溶液中有细小的粉末,取出试块看到表面有白色的膜遮盖了试块的本体。3号烧杯反应前30min与2号烧杯相同;反应进行35min后,表面不再有气泡溢出,反应停止;12h以后,溶液中有少许白色片状物,应该是脱落的硫酸钙。4号烧杯中的反应较1、2、3号烧杯反应剧烈,反应时间持续久,45min后反应停止,12h后晃动溶液,有大量白色鳞片状的硫酸钙从试块表面脱落。
②pH值为2、3时,反应现象没有pH值为1时剧烈,同时同一pH值的1、2、3、4号烧杯中,加盐越多反应持续时间较长、反应越剧烈。盐浓度相同,pH值分别为1、2、3时,pH值越高反应时间越长。未加盐的pH值不同的对照组,pH值越大反应时间越短。pH值为2、3的溶液,12h后晃动溶液,未见到鳞片状脱落的白色硫酸钙。
2.4 采集数据
2.4.1 pH值变化数据采集
①自制大小合适反应池一个,使放入石灰岩试块后,反应池的四壁与试块之间有2mm的距离。同时,底面应该用支架隔空,支架不应太高,且石灰岩试块与支架接触面尽可能小,从而使试块与溶液充分反应。侧面应留一个与电极形状大小相似的小孔,用来插电极。尽可能少地使用溶液,使酸液对反应的缓冲作用减小,从而使反应时间缩短,反应过程中pH值的变化更明显,易于数据的采集。
②测定溶液pH值变化的实验之前,石灰岩试块只需打磨两个大面,打磨要求与前面相同,四个侧面不用做处理。
③打磨完后,用自来水冲洗试块,用超声波清洗三次,然后用自来水先洗三次,再用蒸馏水洗三次,用滤纸吸干表面的水分。
分为pH值为2、3、4、5四组,每组分别量取20ml的酸液,然后加入氯化钠晶体,使氯化钠溶液的浓度为0.00mol/L、0.15mol/L、0.30mol/L、0.60mol/L。每次进行反应之前都应清洗反应池与支架(自来水冲洗3次,蒸馏水冲洗3次,甩掉尾水,用滤纸吸干)。
④将处理好的支架放入反应池中,支好支架后,放入试块,调整好四壁的距离,然后将反应池(电极孔朝外,其他部分靠壁压在恒温反应器盖子下)放入25℃恒温水浴中预热。
⑤pH值电极处理:每天早上使用前,对pH值计进行校准,温度调到25℃,先用pH值为6.86的缓冲调至稳定,用蒸馏水冲洗电极3次,用滤纸吸干,然后用pH值为4缓冲矫正斜率,矫正完后,用蒸馏水冲洗电极3次,然后将电极插入在25℃不加盐的酸液中润洗,同时校验pH值计。将校验完的pH值计插入反应池中,调整好位置,保证电极垂直插入反应池底部。
⑥量取20ml已配好的酸液,倒入烧杯中,对照组不用加盐,放入25℃温箱中预热5min,然后倒入反应池中并开始秒表计时,加盐组应提前将称好的盐倒入烧杯,再进行与不加盐组相同的操作。
⑦相同pH值的系列反应保证在同一环境温度下完成,环境温度的变化对反应速率有较大的影响。
⑧以分钟为单位,记录pH值的变化,pH值达到5.6停止记录,结束反应。如果在记录过程中出现pH值计数值漂移的情况,应及时校準。
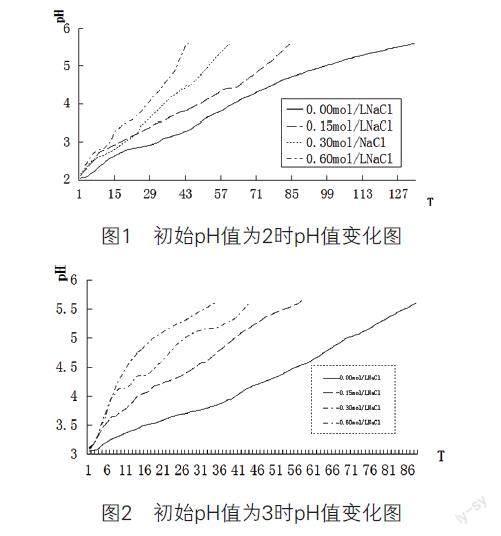
⑨整理数据,绘制反应过程中pH值变化如图1~图4所示。
2.4.2 扫描电子显微镜分析和X射线衍射分析p
①未被风化的石灰岩试块,反应条件是25℃,起始pH值为4,照片采集时间为反应开始后5min,氯化钠浓度分别为0.00mol/L、0.15mol/L、0.30mol/L,0.60mol/L时,扫描电子显微镜下观察到表面形貌致密性依次减弱。
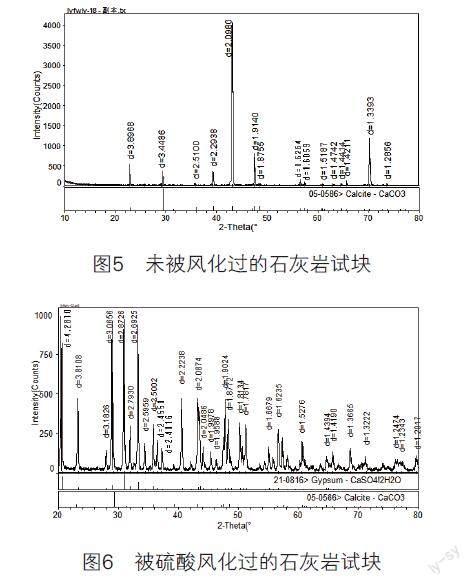
②未被风化的石灰岩试块和25℃、pH值为4时被硫酸溶液风化过的试块X射线衍射分析如图5、图6所示。
3 结果分析
①如果试块前后不进行烘干,反应前后用滤纸吸干表面蒸馏水,称其质量变化,反应后质量反而比反应前重。结合前文可知,碳酸钙的吸水率小于硫酸钙的吸水率。
②根据图1、图2、图4分析,随着pH值的增大,相同盐浓度的反应pH值达到5.6所用的时间越来越短,说明酸液的缓冲作用减缓了反应的速度。在同一pH值环境中,随着盐浓度的增大,pH值达到5.6所用的时间越来越短,说明盐的加入确实促进了硫酸与碳酸钙的反应速率。
③对于图3中不加盐的对照组与加0.15mol/L氯化钠的反应,在前6分钟,加0.15mol/L氯化钠的反应比对照组快,6min之后,对照组超过了加0.15mol/L氯化钠的pH值,可能与环境温度的变化有关。
④根据扫描电子显微镜下观察到的试块表面形貌得出:未被风化的石灰岩试块表面光滑,结构致密q;pH值为4、温度为25℃时,随着盐浓度的增大,石灰岩与硫酸和氯化钠发生作用,使石灰岩表面结构疏松,孔隙度变大,稳定性降低。甚至当盐浓度达到0.60mol/L时,明显看到表面尖锐,使石灰岩与外界接触面积变大,更易受环境的影响。
注释
①严绍军,方云,刘俊红,等.可溶盐对云冈石窟砂岩劣化试验及模型建立[J].岩石力学,2013(12):3410-3416.
②王成兴,尹慧道.文物保护技术[M].合肥:安徽大学出版社,2005:158-171.
③⑦冯楠.潮湿环境下砖石类文物风化机理与保护方法研究[D].长春:吉林大学,2011.
④徐则民,唐正光.石灰岩腐岩的基本特征及其形成机制[J].地质评论,2007(2):421-427.
⑤n张秉坚.石材的化学清洗[J].石材,1999(8):8-9.
⑥丁梧秀,冯夏庭.化学腐蚀下灰岩力学效应的试验研究[J].岩石力学与工程学报,2004(21):3571-3576.
⑧⑨王锦芳.孔隙材料盐劣化及可溶盐特征[J].甘肃科技,2011(2):56-58.
⑩q吴孙富.石灰石能与硫酸持续反应的实验探究[J].拓展探究,2012(2):45-46.
k尹忠,赵晓东.硫酸钙在盐酸和氯化钠水溶液中的溶解度[J].油田化学,1994(4):345-347.
l田萍,宁斌,曹宏.二水硫酸钙在铵盐溶液中溶解度测定及热力学计算[J].工程与工程学报,2012(4):625-630.
m洪太元,马士忠,祁玉平,等.济阳坳陷早古生代岩石地层特征及古潜山界面的识别[J].地层学杂志,2004(4):375-384.
oA.S.Goudie,H.A.Viles & A.G.Parker.Monitoring of rapid salt weathering in the centralNamib Desert using limestone blocks[J].Journal of Arid Environments,1997(37):581-598.
p杨万容,唐天福,张俊明,等.我国西南地区震旦系灯影组碳酸盐岩石学特征及其储集性[J].地球化学,1978(4):247-260,316-319.

