宏基因组二代测序在原发性脊柱感染保守治疗中的价值
刘晓伟,殷楚强,丛亚男,王德春,王海龙,杨希重,汪学松,陈龙伟,王月磊,王亭
宏基因组二代测序(metagenomic next-generation sequencing,mNGS)技术是近几年蓬勃发展的一门新兴诊断技术[4-5],它基于核酸水平,可无偏向地一次性覆盖送检样本中涉及的所有病原体,包括细菌、真菌、病毒甚至寄生虫等病原微生物。该技术具有快速、准确率高、病原微生物覆盖广等特点,目前,已经广泛用于多系统感染的病原学诊断[4-7]。基于其自身的优势,未来可能会成为病原学诊断的标准方法。本文回顾性分析原发性脊柱感染患者的临床资料,探讨mNGS 检测指导下原发性脊柱感染保守治疗的效果。
1 资料与方法
1.1 一般资料
回顾性分析2019 年12 月至2022 年2 月就诊于青岛大学附属医院脊柱外科疑似脊柱感染的358 例患者的临床资料。纳入标准:①根据临床表现、体征、实验室检验及影像学表现等初步诊断为原发性脊柱感染;②患者入院时无严重神经功能障碍表现;③C 型臂X 线机辅助下穿刺病灶获取标本;④进行常规实验室检验及mNGS 检测。排除标准:①未按要求完成全部常规检查和mNGS 检测的患者;②标本送检过程出现明显外源性污染的患者;③资料不完整或失访的患者;④病灶位于颈椎或上胸椎部位的患者。根据以上纳入及排除标准,共47 例患者纳入本研究,其中男33 例,女14 例;年龄17~91 岁,平均(63.2±14.4)岁。
本研究已获得青岛大学附属医院伦理委员会批准(审批号:QYFY WZLL27811),并豁免患者知情同意。
1.2 研究方法
1.2.1 检测内容
患者入院时完善特异性实验室检测,如布鲁氏菌抗体及血清凝集试验、结核感染T 细胞斑点试验、半乳甘露聚糖抗原检测、1,3-β-D-葡聚糖检测,定期监测血常规、红细胞沉降率(erythrocyte sedimentation rate,ESR)、超敏C 反应蛋白(highsensitivity C reactive protein,hs-CRP)、降钙素原(procalcitonin,PCT)等感染指标,入院后和发热时抽取血培养。采取保守治疗方案的患者由脊柱外科医师在C 型臂X 线机引导下行病灶穿刺活检[8]。所有穿刺活检及开放手术获取的标本均进行细菌培养、病理检查和mNGS检测。
1.2.2 抗感染治疗方案
换算截面法:源于钢筋混凝土构件计算,根据刚度等效原则,将钢材换算成相当截面的混凝土,或反之,通常其计算结果较双单元法偏大。
未取得明确致病微生物前采用经验性抗感染治疗,抗生素使用万古霉素联合三代或四代头孢,或者利福平联合左氧氟沙星。待病原微生物培养及mNGS 检测结果回报后,调整抗生素种类及用药疗程:化脓性脊柱炎患者常规抗感染治疗12 周,前4 周静脉给药,后续改用同类抗生素口服;布鲁氏菌感染患者常规三联用药(多西环素、利福平、头孢曲松钠)9个月左右[9-11];脊柱结核患者常规四联用药(异烟肼、利福平、吡嗪酰胺、乙胺丁醇)9~12 个月[12];如果患者存在高龄、合并免疫缺陷等疾病、并发脓肿等,抗生素应用时间需适当延长。每2 周复查血常规、ESR、hs-CRP、PCT 及各项生化指标;每4 周复查病灶部位MRI。当患者出现保守治疗无效或加重、严重神经功能障碍、病灶部位脊柱稳定性丧失时行手术治疗[13-14]。
1.3 原发性脊柱感染性疾病的诊断标准
1.3.1 临床诊断标准[12,15]
脊柱感染初发症状常不明显,缺乏特异性。需结合患者病史:①病灶部位疼痛,可伴有发热等其他症状;②病灶节段MRI 检查提示椎体或椎间盘信号改变,可伴有椎间隙改变或脓肿形成;③入院血常规、hs-CRP、ESR、PCT 等感染指标异常,或抗感染治疗有效。
1.3.2 病原微生物诊断标准
①化脓性细菌:病灶标本微生物培养或血培养阳性;②布鲁氏菌:布鲁氏菌抗体阳性且血清凝集试验结果>1∶160 或微生物培养阳性[16];③结核分枝杆菌:微生物培养、病理检查或PCR 任一阳性;④真菌:病原微生物培养或病理检查阳性。
1.3.3 mNGS检测阳性标准
检测出列最低层级的微生物,在同类微生物中所占百分比,称为相对丰度。查阅同类文献,对mNGS检测结果进行标准拟定:①化脓性细菌或布鲁氏菌:定义为属相对丰度>15%,同时序列数>40 作为诊断的阈值;②结核分枝杆菌:实际所测得序列数≥1时,确诊为阳性;③真菌:属相对丰度>15%,同时序列数>50;④临床罕见的细菌或其他病原体:当属相对丰度>10%,同时序列数>10作为诊断标准[15]。
实际检测过程中,背景微生物也会影响结果。常见的背景微生物一般来源于样本采集工具、实验耗材及文库构建所用试剂等,如伯克霍尔德菌属(Burkholderia)、不动杆菌属(Acinetobacter)、慢生根瘤菌属(Bradyrhizobium)、罗尔斯顿菌属(Ralstonia)、鞘氨醇单细胞菌属(Sphingomonas)、脱硫化煤菌属(Desulfocarbo)及莫拉菌属(Moraxella)等细菌,以及细环病毒、人类疱疹病毒等。判读mNGS 检测结果时,背景菌多不被纳入致病微生物范畴。
1.4 统计学方法
采用SPSS 26.0 统计软件进行统计分析,使用卡方检验比较mNGS 检测和微生物培养两种检测方式的阳性率,检验水准α取双侧0.05,以P<0.01为差异有统计学意义。
2 结果
2.1 纳入病例情况
47 例患者的主要临床表现为病灶疼痛伴发热、病灶局限性疼痛和病灶处及下肢疼痛(表1)。结合患者病史、体征、实验室检查、影像学检查及穿刺或手术所见等,47 例均被确诊为脊柱感染。感染灶位于胸椎、腰椎及胸腰段合并感染(表1);mNGS 检测结果均在48 h 内完成,病原微生物培养完成时间在5~7 d不等。所有患者最终均治愈出院并随访1年。

表1 47例脊柱感染病例结果分布
2.2 病原微生物诊断结果
2.2.1 病理及病原微生物培养结果
47例患者临床诊断及病理结果分为4类:①化脓性细菌感染:30例,镜下见中性粒细胞浸润,慢性化脓性炎,或有死骨存在,偶有脓肿形成;②布鲁氏菌感染:10 例,镜下见炎性细胞浸润,增殖性结节和肉芽肿形成;③结核分枝杆菌感染:6 例,镜下见慢性肉芽肿性炎伴凝固性坏死;④真菌感染:1 例,镜下见较多炎性细胞浸润,坏死物内可见多量真菌菌丝。
47例患者微生物培养阳性23例,阴性24例;阳性结果共发现3 类微生物,其中化脓性细菌感染19 例,占比34.0%(19/47),最常见的革兰氏阳性菌和革兰氏阴性菌分别为金黄色葡萄球菌(7例)、大肠埃希菌(5例);布鲁氏菌3 例,占比6.4%(3/47);烟曲霉菌1 例,占比2.1%(1/47)。见表2。
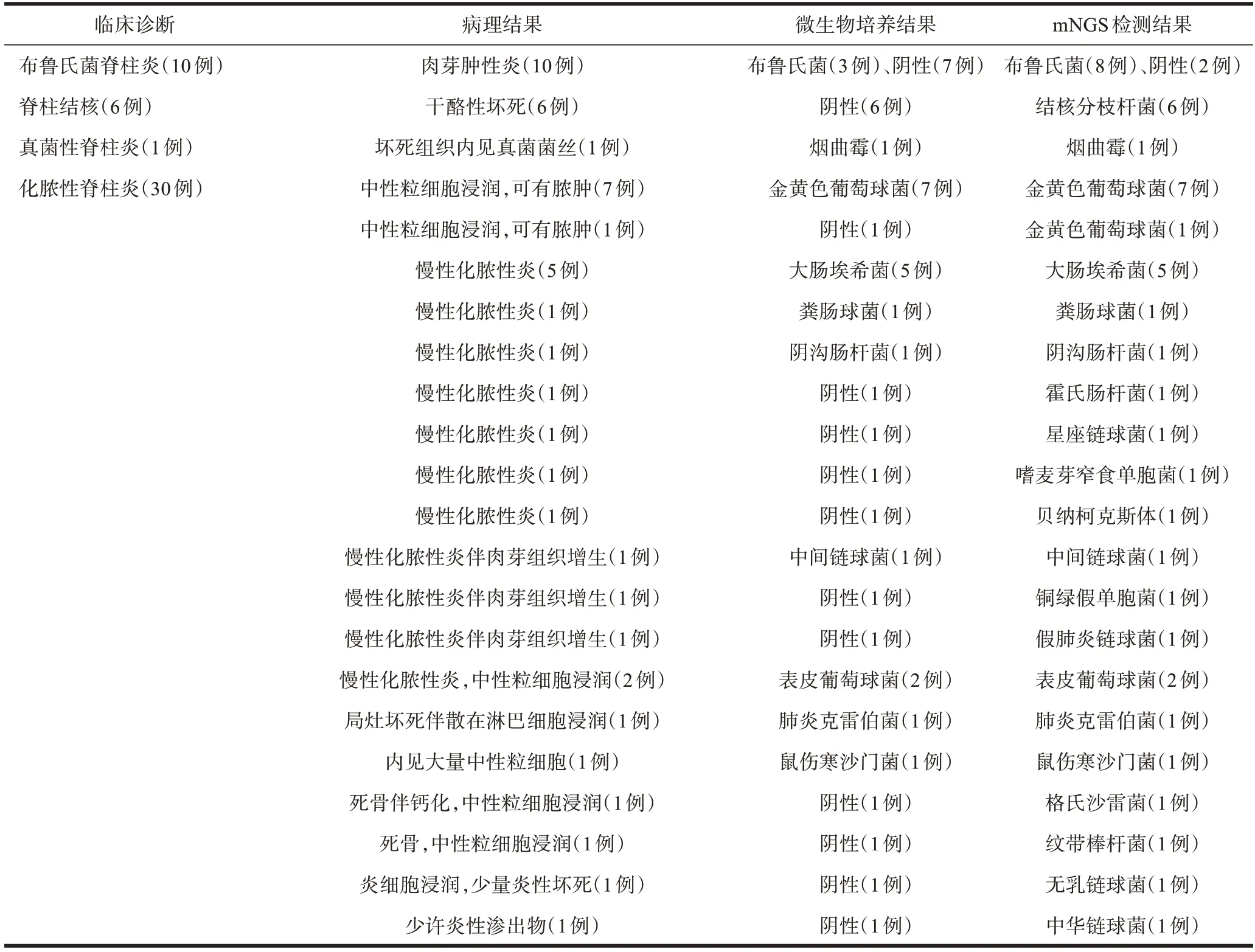
表2 病原微生物培养和mNGS检测结果分布
2.2.2 mNGS检测结果
mNGS 检测频次为48 例次(47 例患者中,其中1例术前行mNGS 检测结果阴性,最终该患者进行手术治疗,术后再次进行mNGS 检测,结果阳性),阳性结果45 例次,发现4 类致病微生物,其中化脓性细菌30 例次,占比为66.7%(30/45),最常见的革兰氏阳性菌和革兰氏阴性菌分别为金黄色葡萄球菌(8 例次)、大肠埃希菌(5 例次);布鲁氏菌8 例次,占比为17.8%(8/45);结核分枝杆菌6 例次,占比为13.3%(6/45);烟曲霉菌1例次,占比为2.2%(1/45)。见表2。
6 例结核感染病例均通过病理检出,其中2 例结核杆菌PCR 阳性,涂片、培养均为阴性,mNGS 检测结果均对应检出。1 例烟曲霉感染患者,病理结果提示纤维组织增生及炎细胞浸润,坏死物内可见多量真菌菌丝,微生物培养及mNGS 检测均提示阳性。
3 例次mNGS 检测阴性病例临床均表现为患处疼痛,伴感染指标升高,细菌培养阴性。2 例次病理提示慢性化脓性炎伴肉芽组织形成,布鲁氏菌抗体结果阳性,抗布鲁氏菌感染治疗有效,确诊为布鲁氏菌感染;1 例穿刺后微生物培养及mNGS 检测均为阴性,抗生素经验性治疗效果不佳,转行手术清创内固定治疗,再次行mNGS检测提示贝纳特柯克斯体。
47例脊柱感染患者中,微生物培养阳性23例,阳性率为48.9%(23/47);mNGS 检测阳性结果45 例次,阳性率为93.8%(45/48)。病原微生物培养阳性结果均与mNGS 检测有对应。mNGS 检测阳性率远高于病原微生物培养,差异有统计学意义(P<0.01)。微生物培养阴性病例中,23 例可通过mNGS 检测获得对应阳性结果。其中检出阳性较多的致病微生物分别为结核分枝杆菌(6/24)、布鲁氏菌(5/24)、链球菌(4/24)及葡萄球菌(3/24),因此mNGS 检测可对确诊致病微生物起到有效的补充作用。
2.3 转归与预后
47例脊柱感染患者中,46例行保守治疗并治愈。1 例患者腰痛伴间断发热半年,结合影像学检查,临床诊断腰椎间盘感染。首次穿刺微生物培养及mNGS 检测结果均为阴性,经验性抗感染治疗2 周效果不佳,转行病灶清创内固定术。术后再次送病理检查、病原微生物培养及mNGS 检测,mNGS 检出贝纳柯克斯体阳性,应用多西环素、羟氯喹抗感染治疗后治愈出院。47 例患者均治疗康复出院。所有患者随访1年无复发,最终临床治愈。
3 讨论
临床脊柱感染致病微生物的分类主要有化脓性细菌、布鲁氏菌、结核分枝杆菌及真菌。脊柱感染的临床表现、体征、影像学表现及常规感染指标较为相似,临床对获取明确致病菌比较困难。微生物培养仍是诊断的“金标准”,但对低毒力菌群及罕见菌阳性率低,且结果获取时间长。以往研究显示,mNGS检测阳性率高于常规培养,对于培养阳性率低或培养时间长的病原体,mNGS 检测具有优势[15],目前根据专家共识,高度疑似感染性疾病,调整抗感染治疗方案同时应开展mNGS检测[17]。
本研究中,病原微生物培养阳性率48.9%,难以达到临床对于脊柱感染保守治疗的精准用药指导的要求。本研究中,mNGS检测病原菌的阳性率显著高于微生物培养,且微生物培养阳性病例均可通过mNGS 检测获得对应致病微生物,这表明,mNGS 检测诊断脊柱感染具有更高的检出率和准确性,结合其快速性的优势,可将其作为确诊病原微生物的补充手段[5]。这对脊柱感染早期抗感染药物保守治疗有显著意义。本研究中,mNGS 检测出现3 例次阴性病例,结合病例特点分析其原因,不能排除取材过小、获取病灶为罕见菌或提取菌群浓度偏低的情况;建议对标本获取精准化,增加检验的操作严谨性。且与微生物培养相比,本研究发现,mNGS 检测技术难以有效分辨致病菌和背景菌,在病原菌鉴定及相对丰度方面也缺乏统一标准。此外,mNGS检测也缺乏针对性的药敏结果,药物多根据阳性结果给予常用的抗生素治疗,因此mNGS 检测技术还需继续验证其效能,以提高准确度。
本研究中患者保守治疗获得高治愈率的另一原因与精准获取感染标本相关。本研究中,因通过C型臂X 线机引导对颈椎及上胸椎等复杂部位完成穿刺难度大,故排除此类患者,所有纳入患者病灶均位于下胸椎或腰椎部位,根据李宝田等[18]建议,穿刺首选C 型臂X 线机引导,取样过程由脊柱外科临床医师严格无菌操作,取样部位为病灶核心,所有样本穿刺结果均满足取样要求。临床医师是脊柱感染诊疗的执行者,其参与取样过程,能够提高对穿刺部位的分析准度;与CT 引导相比,对于下胸椎或腰骶椎部位,C型臂X 线机引导穿刺可获得同样良好的穿刺结果。但对于颈椎及上胸椎等复杂部位的穿刺,建议优先选取CT引导[18-19]。
目前脊柱感染仍需规范诊疗标准,杨波等[20]认为治疗目的在于消除感染、重建和维持脊柱结构和功能及缓解症状。牛宁奎等[21]建议先行经验性抗感染保守治疗,根据微生物培养及mNGS 检测结果进行合理的药物调整。Guo 等[22]及Tsai 等[23]则分别建议在抗感染治疗前,先行早期病灶清创内固定术等手术治疗。目前两种观点并无明确定论,本研究中入组的脊柱感染病例在经使用抗生素、镇痛、营养治疗、康复锻炼及预防并发症等保守措施治疗后,获得了极高的保守治愈率。如患者无脊柱失稳或严重神经压迫症状,在排除感染性休克等病重情况后,应优先选取抗感染药物治疗,并设计个体化保守治疗方案[24]。
本研究存在一定的局限性。本研究属于单中心研究,且病例数较少,结果分析中存在一定的偏倚;本研究纳入病例为轻型病例,对结果分析存在一定偏倚。
4 结论
原发性脊柱感染,应用抗生素之前即行感染病灶核心部位活检,并结合微生物培养及mNGS 检测明确致病微生物后,选取敏感抗生素及合理抗感染疗程治疗,可获得显著的治疗效果,并能极大降低患者行手术治疗的概率。
【利益冲突】所有作者均声明不存在利益冲突

