不同程度活动期溃疡性结肠炎患者血清IFABP、MUC1、CCL11水平变化及对预后的影响
王 沛,严小俊
1.陕西省西安市高陵区医院消化内科,陕西西安 710200;2.陕西省西安市红会医院检验科,陕西西安 710054
溃疡性结肠炎(UC)是发生在结直肠黏膜的慢性非特异性炎症性肠病,近年来国人随着饮食习惯和生活方式的改变,UC发病率逐年升高[1]。目前,UC尚无治愈方法,主要治疗目标为控制急性发作和减少并发症发生,准确评估活动期UC患者病情严重程度有助于改善UC患者预后。有研究表明,炎症反应介导的肠黏膜损伤参与了UC的发生、发展[2]。肠型脂肪酸结合蛋白(IFABP)是一种仅表达于小肠的脂肪酸结合蛋白,能敏感反映小肠黏膜损伤情况[3]。黏蛋白1(MUC1)是一种跨膜蛋白,参与了调控细胞生长、增殖、侵袭、凋亡和炎症反应等行为[4]。有研究表明,MUC1的糖基化能诱导肠道炎症反应及癌变[5]。C-C基序趋化因子配体11(CCL11)是一种趋化因子,能通过诱导嗜酸粒细胞趋化而参与炎症反应[6]。有学者通过高通量筛选技术分析发现,CCL11是UC血清和结肠组织中的异常表达因子[7]。本研究检测了活动期UC患者血清IFABP、MUC1、CCL11水平,并分析其与活动期UC病情严重程度和预后的关系,以期为控制活动期UC病情和改善预后提供参考依据。
1 资料与方法
1.1一般资料 选择2018年6月至2020年1月陕西省西安市高陵区医院收治的活动期UC患者80例作为UC组,其中男47例,女33例;年龄34~67岁,平均(42.75±5.98)岁;体质量指数18.59~26.34 kg/m2,平均(22.38±1.93)kg/m2;病变范围:直肠12例,左半结肠15例,右半结肠53例。另选择同期在陕西省西安市高陵区医院健康体检者60例作为对照组,其中男37例,女23例;年龄28~64岁,平均(41.77±5.71)岁;体质量指数18.86~27.62 kg/m2,平均(22.18±1.72)kg/m2。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。根据UC组患者病情严重程度分为轻度组(36例)、中度组(28例)和重度组(16例),根据随访2年预后情况分为预后不良组(29例)和预后良好组(51例)。纳入标准:(1)活动期UC符合《炎症性肠病诊断与治疗的共识意见(2018年,北京)》[8]诊断标准;(2)年龄≥18岁;(3)初次诊断且入院前未接受任何UC相关治疗;(4)临床资料完整。排除标准:(1)合并克罗恩病等其他炎症性肠病;(2)妊娠及哺乳期妇女;(3)慢性疾病终末期;(4)合并严重心脑血管疾病、恶性肿瘤、造血系统损害等;(5)近3个月内有免疫抑制剂使用史。所有研究对象均知情同意并签署知情同意书。本研究经陕西省西安市高陵区医院伦理委员会审批同意。
1.2方法
1.2.1血清IFABP、MUC1、CCL11水平检测 收集UC组入院次日清晨和对照组体检时静脉血3 mL,分离血清后采用美国赛默飞MK3酶标仪通过酶联免疫吸附试验检测血清IFABP、MUC1、CCL11水平。试剂盒均购自上海继和生物科技有限公司(编号:JH-H10481、JH-H12093、JH-H11561)。
1.2.2病情严重程度评价 活动期UC患者根据改良Truelove和Witts疾病分型[8]进行病情严重程度评估。(1)轻度:排便次数<4次/天,轻度或无便血,脉搏、体温、血红蛋白正常,红细胞沉降率<20 mm/h。(2)中度:介于轻度与重度之间。(3)重度:排便次数≥6次/天,重度便血,脉搏>90次/分,体温>37.8 ℃,血红蛋白<75%正常值,红细胞沉降率>30 mm/h。
1.3预后评估 UC患者入院后参照文献[8]给予治疗,治疗后随访2年(随访截至2022年1月)记录患者预后不良发生情况,包括UC复发、急性穿孔、黏膜异常增生、大出血等。
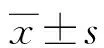
2 结 果
2.1UC组与对照组血清IFABP、MUC1、CCL11水平比较 UC组血清IFABP、MUC1、CCL11水平均高于对照组,差异均有统计学意义(P<0.05)。见表1。
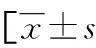
表1 UC组与对照组血清IFABP、MUC1、CCL11水平比较或M(P25,P75)]
2.2不同病情严重程度活动期UC患者血清IFABP、MUC1、CCL11水平比较 轻度组、中度组、重度组患者血清IFABP、MUC1、CCL11水平依次升高,差异有统计学意义(P<0.05)。见表2。
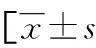
表2 不同病情严重程度活动期UC患者血清IFABP、MUC1、CCL11水平比较或M(P25,P75)]
2.3单因素分析 80例活动期UC患者预后不良发生率为36.25%(29/80)。预后不良组患者中病情严重程度为重度比例和血清IFABP、MUC1、CCL11水平均高于预后良好组,差异均有统计学意义(P<0.05)。见表3。
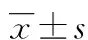
表3 单因素分析[n(%)或或M(P25,P75)]
2.4多因素Logistic回归分析 以病情严重程度(重度=1,非重度=0)、IFABP水平(≥161.43 pg/mL=1,<161.43 pg/mL=0)、MUC1水平(≥17.62 U/mL=1,<17.62 U/mL=0)、CCL11水平(≥161.13 pg/mL=1,<161.13 pg/mL=0)为自变量,预后情况(不良=1,良好=0)为因变量进行多因素Logistic回归分析,结果显示,病情为重度、IFABP≥161.43 pg/mL、MUC1≥17.62 U/mL、CCL11≥161.13 pg/mL为活动期UC患者预后不良的独立危险因素(P<0.05)。见表4。
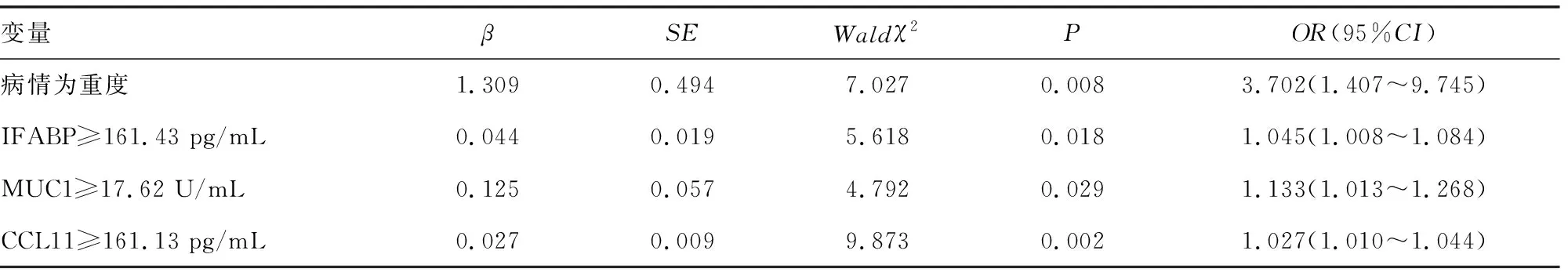
表4 多因素Logistic回归分析
2.5血清IFABP、MUC1、CCL11水平对活动期UC患者预后不良的预测价值 血清MUC1、IFABP、CCL11水平联合检测预测活动期UC患者预后不良的ROC曲线下面积(AUC)大于各项指标单独检测。见表5、图1。
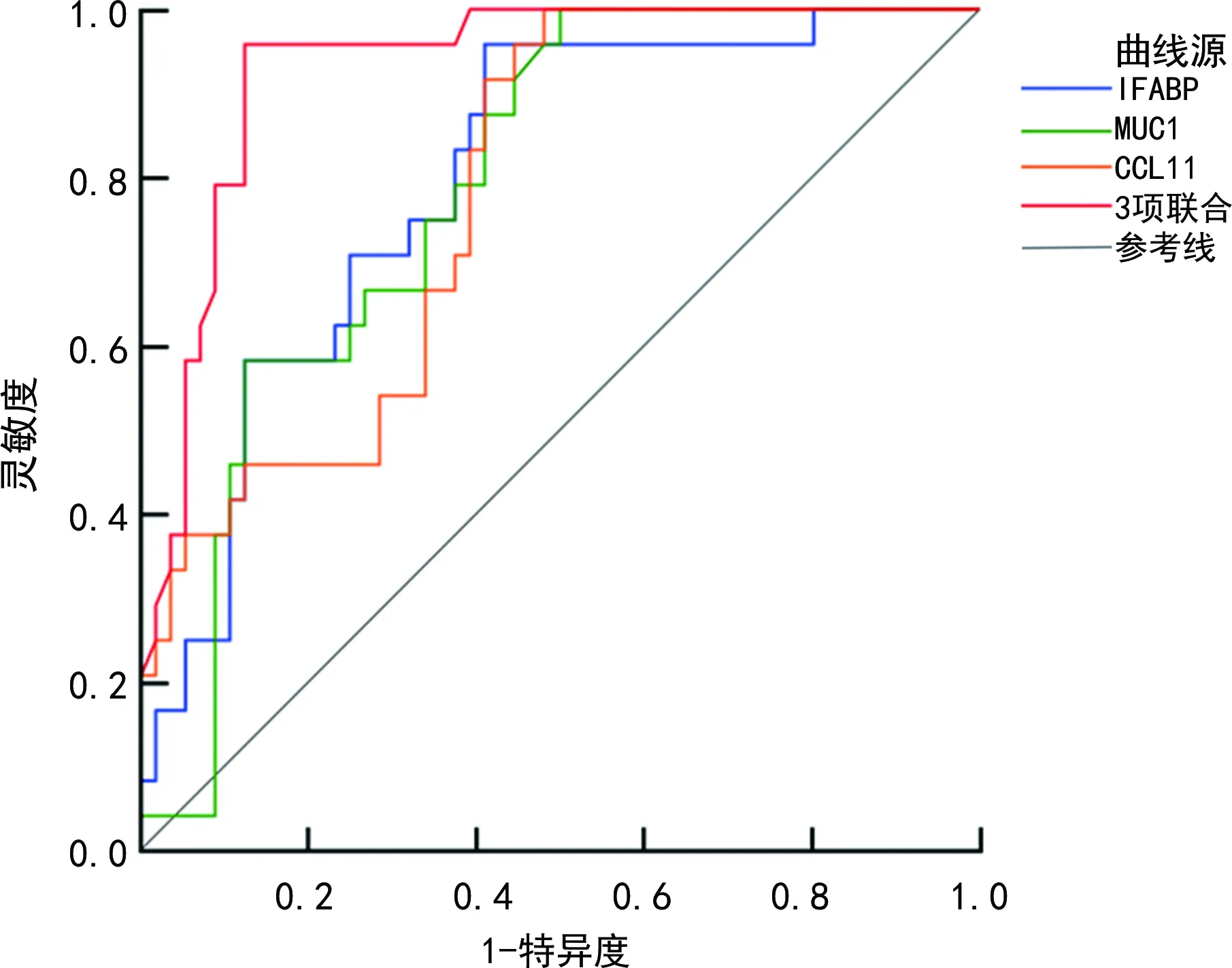
图1 血清IFABP、MUC1、CCL11水平预测活动期UC患者预后不良的ROC曲线

表5 血清IFABP、MUC1、CCL11水平预测活动期UC患者预后不良的价值
3 讨 论
UC是一种慢性非特异性炎症性疾病,其发病机制尚未完全明确,可能与宿主免疫应答、内部肠道微生物群、外部环境、遗传易感性等有关,尽管大多数活动期UC患者通过生物制剂、激素、5-氨基水杨酸类药物能有效控制病情,但仍有部分患者会并发出血、穿孔、狭窄甚至癌变,严重影响患者预后[9]。因此,及时判断活动期UC病情严重程度和预后情况至关重要。目前,有研究表明,肠道黏膜免疫系统失衡启动的病理性炎症反应参与了活动期UC的发生、发展,持续炎症反应能损伤肠道黏膜和屏障功能导致UC发生,而随着炎症反应加重能进一步增强肠黏膜损害,导致黏膜脆性增加(接触性出血)、黏膜自发性出血及糜烂/溃疡[10-11]。
脂肪酸结合蛋白是细胞内脂质结合蛋白超家族成员,主要参与了长链脂肪酸的摄取、转运和代谢调节等,在多个组织中均有表达,但不同组织内脂肪酸结合蛋白表达具有高度特异性。IFABP是具有肠组织特异性的脂肪酸结合蛋白,仅存在于小肠中且含量丰富,占肠内总细胞质蛋白的1%~2%,当肠黏膜受损时会释放IFABP进入血液循环。因此,血液中IFABP被认为是反映肠黏膜损伤的敏感指标[12]。有研究表明,血清IFABP在坏死性肠炎、脓毒症并发肠损伤、急性肠系膜缺血等肠疾病中水平升高,与肠道损伤密切相关[13-14]。本研究结果显示,UC组患者血清IFABP水平升高,推测与UC患者肠黏膜损伤导致IFABP被大量释放进入血液有关[15]。轻度组、中度组、重度组UC患者血清IFABP水平依次升高,IFABP≥161.43 pg/mL是活动期UC患者预后不良的独立危险因素,说明血清IFABP水平升高与患者病情加重和预后不良有关,血清IFABP水平越高反映活动期UC患者肠黏膜损伤越严重,更易促进病情进展,导致预后不良。
糖基化是机体新陈代谢的重要组成部分,几乎修饰了机体所有蛋白质,能通过细微的糖链修饰调节免疫和炎症反应等过程。近年来,糖基化在自身免疫性疾病中得到广泛研究[16]。MUC1是主要由上皮细胞合成的大分子糖蛋白,能通过N末端的N糖基化位点在内质网和高尔基体中进行糖基化,进而参与免疫调节和信号传导等细胞生物活动[4]。目前,有研究发现,MUC1能直接增加核因子κB(NF-κB)在目标基因启动子的比例以激活NF-κB信号通路,进而参与了炎症反应进展[17]。SHENG等[18]指出,MUC1能通过激活白细胞介素6/信号传导和转录激活因子3促进结肠炎相关的结直肠癌发生、发展。CHI等[19]研究表明,抑制肠黏膜MUC1表达能抑制NF-κB信号传导,减轻结肠炎小鼠炎症反应并改善肠道屏障功能,提示MUC1与结肠的炎症反应密切相关。本研究结果显示,UC组患者血清MUC1水平升高,分析与活动期UC患者肠道上皮细胞受损释放MUC1进入血液有关。本研究结果还显示,轻度组、中度组、重度组UC患者血清MUC1水平依次升高,MUC1≥17.62 U/mL是活动期UC患者预后不良的独立危险因素,说明血清MUC1水平升高与活动期UC病情加重和预后不良有关,推测与MUC1能激活NF-κB信号通路,促进炎症反应进展,导致病情加重和预后不良有关[16]。NF-κB信号通路是UC中重要的炎症反应信号通路,在UC发生、发展中发挥至关重要的作用[20]。同时,近年实验也发现,抑制MUC1水平能减弱UC小鼠NF-κB信号通路传导,促进肠黏膜愈合[19]。
趋化因子是一类小细胞因子,可导致人体细胞免疫功能紊乱,进而激活和促进炎症反应[21]。嗜酸粒细胞是一种含酸性磷酸酶和过氧化物酶的颗粒白细胞,活化时能释放高度生物活性的炎症介质促进炎症反应进展,CCL11作为嗜酸粒细胞的趋化剂,能促进嗜酸粒细胞活化参与炎症反应[22]。有研究发现,UC患者结肠中嗜酸粒细胞数量明显增加,并与肠屏障功能有关[23]。FILIPPONE等[24]研究表明,CCL11水平在豚鼠结肠炎中大量表达,抑制CCL11能减轻豚鼠结肠炎的炎症反应相关损伤和缓解结肠功能障碍。本研究结果显示,UC组患者血清CCL11水平升高,分析与活动期UC患者炎症反应激活趋化因子信号途径导致CCL11大量产生有关。本研究结果还显示,轻度组、中度组、重度组UC患者血清CCL11水平依次升高,CCL11≥161.13 pg/mL是活动期UC患者预后不良的独立危险因素,说明血清CCL11水平升高与活动期UC患者病情加重和预后不良有关,可能原因为CCL11促进大量嗜酸粒细胞活化导致炎症反应,进而促进病情进展并导致预后不良[22]。也有学者指出,CCL11在UC小鼠结肠中表达与嗜酸粒细胞增加呈正相关,能通过炎症反应加剧结肠损伤和炎症反应相关的结肠肿瘤发生[6]。
本研究通过绘制ROC曲线发现,血清IFABP、MUC1、CCL11水平单独与联合检测预测活动期UC患者预后不良的AUC分别为0.796、0.787、0.781、0.931,3项指标联合检测预测活动期UC患者的AUC较各项指标单独检测预测明显增加,说明血清IFABP、MUC1、CCL11水平可能成为UC患者预后不良的辅助预测指标,且3项指标联合检测可提升活动期UC患者预后预测价值,对活动期UC患者治疗更具有指导价值。
综上所述,血清IFABP、MUC1、CCL11水平升高与活动期UC患者病情加重和预后不良有关,可能成为活动期UC患者预后不良的辅助预测指标,且3项指标联合预测价值更高。但本研究样本量较小,还需更大样本验证,同时,关于IFABP、MUC1、CCL11与活动期UC临床疗效的关系也需进一步研究。

