胃炎及胃癌患者血清HIF-1α和ROS表达水平与Hp感染的关系及临床意义*
李文茜,王学红,朱思雨,刘 曙
1.青海大学研究生院,青海西宁 810016;2.青海大学附属医院消化内科,青海西宁 810000
胃癌是一种起源于胃黏膜上皮细胞的恶性肿瘤,其恶性程度高,异质性强,患者预后较差[1],发病率和病死率在恶性肿瘤中均位于前列[2]。由于肿瘤的快速和不受控制的增殖限制了氧气的供应,血液供应不足或缺氧是几乎所有实体瘤的典型微环境特征[3]。有研究证明了缺氧在癌症治疗中的意义[4]。缺氧改变了肿瘤内的氧含量梯度,使肿瘤的可塑性和异质性增强,并使其更具侵袭性和转移性[5],在缺氧过程中,缺氧诱导因子-1α(HIF-1α)表达增加是一个关键的步骤,HIF-1α在因缺氧而触发的细胞机制中发挥着核心作用,是目前发现的唯一在缺氧状态下可以发挥活性的核转录因子,是专一调节氧稳态的关键性介质[6]。幽门螺杆菌(Hp)是一种革兰阴性微需氧细菌,其感染会引起一系列胃黏膜改变,从浅表性胃炎开始,可发展为慢性胃炎、萎缩性胃炎、肠上皮化生、不典型增生,最后发展为胃癌[7],Hp也被世界卫生组织列为胃癌的最高警示级别的Ⅰ类致癌物。
机体内由氧组成、含氧并且性质活泼的物质被统称为活性氧(ROS),而缺氧伴随着ROS的产生增加[8]。有研究表明,Hp感染可促进胃上皮细胞内ROS产生,通过Hp本身或还原性辅酶Ⅱ(NADPH)产生过多的ROS[9],并上调人胃上皮AGS和GES-1细胞HIF-1α的表达[10],尤其是胃上皮的Hp感染和ROS介导的HIF-1α稳定被认为可诱导增殖、抑制细胞死亡并最终有利于胃上皮的癌变。本研究探讨了胃炎及胃癌患者血清HIF-1α和ROS表达水平的相关性,以及二者与Hp感染的相互作用,以期为胃癌的进一步研究提供帮助。
1 资料与方法
1.1一般资料 选择2021年12月至2022年8月青海大学附属医院内镜中心经胃镜检查及胃黏膜活检确诊的慢性胃炎及胃癌患者119例作为研究对象,其中男70例,女49例;年龄≥60岁38例,<60岁81例;慢性萎缩性胃炎54例(慢性萎缩性胃炎组),慢性非萎缩性胃炎30例(慢性非萎缩性胃炎组),胃癌35例(胃癌组)。纳入标准:(1)年龄18~80岁,男女不限;(2)胃镜及病理活检确诊为慢性胃炎和早期胃癌;(3)检查前未经任何根除Hp治疗及口服非甾体类抗炎药物等治疗。排除标准:(1)患有肝、胆、胰、脾、肺,以及心、脑血管等疾病,中、重度贫血,重度营养不良等;(2)非首次根除Hp;(3)长期居住在海拔高于3 500 m或低于1 700 m者;(4)临床资料不完整。所有患者均知情同意并签署知情同意书。本研究经青海大学附属医院伦理委员会审批。
1.2仪器与试剂 冻存管、离心管、HIF-1α和ROS的酶联免疫吸附试验试剂盒均购自青海赛斯克生物科技有限公司,台式高速冷冻型微量离心机购自Dragonlab公司,超净工作台购自苏净安泰公司,标准试剂型纯水仪购自青岛富勒姆科技有限公司。
1.3方法 (1)3组患者均通过13C-尿素呼气试验检测Hp,按照检测后的结果再各自分为Hp阳性组和Hp阴性组,13C-尿素呼气试验参考值为0~4 dpm,>4 dpm即为阳性。(2)血清HIF-1α和ROS蛋白水平检测。采集各组患者晨起空腹状态下肘静脉血5 mL于促凝管中,3 000 r/min离心10 min,离心半径16 cm,留取1 mL上清液置于-80 ℃冰箱中保存。采用酶联免疫吸附试验检测血清HIF-1α和ROS蛋白水平,具体操作参照试剂盒说明书进行。
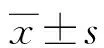
2 结 果
2.1各组患者血清HIF-1α、ROS表达水平比较 慢性萎缩性胃炎组、胃癌组患者血清HIF-1α、ROS表达水平均高于慢性非萎缩性胃炎组,且胃癌组患者血清HIF-1α、ROS表达水平均高于慢性萎缩性胃炎组,差异均有统计学意义(P<0.05)。见表1。

表1 各组患者血清HIF-1α、ROS表达水平比较[M(P25,P75),μmol/L]
2.2不同临床特征胃炎及胃癌患者血清HIF-1α表达水平比较 不同性别、年龄患者血清HIF-1α表达水平比较,差异均无统计学意义(P>0.05);慢性萎缩性胃炎、胃癌Hp阳性及阴性患者HIF-1α表达水平比较,差异均有统计学意义(P<0.05);慢性非萎缩性胃炎Hp阳性及阴性患者HIF-1α表达水平比较,差异无统计学意义(P>0.05)。见表2。
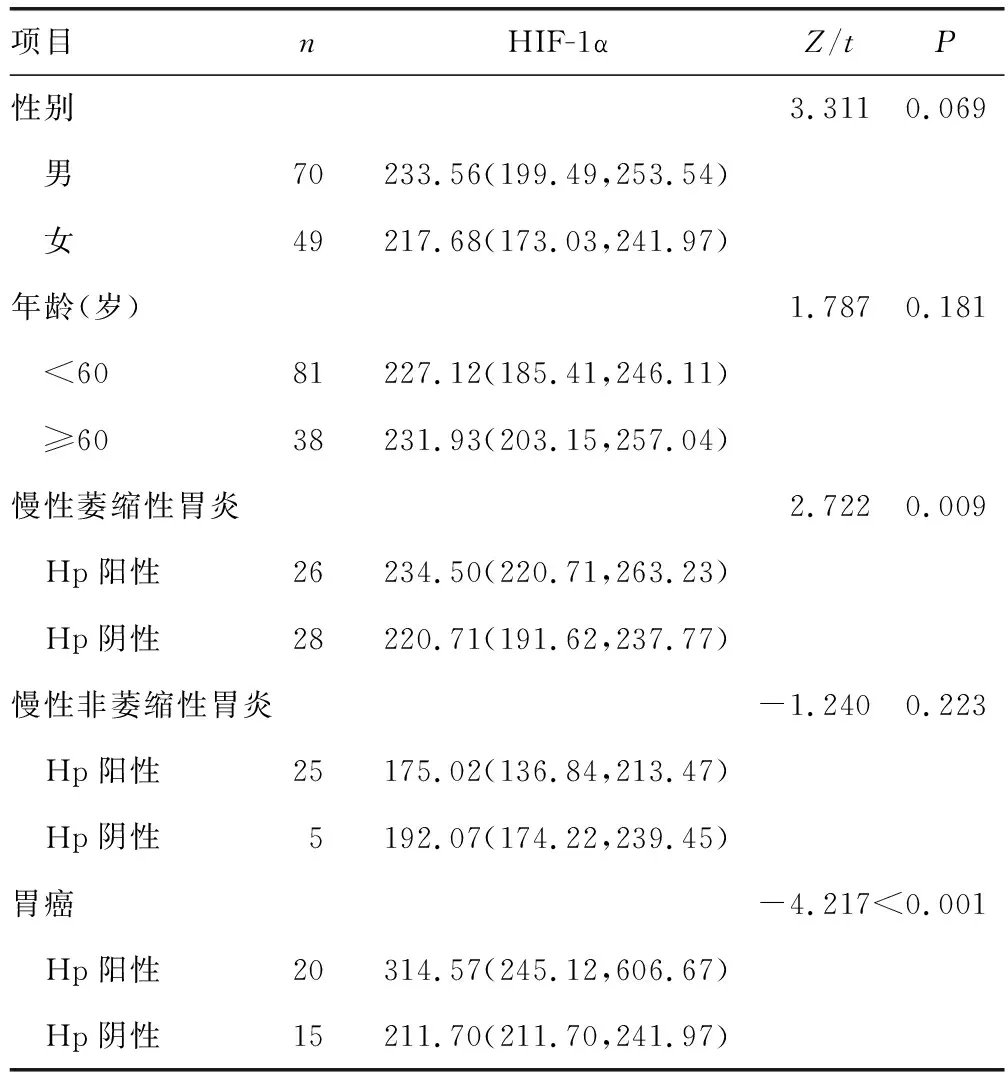
表2 不同临床特征胃炎及胃癌患者血清HIF-1α表达水平比较[M(P25,P75),μmol/L]
2.3不同临床特征胃炎及胃癌患者血清ROS表达水平比较 不同性别、年龄患者血清ROS表达水平比较,差异均无统计学意义(P>0.05);慢性萎缩性胃炎、胃癌Hp阳性及阴性患者ROS表达水平,差异均有统计学意义(P<0.05);慢性非萎缩性胃炎Hp阳性及阴性患者ROS表达水平比较,差异无统计学意义(P>0.05)。见表3。
表3 不同临床特征胃炎及胃癌患者血清ROS表达水平比较[M(P25,P75),μmol/L]
2.4慢性萎缩性胃炎及胃癌患者血清ROS表达水平与HIF-1α表达水平的相关性 慢性萎缩性胃炎及胃癌患者血清ROS表达水平与HIF-1α表达水平呈正相关(r=0.713,P<0.001)。
3 讨 论
胃癌虽是由多因素引起的,但Hp感染为主要因素,使其成为靶向疗法的靶点,有研究证实了Hp治疗对蒙古沙鼠胃癌的预防作用,根除Hp的沙鼠再患残胃癌的概率大大下降[11]。卢光荣等[12]最新研究结果表明,轻、中度胃黏膜肠上皮化生患者根除Hp后肠上皮化生程度较未根除Hp患者减轻;有研究表明,接受过Hp根除的早期胃癌患者异时性胃癌发生率较低,证明如果发现Hp感染应及时进行根除[13]。在胃癌这种缺氧环境下HIF-1α的表达水平增加会调节下游转录因子以及可以作为激活剂促进微小RNA-421在胃癌细胞中高表达,从而抑制细胞凋亡模式的开启,促进肿瘤发生、发展[14]。高国安等[15]发现,HIF-1α蛋白在胃癌组织的阳性率高于癌旁组织,且HIF-1α的表达水平与患者临床病理特征相关,高表达HIF-1α的胃癌患者预后不良。有研究表明,ROS介导的脯氨酸羟化酶结构域抑制和常氧条件下HIF-1α的稳定,尤其是线粒体复合物Ⅲ产生的ROS负责在缺氧期间稳定HIF-1α[16]。ROS和HIF-1α之间的信号传导长期以来被认为与许多疾病的病理学过程有关,包括癌症、炎症性疾病和缺血性损伤。
本研究结果显示,随着胃黏膜病变严重程度的加剧,血清HIF-1α、ROS表达水平不断升高,提示血清HIF-1α、ROS表达水平与胃黏膜病变严重程度有关。有研究表明,胃癌患者的临床分期不同,HIF-1α、ROS的表达水平有所不同[17]。而血清HIF-1α、ROS在Hp阳性的慢性萎缩性胃炎和胃癌患者中的表达水平比Hp阴性的患者中的表达水平高,大多数人感染Hp后均没有明显的临床表现,但细胞均显示慢性炎症反应,通常由于免疫细胞在炎症反应部位浸润过程中对氧气的需求增加,导致发生炎症反应的组织出现局部缺氧[18],提示Hp感染可能通过多种机制过度产生HIF-1α和ROS。而LI等[19]研究也表明,胃上皮的Hp感染与ROS介导的HIF-1α稳定被认为可诱导增殖、抑制细胞死亡并最终有利于其癌变。此外,本研究相关性分析表明,慢性萎缩性胃炎及胃癌患者HIF-1α表达水平与ROS表达水平具有明显相关性,与最近相关研究提出的ROS通过诱导磷酸肌醇-3激酶/蛋白激酶B和细胞外信号调节激酶磷酸化在缺氧条件下增加HIF-1α的转录相符[20]。
综上所述,本研究从Hp感染与HIF-1α及ROS相互影响的角度探讨了胃癌发展的分子机制,其中慢性非萎缩性胃炎组患者Hp感染与HIF-1α、ROS表达水平均无关,其主要局限性在于研究样本量较少。而且本研究胃癌患者均为经胃镜及病理检查诊断为早期胃癌的患者,缺少了与临床较为常见的进展期胃癌患者的HIF-1α和ROS对比;其次,患者均长期居住在青藏高原,代表性不强,仍需多地区、大样本的研究进一步证明根除Hp的必要性。

