乙基纤维素/蓝莓花青素浸泡型标签对牛奶新鲜度的指示
方仕阳,钟秋夏,张一弛,刘婕,陈汉城,范小平
(1.华南农业大学 食品学院,广州 510642; 2.广东安德力新材料有限公司,广东 汕头 515800)
如今,人们对饮食已不再简单满足于温饱,越来越多的人开始注重食品质量安全,这给食品包装带来了新的挑战,也激发了食品包装系统的发展。智能包装领域的创新性理念在延长保质期和有效监控食品质量安全方面正在发挥着越来越重要的作用,这引起了人们的极大兴趣和关注。智能包装材料通过直接或间接识别食品或食品周围环境某些特征指标的变化,以特定的方式将结果传递给消费者[1]。因为多数食品的变质通常伴随着pH 值的变化,所以可以通过pH 指标来监测食品新鲜度,并通过包装内的新鲜度指示标签的颜色变化将结果呈现给消费者,使消费者通过肉眼感知食品品质,实现可视化监控食品质量安全。
新鲜度指示标签通常由聚合物基材和pH 敏感染料组成[2]。聚合物基材是指示标签的重要组成部分,通过影响标签的完整性、通过性等对指示效果造成较大的影响,目前常用的聚合物基材有聚乙烯醇[3]、明胶[4]、羧甲基纤维素[5]等,但该类聚合物基材易溶于水,不能长期浸泡在溶液中,导致这类聚合物基材制备的指示标签只能应用于气敏性包装的食品中[6],而不能在液体食品中应用。pH 敏感染料是指示标签的另一重要组成部分,常用的pH 敏感染料多为人工合成指示剂,如红色甲酚[7]、溴甲酚绿[8]、甲基红[9]等。但这些人工合成指示剂多数有毒,若在食品中使用会对人体健康造成一定影响,不利于其在食品类pH 指示标签中使用。
乙基纤维素由含5 个醚键的分子聚合而成的高分子化合物,因其醚键相对含量高而表现出明显的水不溶性,由于无毒、稳定性、保水性能较好,具有优越成膜性的同时安全无毒,在食品和药品领域被广泛应用[10-11],但目前鲜有乙基纤维素应用于指示标签的相关报道。蓝莓花青素是一种天然的、无毒的水溶性色素,在食品中不但可作为营养强化剂,而且还可作为天然食品防腐剂代替山梨酸、苯甲酸、苯甲酸钠等合成防腐剂,并且可作为食品着色剂应用于平常饮料和食品,符合人们对食品添加剂天然、安全、健康的总要求[12-14]。花青素对不同酸碱度有较宽范围的响应,是一种优异的可应用于食品的化学指示剂的替代品。因此,本研究以乙基纤维素为聚合物基材,花青素为pH 敏感染料,吐温80 和甘油为增塑剂[15-17],通过物理交联后流延制得指示标签,并对其进行比色分析,溶胀率、接触角、迁移测试,傅里叶变换红外光谱分析,扫描电镜等测试表征,最后应用于牛奶新鲜度监测。本研究将为开发新型安全无毒且可浸泡在液体食品中的食品级新鲜度指示标签提供新的思路和参考,并可推动其在食品智能包装领域的应用。
1 实验
1.1 材料与试剂
主要材料与试剂:蓝莓花青素(5%~25%),上海麦克林生化科技有限公司;乙基纤维素(80~120 mPa·s,乙氧基含量为48.5%~49.5%),上海麦克林生化科技有限公司;矢车菊素–3–O–葡萄糖苷,上海麦克林生化科技有限公司;吐温80,科密欧化学试剂有限公司;甘油,国药集团化学试剂有限公司;无水乙醇,上海凌峰化学试剂有限公司;巴氏杀菌乳,购自实验室附近农户。
1.2 仪器与设备
主要仪器与设备:HJ–4A 同步搅拌器,常州峥嵘仪器有限公司;GD0306 超声波器,深圳市冠博科技实业有限公司;SDC–100 接触角测量仪,东莞市晟鼎精密仪器有限公司;Vertex70 傅里叶变换红外光谱仪,布鲁克公司;UV–4802S 型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;FD–5 型分光密度仪,日本柯尼卡美能达(中国)投资有限公司;CHY–C1测厚仪,济南兰光机电技术发展中心;Verios460 场发射扫描电子显微镜,FEI 公司;EVOMA15 扫描式电子显微镜,ZEISS 公司。
1.3 方法
1.3.1 指示标签的制备及思路
如图1 所示,将2 g 乙基纤维素、0.5 g 吐温80和0.5 g 甘油添加到20 g 无水乙醇中,常温下在磁力搅拌器搅拌 4 h 后,分别取乙基纤维素质量分数5%、7.5%、10%、12.5%、15%的蓝莓花青素溶解于5 g 去离子水,超声后添加到乙基纤维素溶液中;然后在40 ℃条件下搅拌2 h 使蓝莓花青素和乙基纤维素发生物理交联,以获得蓝莓花青素/乙基纤维素聚合物溶液。将聚合物溶液超声消泡后倒入11 cm 的培养皿,在黑暗环境的室温下干燥48 h,待成膜后剪成1.5 cm×1.5 cm 的指示标签,放在深色干燥袋里,需要用时取出即可。纯乙基纤维素膜制备过程不加花青素,其他过程同上。

图1 指示标签的制备过程及思路Fig.1 Preparation process and ideas of indication label
1.3.2 指示标签的表征
1.3.2.1 指示标签的比色分析
采用扫描仪对不同pH 值指示标签进行光学图片扫描,选用彩色照片扫描模式,分辨率为600 dpi,光源为仪器自带标准光源。
参考Weston 等[18]的实验结果,牛奶质量变化过程的pH 值从6.8 减低至4,适当扩大pH 值范围,利用分光密度仪记录指示标签在pH 值为3~7 时缓冲溶液下的颜色变化。用分光密度仪测得指示标签的L*、a*、b*值,按式(1)计算总色差ΔE。
式中:ΔL*=L*−L0*,Δa*=a*−a0*,Δb*=b*−b0*;L*、a*、b*为不同pH 下指示标签的值;L0*、a0*、b0*为指示标签的初始值。
1.3.2.2 指示标签的厚度与质量
使用测厚仪对标签进行随机采样,取20 张指示标签采样,厚度的平均值作为标签的厚度,单位为μm;质量的平均值为标签的质量,单位为g。
1.3.2.3 指示标签的溶胀率、含水率和水溶性
取3 片制得的纯乙基纤维素膜和指示标签进行称量,记质量为m0,然后分别浸泡在去离子水中,每隔24 h 取出并用滤纸快速擦干表面的去离子水后再次称量,记质量为mt,溶胀率SD[19]按公式(2)计算。
式中:mt为第t天溶胀时标签的质量,g;m0为干质量时标签的质量,g。
参照封晴霞等[20]的方法测试标签的含水率,将质量为m1的标签放入温度为105 ℃的烘箱中烘干至标签质量恒定,取出后标签的质量为m2,每次标签测试3 个平行试样,取平均值作为标签的含水率,含水率(MC)按式(3)计算。
式中:m1为标签的初始质量,g;m2为标签烘干后的质量,g。
取3 片制得的指示标签,干燥至质量不变,记质量为m3,于常温条件下浸泡在三级水中24 h,取出后干燥至质量不变,质量为m4,水溶性(WS)按式(4)计算。
式中:m3为标签首次质量不变时的值,g;m4为标签浸泡后再次质量不变时的值,g。
1.3.2.4 迁移测试
将指示标签进行花青素迁移测试,验证花青素迁移量是否超标并对牛奶造成不良影响。参照李夏[21]的方法绘制标准曲线:准确称量100 mg 矢车菊素–3–O–葡萄糖苷标准品,用体积分数为50%的乙醇溶液(含0.8%的盐酸)准确定容至100 mL,得到1 mg/mL 的标准使用液。用移液枪分别吸取0、0.04、0.08、0.12、0.16、0.20 mL,分别加入1、0.96、0.92、0.88、0.84、0.80 mL 的体积分数为50%的乙醇溶液(含0.8%的盐酸),在500 nm 的波长测各浓度标准品的吸光度,以标准品的花青素浓度为横坐标,以吸光度为纵坐标,绘制花青素标准曲线。将指示标签浸泡于180 mL 的体积分数为50%的乙醇溶液(含0.8%的盐酸)中,3 d后取溶液测其吸光度,并代入标准曲线求溶液中花青素含量。根据标签质量,按比例计算出其他物质含量,对比国标及已有的相关研究结果,验证标签的安全性。
1.3.2.5 指示标签的接触角
采用SDC–100 接触角测量仪在室温下测定标签的接触角。具体过程如下:将标签裁剪成15 mm×15 mm的试样并利用双面胶将其粘贴于玻片上;测试开始时滴加2 μL 的水滴至标签上,拍摄1 s 左右时的接触角图片,并利用仪器自带软件处理角度数据,进行3 组平行测试取平均值。
1.3.2.6 傅里叶变换红外光谱分析
为了研究指示标签中乙基纤维素和花青素的相互作用,使用傅里叶变换红外光谱仪测定纯乙基纤维素膜和指示标签的红外光谱。扫描范围为4 000~500 cm−1,扫描次数为32 次,分辨率为4 cm−1。
1.3.2.7 扫描电镜测试
使用扫描电子显微镜采集标签表面和截面的微观结构。扫描前将标签裁剪为4 mm×4 mm 的正方形试样,真空溅射喷金,加速电压设置为5 kV,电流为50 pA,观察形貌。
1.3.3 牛奶新鲜度的监测
1.3.3.1 牛奶中菌落总数和pH 值的测定
按照GB 4789.2—2016《食品安全国家标准 食品微生物学检验菌落总数测定》[22]对牛奶贮存期间的菌落总数进行测定。以GB 19645—2010《食品安全国家标准 巴氏杀菌乳》[23]的细菌总数标准对牛奶的品质进行评价。
取少量牛奶置于无菌无霉的器皿中,利用均质仪均质后再用pH 计测得牛奶的pH 值。
1.3.3.2 指示标签的应用比色分析
在10 个杯子中分别装入180 mL 牛奶,在保鲜膜内部贴上大小为1.5 cm×1.5 cm 的正方形指示标签。用贴有指示标签的保鲜膜对杯子进行密封,后置于常温条件中贮藏。在隔着保鲜膜的条件下,每隔24 h利用分光密度仪测定标签的L*、a*、b*值,按照公式计算ΔE值并分析。
1.3.4 数据处理
本研究实验内容的性能、指标测定均做3 组平行实验,结果为平均值(Mean)±标准差(SD),使用Office Excel 处理数据、SPSS Statistics 26 进行显著性分析、Origin 2021 软件进行作图。
2 结果与分析
2.1 不同浓度花青素指示标签对不同pH 缓冲液的颜色响应
不同花青素含量的指示标签在不同的pH 值下显示出的颜色见图2,颜色变化既与花青素的含量有关,还与花青素的结构有关。当标签暴露于pH=3的环境时,由于黄烊盐阳离子大量存在使标签颜色显现为粉红色;在pH=4 的环境时,此时黄烊盐阳离子开始少量分解成无色的甲醇假碱,使标签颜色变淡成为淡粉色;在pH=5~6 时,由于无色的甲醇假碱少量转化为紫色的喹啉无水碱基,标签颜色变为紫粉色;在pH=6~7 时,甲醇假碱快速且大量向紫色喹啉无水碱基转移,标签颜色变为紫色[24-26]。标签的颜色随pH 值的变化与Prietto 等[27]制备的黑豆花青素薄膜的颜色变化结果基本一致,证明成功制备了指示标签。

图2 不同质量分数花青素的指示标签在不同pH 缓冲溶液中的显色照片Fig.2 Color rendering photograph of indication labels of different anthocyanin content in different pH buffer solutions
用分光密度仪记录指示标签在pH 值为3~7 的透明缓冲溶液下的颜色参数(L*、a*、b*)。计算总色差ΔE,并比较总色差ΔE与pH 值的关系。根据图3 可知,在pH 值为3~7 时,质量分数为5%的花青素和10%的花青素的总色差ΔE值的差值较大,都超过了12。根据Tassanawatm 等[28]研究可知,ΔE大于5 意味着人眼可以察觉到的颜色变化,ΔE大于12 表示颜色具有绝对差异。说明质量分数为5%的花青素和10%的花青素的标签颜色变化效果明显。这可能是质量分数为5%的花青素添加量的标签颜色偏淡,即使颜色变化也淡,但对比初始色偏淡的标签色差也是较大的,而质量分数为10%的花青素的标签颜色适中且花青素含量足够使其色差变化足够大。基于牛奶的变质过程,牛奶的pH 值变化范围也是集中在4~7[18]。当在pH=5 的总色差∆E附近时,质量分数为10%的花青素的标签颜色变化相对明显。综合说明质量分数为10%的花青素的标签的应用效果最好,因此之后研究的指示标签都以质量分数为10%的花青素制备的指示标签为样本。
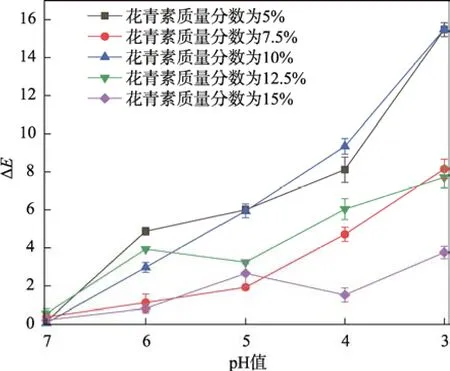
图3 指示标签对不同pH 缓冲液的颜色响应总色差ΔE 与pH 值关系Fig.3 Relationship between pH and total color difference ΔE of color response of indication labels to different pH buffers
2.2 溶胀率和含水率
溶胀可能会影响标签的完整性,从而影响颜色响应性能。因此溶胀率也是衡量指示标签的重要指标,它还可以体现指示标签的物理完整性和耐水性。由图4 看出,从第1 天到第2 天的溶胀率的平均值急剧上升。这是由于水分子通过孔隙不断向核心渗透达到一个峰值,然后在第3 天有一个小幅下降,接下来6 d的溶胀率都围绕第3 天的溶胀率上下小幅震荡,趋于相对平稳状态。结合水溶性结果可知,纯乙基纤维素膜水溶性仅为0.7%,指示标签的水溶性为0.9%,这可能是极少数乙基纤维素从膜中脱落导致。证明该膜材料具有较高的吸水性,且该膜耐水性较好,不易溶于水,可以浸泡在牛奶中做指示标签。

图4 纯乙基纤维素膜和指示标签溶胀率Fig.4 Plot of pure ethyl cellulose membrane and indication label swelling rate
由表1 可知,纯乙基纤维素膜的平均含水率为2.6%,指示标签的平均含水率为3.8%。花青素本身含有少部分的水分子,且指示标签的孔隙结构更多,使部分水分子的可接触面积更大,更好地残留在标签内部使得平均含水率更高。

表1 纯乙基纤维素膜和指示标签的含水率及水溶性Tab.1 Water content and water solubility of pure ethyl cellulose membrane and indicator label
2.3 迁移测试
利用紫外分光光度仪,分别测1.3.2.4 节中各浓度标准品的吸光度,对应吸光度分别为0、0.32、0.654、1.021、1.396、1.751。以标准品的花青素浓度为横坐标,以吸光度为纵坐标,绘制花青素标准曲线,见图5,标准曲线为y=0.008 8x−0.009 7,R2=0.999 6,满足相关检测标准。取指示标签浸泡的体积分数为50%的乙醇溶液(含0.8%的盐酸)多次测其吸光度,得到吸光度均值为0.000 3。将均值代入标准曲线公式中,得出溶液中迁移的花青素质量浓度为1.136 μg/mL,即一盒180 mL 规格的巴氏杀菌乳中含花青增加量为0.204 mg。花青素为酚类物质,Pandey 等[29]通过对乳制品添加花青素,不仅提高了乳制品的营养特性,还增加了抗氧化性而延长了贮存时间,Vázquez 等[30]通过研究得出牛乳自身酚类物质含量为(49.00±10.77)mg/L,因此1.1 mg 的酚类物质添加量不会对牛乳造成影响。

图5 花青素标准曲线Fig.5 Standard curve of anthocyanin
通过分析天平称量指示标签的质量,可知每张指示标签平均质量为38 mg,根据比例得乙基纤维素约为25 mg、吐温80 约为6.3 mg、甘油约为6.3 mg。乙基纤维素为水不溶性纤维,不会与牛奶反应造成安全问题。根据GB 2760—2014《食品安全国家标准 食品添加剂使用标准》可知,吐温80 的添加量不能超过1.5 g/kg,食品级甘油的添加量不能超过5 g/kg。因此,如若标签中的吐温80 与甘油全部迁移至产品中,也不会超过国标限量而引起安全问题,该标签误食也不会存在安全问题。
2.4 接触角
接触角是衡量液体对材料表面润湿性能的重要参数。如表2 所示,未加花青素的纯乙基纤维素膜的平均接触角为102.15°,这与乙基纤维素是疏水材料相符,证明纯乙基纤维素膜是疏水膜。指示标签的接触角为88.61°,这与胡婉婷等[31]发现的当乙基纤维素的质量分数超过25%时,大量的乙基纤维素颗粒使复合膜结构的致密性下降,水分子更容易渗透进复合膜内部的结果是一致的。又因为指示标签含水溶性花青素,所以水在渗进孔隙的同时会与花青素结合,导致了该指示标签接触角比未加花青素的乙基纤维素的标签还小,展现出亲水性。这也是指示标签可以显色的前提,且该标签实际上还是表现出耐水性,结合2.2 节溶胀率和水溶性实验的结果也可以证明该观点。

表2 纯乙基纤维素膜和指示标签接触角Tab.2 Pure ethyl cellulose membrane and indication label contact angle
2.5 傅里叶变换红外光谱
由图6 可以看出,在673 cm−1处的特征峰属于乙基纤维素中的C−H 振动特征峰,加入蓝莓花青素后,吸收峰强度明显增强,这可能是部分花青素芳香环结构发生了邻位取代引起的。在1 051 cm−1处的特征峰是乙基纤维素的C−O 特征峰。在1 643 cm−1处的吸收峰是由于膜中含少量乙醇的部分羟基,而指示标签中少量花青素与水分子密切结合产生了一个小的加强峰,可以初步推断花青素包埋进了乙基纤维素里。在3 350 cm−1和3 365.62 cm−1附近都有明显强而宽的O−H 伸缩振动峰,而花青素的加入使特征峰发生偏移,同时可以看到花青素的加入使这个峰得到加强,表明花青素被良好地包埋进乙基纤维素里。

图6 傅里叶变换红外光谱图Fig.6 Fourier transform infrared spectrogram
已知乙基纤维素的非离子醚键具有良好的稳定性,不与酸、碱、氧化剂和还原剂相互作用[32]。因此,乙基纤维素中的醚键不参与体系中分子间氢键的形成。然而,乙基纤维素的OH 可作为H 键受体,而花青素中的Ar−OH 具有良好的反应性,可作为氢键供体。乙基纤维素和花青素成功发生物理交联,两者形成Ar−OH…HO−R 的氢键,破坏了乙基纤维素的有序排列,导致物理性质的改变。这与Su 等[33]研究的辣椒素和乙基纤维素的相互作用一致,由此得出交联的化学结构如图7 所示。

图7 乙基纤维素和花青素间氢键相互作用Fig.7 Interaction of hydrogen bonding between ethyl cellulose and anthocyanins
2.6 扫描电镜分析
通过图8 扫描电镜图分析纯乙基纤维素膜和指示标签的表面和截面结构。在5 000 倍下可以清楚看到纯乙基纤维素膜存在很多孔隙结构,与高红芳[34]制备的乙基纤维素复合膜形貌结果一致。同时还可以清楚地看到条状结构的纤维素,而指示标签的结构上有很多颗粒,这些颗粒为花青素,该结构也证明了2.5 节中傅里叶变换红外光谱的分析,即花青素和乙基纤维素由于氢键作用复合在一起。随着花青素的加入,指示标签的厚度明显增加,纯乙基纤维素膜的平均厚度为 288.17 μm,而指示标签的平均厚度为530.95 μm。花青素与乙基纤维素发生了氢键作用,破坏了乙基纤维素的有序排列,增加了标签的网络交错结构和孔隙率,导致厚度增加。Chu 等[35]通过加入精油减少花青素对原有结构的破坏,也证明了花青素的加入会对乙基纤维素的有序排列造成影响。

图8 纯乙基纤维素膜和指示标签SEM 图Fig.8 SEM images of pure ethyl cellulose membrane and indication label
2.7 牛奶新鲜度监测
菌落总数是判断牛奶品质的重要指标,根据GB 19645—2010《食品安全国家标准 巴氏杀菌乳》的规定,1 mL 牛奶的菌落总数限量为105CFU/mL,1 mL牛奶的大肠菌群限量为5 CFU/mL,若超过国标限度则牛奶变质,不可正常食用。在牛奶贮藏期间,微生物的生长会导致乳酸的积累和pH 值变化,对标签颜色造成影响。
由图9 可知,第1 天菌落总数为0,pH 值为(6.73±0.02),此时牛奶处于新鲜可食用状态。第2天,菌落总数为1 000 CFU/mL,pH 值小幅下降为(6.67±0.02),牛奶依旧新鲜可食。第3 天,菌落总数上升至5.95×104CFU/mL,此时pH 值也较快跌至(5.28±0.03),此时细菌总数相比于第2 天的细菌总数增长明显。这可能是因为第2 天已有细菌滋生,使牛奶中蛋白质部分变质,有利于细菌吸收生长繁殖,分解利用了牛奶中的蛋白质和乳糖等物质,牛奶开始变酸,此时牛奶需要尽快食用。保存至第4 天时的细菌总数为1.302×105CFU/mL,pH 值为(4.21±0.01),完全超过国标105CFU/mL 的限定值。说明此时牛奶处于变质状态,已经不能食用,且之后菌落总数已经严重超标,甚至无法进行菌落计数了。

图9 牛奶中菌落总数和pH 值变化Fig.9 Changes in total colonies and pH in milk
2.8 指示标签的应用比色分析
随着贮藏时间的延长,牛奶中指示标签的颜色随之发生相应变化。贮藏期内指示标签的颜色和总色差变化见图10。结合2.7 节的菌落总数结果,第1、2天为新鲜牛奶,此时由于牛奶的渗入使指示标签的颜色为浅紫色,总色差变化也没超过5,颜色变化肉眼不可见。第3 天的菌落总数接近国标限值,牛奶还未变质,指示标签颜色为粉紫色,总色差与第1 天指示标签的总色差差值达到11.09,属于人眼可观察到的颜色变化。第4 天的菌落总数已超过国标限值,指示标签的颜色为粉色,总色差差值达到16.15,此时标签颜色存在绝对差异。标签在牛奶中的应用比在缓冲溶液中的总色差变化更加明显,这可能是新鲜牛奶的白色在一开始抑制了标签的紫色,使标签显示的是新鲜时的淡紫色与变质时的粉色,使颜色区别更加明显,实际应用效果比在缓冲溶液中更好。该标签实际应用时颜色变化与Kang 等[36]制备的应用于对挥发性氨监测的比色膜的变化一致。
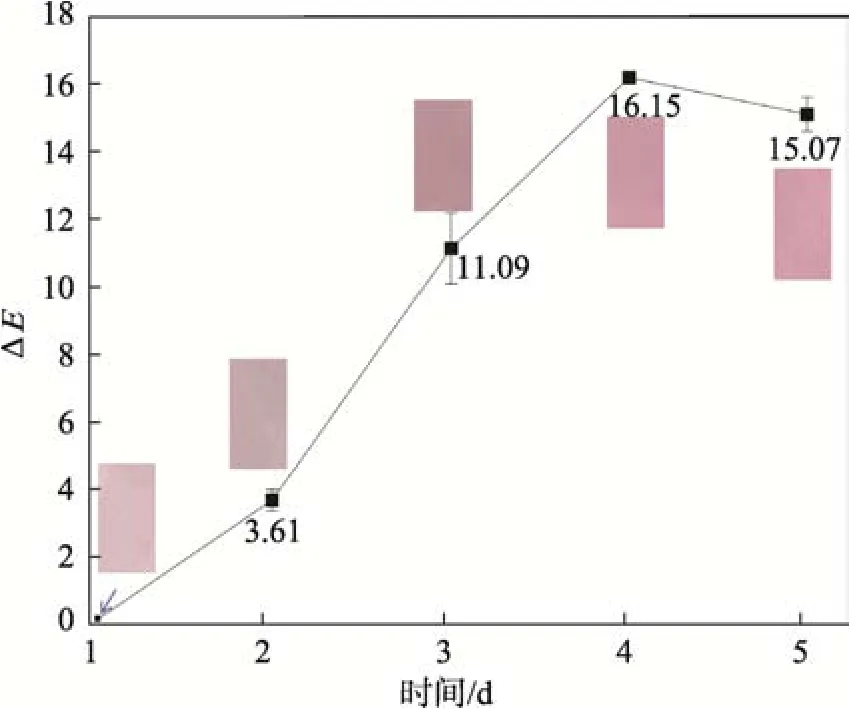
图10 指示标签在牛奶中应用的总色差变化Fig.10 Total color difference change of indication label in milk
由2.7 节的菌落总数结果可知,前4 天为牛奶变质的过程,因此,相关性取前4 天的结果进行分析。指示标签的总色差∆E与pH 值、菌落总数之间的相关性结果见表3,相关性分别为0.022 和0.038,均小于0.05,说明指标之间存在显著相关性。再通过对牛奶变质过程中的指示标签总色差∆E和菌落总数、牛奶pH 分别进行线性回归拟合,结果见图11,可得决定系数(R2)分别为0.926 2 和0.957 3。表明指示标签总色差∆E变化和牛奶变质过程中菌落总数、牛奶pH 的变化存在相关性。证明该标签可用于牛奶新鲜度的监测。

表3 指示标签总色差变化和pH 值、菌落总数变化的相关性和显著性分析Tab.3 Correlation and significance analysis on change of total color difference of indication label, pH and total colonies

图11 指示标签∆E 与菌落总数和牛奶pH 的回归拟合分析结果Fig.11 Regression fitting analysis results of indication label ∆E versus total colonies and milk pH
3 结语
本研究以乙基纤维素为聚合物基材,蓝莓花青素为pH 敏感染料,吐温80 和甘油为增塑剂,制备出了一种安全无毒且耐水性好可浸泡在牛奶中的食品级新鲜度指示标签。通过比色分析、溶胀率、迁移测试、接触角、傅里叶变换红外光谱、扫描电镜等对指示标签性能进行测试表征,结果表明标签中的乙基纤维素与花青素发生物理交联,产生氢键作用,标签孔隙增大,牛奶更易渗入标签并提高标签的显色效果。迁移测试结果表明,该标签花青素迁移量少且其他成分迁移均在相关要求范围内,不会对牛奶安全造成影响,即使误食标签也不会造成安全问题。溶胀率和接触角结果证明,虽然该标签表面润湿性能较好,但耐水性好,仍属于不溶性标签,可以浸泡在溶液中,更符合实际应用场景。将该标签应用于牛奶新鲜度实际监测,常温条件下,前2 天新鲜牛奶中标签的总色差变化仅为肉眼不可见的3.61,第3 天亚变质牛奶中指示标签的总色差变化为肉眼可见的11.09,第4 天变质牛奶的指示标签总色差变化达到了颜色绝对差异的16.15。结合牛奶中菌落总数、pH值与指示标签总色差存在显著相关性,证明该指示标签在牛奶变质过程中的指示是有效的,可用于实时指示牛奶的新鲜度。

