蝴蝶兰外植体(花梗)消毒效果试验研究
刘钰 周胜芳 夏豫川 任羽


摘 要 以开花后的蝴蝶兰花梗为外植体,对影响外植体诱导的消毒方式、二次消毒、外源激素等进行探究,对蝴蝶兰外植体实验过程中产生的污染进行原因分析。试验结果表明: ① 0.1%的HgCl2消毒16分钟时效果最好;0.15% HgCl2的消毒效果要优于0.1%的,且在消毒10分钟时效果最好。② 对污染的花梗进行二次消毒,按初次消毒的方式消毒后,再用多菌灵浸泡15分钟后放入添加抗生素的培养基效果最好。
关键字 蝴蝶兰;诱导;组织培养;污染
蝴蝶兰,是兰科蝴蝶兰属的常绿草本植物。因蝴蝶兰的色彩鲜艳、造型别致、花期较长而享有“洋兰皇后”的美誉,深得消费者的喜爱。蝴蝶兰的叶大、茎短、花一到数枚,由于花形似蝶得名,与卡特兰、石斛兰、万代兰并称为四大观赏兰。目前已经发现超过70个蝴蝶兰的原生种,其原产于热带、亚热带雨林地区, 我国台湾和东南亚等地区均有分布。现有的蝴蝶兰杂交品种很多,经过官方认证的蝴蝶兰品种已经达到了10万多个,现已在全世界广泛栽植。蝴蝶兰不是寄生性植物,而是附生兰,仅立足于附生物上,在空气中吸收水分,在树皮裂隙的腐殖质中汲取有机物。
蝴蝶兰是单茎性气生兰,其种子小且无胚乳,只有一层非常薄的种皮,在自然条件下很难萌发。因此组织培养是蝴蝶兰快速繁殖的重要途经,植物组织培养技术可以保持植株优良性状,保存种质资源,还能够将蝴蝶兰繁殖周期缩短,从而获得大量的植株。
现在生产和工业上使用的蝴蝶兰植物组织培养技术主要有:①原球茎途径。原球茎途径主要是指采用蝴蝶兰的离体器官如叶、茎等来诱导产生原球茎,进一步诱导原球茎获得分生苗;②利用种子无菌播种得到实生苗;③直接诱导出丛生芽。一直以来,原球茎途径是人们研究的重点,但主要有两方面不足,一是繁殖系数低或容易使母株丧失,二是遗传不稳定,后代容易发生变异。利用丛生芽途径快速繁殖就能很好的解决变异的问题。
根据外植体不同的带菌程度采取有效的消毒措施是组织培养的关键。酒精和升汞是植物组织培养中常用的消毒试剂,能够使蛋白质脱水变性从而达到消毒效果。宋火元研究表明,0.1%升汞对蝴蝶兰外植体有明显的消毒效果,但是处理时间过长后升汞残留较多,其毒性影响了外植体的生长,在消毒时间超过22分钟时外植体甚至完全失活。因此研究外植体消毒时间对外植体脱毒效果的影响,对蝴蝶兰扩繁产业有重要的 意义。
1 材料与方法
1.1 材料 蝴蝶兰花梗取自西华师范大学生命科学学院培养室。
1.2 方法
1)外植体的消毒。选择生长健壮的蝴蝶兰植株,取已开花的花梗作为诱导的外植体材料,不破坏腋芽。枝剪消毒后将外植体剪成2~3 cm的小段,每段含一个腋芽,先用洗洁精溶液冲洗去表面的灰尘杂质,放入肥皂水浸泡20~30分钟后,再用自来水冲洗20~30分钟,然后进行无菌消毒处理。
在超净工作台上先用75%的酒精消毒30秒后用HgCl2(升汞)消毒(浓度及时间见表1),然后用无菌水沖洗茎段上残留的HgCl2,再用无菌滤纸吸干水分后放置在无菌盘中,将花梗切成 1~1.5 cm 的茎段(保留腋芽,并将花梗腋芽外的包叶剥去),芽的下端斜切,上端平切,顺势插于培养基中,不要淹没芽点。培养室温度设置为(25±1) ℃,光/暗周期14小时/10小时。
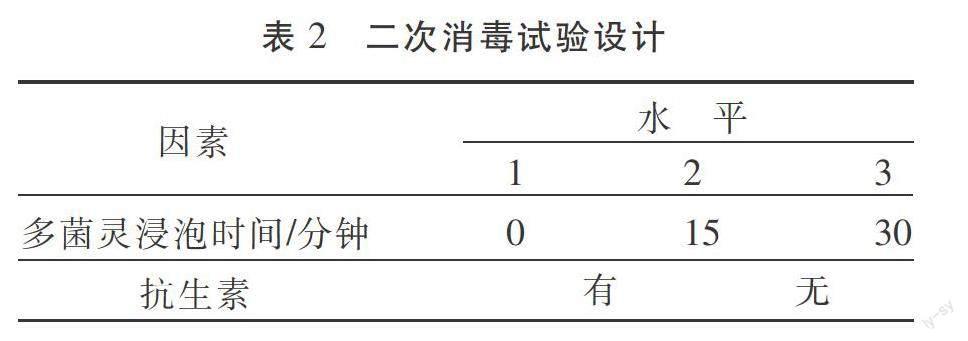
2)二次消毒。将污染的外植体按照初次消毒的方式同样消毒后,放入多菌灵中浸泡(0分钟、15分钟、30分钟)后放入培养基(含抗生素、不含抗生素)。采用正交试验方法设计正交表(表2),接种20天后统计出芽率。
2 结果分析
2.1 消毒方式对外植体诱导的影响 在蝴蝶兰生长过程中,植株体内会携带一定的内生菌,要达到彻底消毒的效果,关键是选择有效的消毒方式。从表4中可以看出,当HgCl2的浓度为0.1%时,消毒的时间越长,消毒的效果越好,其污染率越低,0.1%HgCl2消毒16分钟效果最好,但是存活率为零。可能是因HgCl2毒性大损伤腋芽影响植株正常生长。HgCl2浓度为0.1%时,最佳消毒时间为14分钟。但此组消毒效果不理想,或许是由于外植体自身携带的病菌较多或操作过程出现失误所致。0.15%的消毒效果优于0.1%,0.15%氯化汞消毒10分钟,污染率20%,存活率80%,效果最好,但随着消毒时间的增加污染率呈现先降低后增加的趋势。
2.2 二次消毒效果对比 经过和二次消毒后结果见表4。可以看出,在相同的多菌灵浸泡时间下,培养基中添加抗生素二次消毒效果更好;在相同的培养基中,使用多菌灵浸泡,二次消毒效果更好,多菌灵浸泡15分钟污染率虽达50%、但存活率较浸泡30分钟高出25%。综合考虑使用多菌灵浸泡15分钟后植入添加抗生素的培养基效果较好。
3 污染原因分析
污染是蝴蝶兰组培过程中无法回避的。培养基滋生各种霉菌,影响组培材料生长、发育。在工厂化育苗过程中,若是污染率持续走高,导致蝴蝶兰组织培养的成本升高,将影响整个工厂化育苗的成功与否。
3.1 外植体 外植体是植物组织培养或其他体外实验的植物器官和组织的切段。蝴蝶兰外植体长期暴露在空气中,与外界的环境直接接触,对外植体灭菌不彻底,是导致污染的一个十分重要因素。外植体内携带的病原菌产生的污染是全身性的,占一定比例。具体表现为:通常培养数周后,外植体携带的病菌从培养基接触外植体的地方扩散开来,甚至直接从外植体中长出。
3.2 环境 在操作过程中,接种台周围,或者环境中含有霉菌和成熟孢子,组培苗污染率将会大大提高。
3.3 操作不规范 接种过程中使用的各种器械,如镊子、接种盘等工具灭菌不完全会导致污染,不规范操作也会造成污染。整个接种过程步骤和操作繁杂,接种人员不经意会造成工具污染。
3.4 后期管理 接种工作完成后,组培瓶放在培养室培养,不仅要严格把控培养室的温度和光照情况,卫生状况也要严格要求。培养室保持干燥,防止霉菌滋生,及时观察和清除污染的瓶苗。
4 褐化
在整个组织培养过程中,蝴蝶兰材料常常出现褐化现象。产生褐化主要是因为植物组织多酚氧化酶和酚类物质相结合,在氧气的作用下发生化学反应形成醌类物质。醌类物质呈褐色,当其进入培养基不仅影响植物体内酶的活性,使得植物无法正常代谢,还甚至会使植物死亡。
为防止褐化常常使用抗氧化剂和吸附剂。抗氧化剂主要有维生素等,吸附剂有活性炭等。谷胱甘肽和柠檬酸一般控制褐变,但对植物生根和芽形成影响不大。及时切除变黑区域,及时更换培养基也可以有效防止变褐化。
5 结论与讨论
茎尖、叶片、根尖、顶芽等都可以用作外植体进行组织培养,不同部位方法和难易程度不同,如选用腋芽为外植体,蝴蝶兰植株损伤小且取材方便。研究外植体升汞消毒时间对外植体脱毒效果的影响,为蝴蝶兰扩繁产业提供理论依据。当前常见的花梗消毒处理方式是采用0.1%升汞浸泡,具有方法简单,消毒效率高的优点,但是安全性低。付镇芳等将NaClO(次氯酸钠)溶液和升汞的消毒效果进行比较,发现NaClO溶液的消毒杀菌作用远不如升汞好。
本实验考虑到取开花后的花梗作为外植体,故使用0.1%、0.15% 的HgCl2对外植体进行消毒。研究表明在HgCl2的浓度为0.1%时,消毒的时间越长,消毒的效果越好,但是随着消毒时间的增加存活率降低。当HgCl2的浓度为0.15%时,结果显示0.15%HgCl2消毒效果要优于0.1%。当0.15%HgCl2的氯化汞消毒10分钟时,消毒效果最好,随着消毒时间的增加污染率呈现先降低后增加的趨势。
蝴蝶兰花梗外植体宝贵,污染后直接扔掉很浪费,因此将污染的外植体进行二次消毒对工厂化育苗和实验室培养都有着重要的意义。对初次消毒后污染的蝴蝶兰花梗外植体进行二次消毒,研究表明多菌灵和抗生素对二次消毒的效果较好,但多菌灵浸泡时间过长,毒性大损伤芽,影响植株正常生长。
参考文献
[1] 卢思聪. 中国兰与洋兰[M]. 北京:金盾出版社, 1994.
[2] 黄胜琴, 郭建军, 叶庆生, 等. 温度对蝴蝶兰成花诱导的研究初探[J]. 中山大学学报(自然科学版), 2003(04): 132-134.
[3] 曹孜义,刘国民. 实用植物组织培养技术教程[M].甘肃:甘肃科学技术出版社, 1996.
[4] 陈宇勒. 洋兰欣赏与栽培图说[M].北京:金盾出版社 , 2004.
[5] Park S Y ,Murthy H N ,Paek K Y . Rapid propagation ofPhalaenopsisfrom floral stalk-derived leaves[J]. In Vitro Cellular & Developmental Biology - Plant, 2002, 38(2):168-172.
[6] Ya Huei CHEN,Yi Jung TSAI,Fure Chyi CHEN.Transcription analysis of peloric mutants of Phalaenopsis orchids derived from tissue culture[J].Cell Research,2005(08):639-657.
[7] 潘学峰, 王安石, 李海珠. 蝴蝶兰组培快繁技术的研究进展[J]. 热带林业, 2005(01): 45-47.
[8] 杨松宸,赵德刚,赵懿琛.六盘水小黄姜脱毒快繁技术及遗传变异研究[J].分子植物育种,2017,15(12):5 070-5 078.
[9] 胡凯,张立军,白雪梅,等.植物组织培养污染原因分析及外植体的消毒[J].安徽农业科学,2007(03):680-681.
[10] 宋火元.不同消毒处理及保存时间对蝴蝶兰外植体脱毒效果的影响[J].现代园艺,2019,42(17):31-33.
[11] 陈桂敏,郑羽书,杨佩华,等.不同外植体对蝴蝶兰组培快繁的影响[J].中国园艺文摘,2013(11):15-16.
[12] 张彩玲.蝴蝶兰花梗组织培养与快速繁殖的研究[J].中国林副特产,2010(5):42-44.
[13] Chen Y C ,Chen C ,Chang W C . A reliable protocol for plant regeneration from callus culture of Phalaenopsis[J]. vitro cellular & developmental biology plant, 2000, 36(5):420-423.
[14] 付镇芳,何博,马杰,等.蝴蝶兰“大辣椒”花梗组织快繁技术研究[J].林业科技通讯,2017(05):66-69.
[15] 周利利. 蝴蝶兰组培快繁体系的建立[D].杭州:浙江农林大学,2017.
[16] 高壮壮,娄倩,刘雅莉.蝴蝶兰‘大辣椒组培快繁技术体系的优化[J].西北林学院学报,2020,35(04):95-100+211.

