长安八水有机污染物动态分布及对渭河干流水环境的影响
杨雨新,王 琪,朱 凝,王军锋
( 1. 陕西学前师范学院化学化工学院,陕西 西安 710100;2. 临沂大学,山东 临沂 276000;3. 杭州电子科技大学材料科学与工程学院,浙江 杭州 310018)
0 引言
本文将长安八水(渭、泾、沣、涝、潏、滈、浐、灞八条河流)的水环境质量变化做为主要研究目的,揭示八条河流全流域水污染物特别是可溶性化学有机污染物的动态分布特征。利用三维荧光光谱技术提供的全方位、大数据信息,辅助平行因子数据处理技术对河流上中下游水中的腐殖质类物质、蛋白质、碳水化合物、脂类等溶解性有机物(DOM)[1]和有色溶解性有机物(CDOM)分布和含量进行系统检测,确立八水中有机物污染物动态分布特征,研判对干流渭河水环境质量的综合影响。
三维荧光光谱(Three-dimension excitation emission matrix fluorescence spectroscopy,3D-EEM)是将物质荧光强度随激发光波长和发射光波长的动态变化用三维矩阵形式呈现的一种新荧光分析检测技术,由于运用3D扫描,可提供比二维矩阵更加丰富的大信息量数据;为了实现对三维荧光光谱矩阵数据的完整解析,本文采用了平行因子分析技术(Matlab),采用交替最小二乘法原理的迭代型算法,用二分法和残差分析法检验了平行因子分析模型的有效性,实现通过荧光参数有效追踪有机污染物的来源及分布特征。
以新技术方法3D-EEM及具有数据处理功能的Matlab平行因子算法,对长安八水中污染程度最重、危害也最严重的化学污染物,特别是可溶性有机污染物分布特征及动态变化进行检测、监控及建模,提供系统、完善及全面的数据支持,助力“长安八水”的污染防治和治理,为“八水绕长安”的盛世美景再现贡献力量。
1 材料与方法
1.1 区域概况
实验采样研究的河流为泾河、滈河、浐河、灞河和干流渭河。泾河,黄河支流渭河的第一大支流,全长455.1 km(泾川县志记为451 km),流域面积45421 km2;滈河,渭河的三级支流,全长46 km,流域面积292 km2;灞河,渭河的一级支流,全长109 km,流域面积2581 km2;浐河,渭河的支流,灞河的一级支流,全流域面积760 km2,河道最大汇流长度64.6 km。
1.2 水样采集及预处理
在浐河的上、中、下游设置3个采样点,为1:纬度34.213358,经度109.043534、2:纬度34.285360,经度109.032795、3:纬度34.333558,经度109.012827;在灞河上、中、下游及浐河汇入灞河后设置4个采样点,分别为4:纬度34.247944,经度109.140192、5:纬度34.322785,经度109.039038、6:纬度34.341045,经度109.017512、7:纬度34.344639,经度109.014239;在灞河汇入渭河前、汇入后、泾河汇入渭河后共设置3个采样点,分别为8:纬度34.440965,经度108.998727、9:纬度34.447196,经度109.040052、10:纬度34.469577,经度109.070903;在泾河的上、中、下游分别设置3个采样点,分别为11:纬度34°27′57.1707″N,经度108°58′2.9287″E、12:纬度34°27′3.1437′′N,经度108°59′47.6888″E、13:纬度34°28′15.8645′′N,经度109°3′45.4111″E;在滈河的上、中、下游设置3个采样点,分别为14:纬度34°6′26.6038′′N,经度108°55′56.9293″E,15:纬度34°6′49.2355′′N,经度108°54′57.9970″E,16:纬度34°7′12.4831′′N,经度108°53′26.9048″E。具体位置如图1所示。
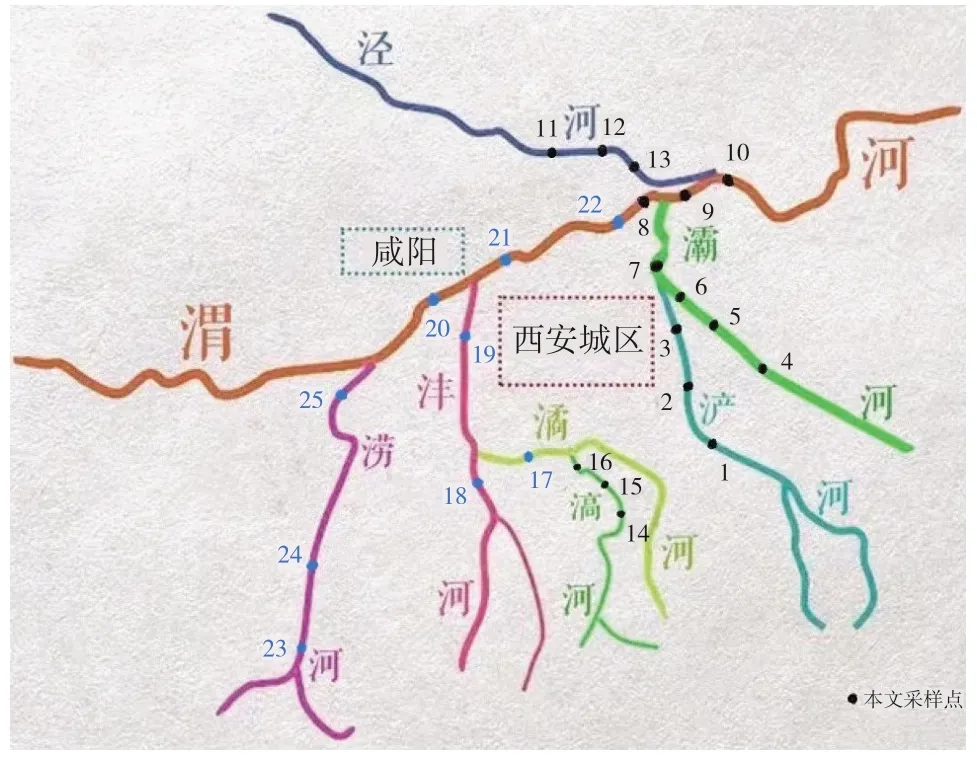
图1 采样点设置
根据河水流向逆向采集水样,在每个采样点随机采集3次,并将3个样品混合均匀,装入500 mL硬质玻璃水样瓶中记录温度与pH,并将其作为该取样点的样品标记和记录,在室温下保存,并在当天带回实验室用砂芯装置(50 mm微孔滤膜)过滤后保存在冰箱内待分析。
1.3 仪器分析
使用日立F-7000荧光分光光度计,利用砂芯装置对经沉淀后的样品进行过滤,用荧光法对过滤后的水样进行扫描,采用娃哈哈矿泉水为空白,并在参数设置页面设置参数。在每次扫描时,激发波长和发射波长范围是不变的,分别为200~400 nm 和290~550 nm,狭缝宽度被设定为5 nm,PMT电压被设定为400 V,扫描速度被选择为60000 nm/min。
2 Matlab-PARAFAC分析法
PARAFAC分析方法可以从荧光数据中分离出各个样品的荧光成分,并与样品相对应,从而求得其最大荧光强度值(Fmax)。其基本原理是通过对扣除空白散射后的三维荧光矩阵进行多次迭代和分离,使其具有N因子的三维三线性组分矩阵及相应的残差项[2]。根据PARAFAC法有:
式中:Xijk—三维三线性矩阵X中的任意一个数据;ain、bjn和ckn—矩阵A(I×N)、B(J×N)、C(K×N)中的组成元素;eijk—组成三维残差阵E的元素。
在Matlab软件中,采用drEEM工具箱进行PARAFAC法的运算,图2显示了具体的运算步骤。
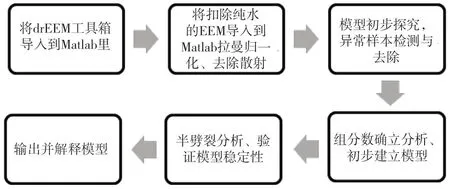
图2 运算步骤
以浐河为例,进行Matlab-平行因子法计算。首先将浐河EEM数据导入到Excel里进行纯水扣除,将扣除纯水后的EEM数据、发射波(Em)、激发波(Ex)导入到Matlab工作区中。
2.1 拉曼归一化及散射去除
对数据进行处理,即拉曼归一化,将之全部转换为拉曼单位(R.U.)。拉曼归一化的原理是将荧光强度进行一种归一化处理,在不改变荧光特征的情况下,使得不同源的荧光图可以放在一起进行分析对比。水的波长相关拉曼截面是水的固定属性,测量的拉曼峰的积分与其成正比,因此可以校准在不同仪器上进行的测量,积分计算公式如下:
本文采用Ex=350 nm处Em=370~430 nm的积分。按照定积分的定义计算,将其看做许多梯形的面积和就得到了拉曼积分,用浐河荧光值除以拉曼积分,得到的新数据就是拉曼单位。
荧光数据经常受到散射效应的困扰:主要是瑞利(Rayleigh)和拉曼(Raman)散射,这可能会妨碍数据的PARAFAC建模。为确保散射峰不影响有机物的荧光强度,在数据分析前应将其去除。研究时将发射波长(Em)>600 nm以及激发波长(Ex)<200 nm范围内的散射峰去除(见图3)。

图3 去除散射峰
2.2 平行因子模型组分数验证
用去除散射峰后的浐河所有荧光数据在Matlab中建立3-D荧光矩阵(样品个数×激发波长个数×发射波长个数),荧光矩阵中的每一面都表示一个样品数据,其中每一面中一行对应一种特定的激发波长,每个列对应一个特定的发射波长,最后形成一个由多个样品的三维荧光数据组成的3-D矩阵[3]。采用drEEM工具箱程序中的PARAFAC算法进行组分模型的建立,如图4所示。
为了评估应该采用模型组分数的合理性,本文采用核心一致性诊断得到PARAFAC模型中成分数量的指示。核一致诊断法可以估计数据集所需要采用的成分数,核一致诊断法的定义核一致函数为:
式中:gigk—用Tucker3方法处理数据阵得到核心阵的元素;tijk—一个三维矩阵其对角矩阵元素为1,其他元素是0(在理想条件下,采用Tucker3 法求出核心矩阵)。
该公式反映了采用Tucker3方法计算出的核心阵在取不同成分数时的核心阵与取理想成分数时的匹配情况[4]。事实上,如果核一致性函数值接近零或为负数,就意味着所选的成分数大于正确成分数;如果函数的值为1或接近l,就意味着所选成分数小于正确的成分数。通常会设置一个阈值来确定分数是否被高估,这个阈值通常被设置为0.5或0.6 (见图5)。SSE也就是残差平方和,为了更客观地综合判断如何去选择模型,在研究中,通过分析相应波长的荧光强度的残差平方和,将PARAFAC模型的荧光光谱图与原始的三维荧光光谱图进行比较[5]。

图5 核心一致性检验
式中:x—原始光谱中任意激发/发射波长处荧光强度;xi—PARAFAC模型光谱中对应激发/发射波长的荧光强度。
因此,确定PARAFAC模型适当数量成分可以使用残差平方和分析为重要依据。比较不同成分数 PARAFAC模型发射和激发光谱与原始发射和激发光谱荧光强度之间的残差平方和,可以用来分析 PARAFAC模型荧光光谱图和原始三维荧光光谱图之间的一致性趋势与成分数N的关系,为合理选择成分数N提供依据。
2.3 组分模型拆半分析
为了验证PARAFAC模型的稳定性,在本文中进行了拆半检验。确认PARAFAC模型拟合度的最有效方法之一是通过数据集的独立子样本构建相同模型。在拆半检验中,来自不同部分运行的组分的趋势越相似,拟合模型就越稳定。最终的目标是获得一个模型,该模型能够公平地代表当前的问题,即所有可能的样本的总体,从其中获得一个特定的实际样本集。
2.4 组分模型图谱输出
经过拉曼归一化及散射去除、平行因子组分模型数验证、组分模型拆半检验后,确定灞河五组分模型为最佳模型,进一步将PARAFAC组分模型图谱及组分Fmax数据和峰位置数据从Matlab中输出,浐河五组分模型图谱分别如图6所示。
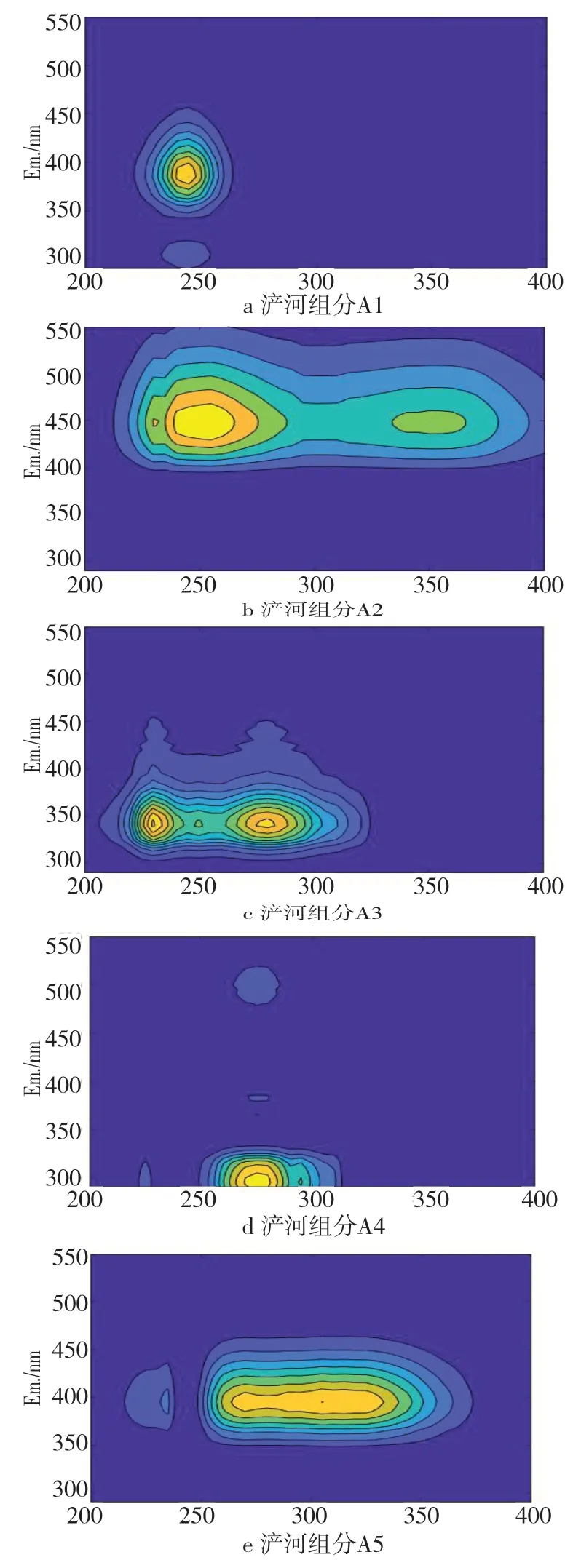
图6 浐河五组分平行因子荧光图谱
3 结果与讨论
3.1 河流样品PARAFAC组分分析
紫外区类富里酸(FUL)主要来源于腐殖质中的富里酸物质,来自于腐烂的动植物经过分解转化形成。类色氨酸(TRY)和类酪氨酸(TYR)主要来源于生物降解的类蛋白质,类蛋白荧光主要来自于微生物的生命活动,包括由外源输入中生活污水和工业废水所携带的微生物以及水体本身的微生物[6]。类色氨酸是一种新鲜的、易生物降解的蛋白质组分,与人为活动相关性较强。Francisco等人的研究表明,类色氨酸是城市污水和食品工业废水中的主要荧光组分。Yingxin等人对中国93个城市水体进行采样调查,发现三维荧光光谱中,发达城市的色氨酸类化合物的荧光强度明显高于欠发达城市[7]。HuaCheng等人的研究表明类酪氨酸比类色氨酸更易发生光降解。类腐殖质组分广泛存在于土壤、河流、河口、海洋等自然环境中。
从图6可以看出,浐河中的荧光有机物有五种主要组分,a中组分A1的最大激发/发射波长为245 nm/385 nm且与表3中紫外类富里酸荧光峰的激发波长和发射波长的范围一致,故组分A1为紫外类富里酸;b中组分A2位于255 nm/450nm处的荧光峰与表3中浮游生物产生的激发波长和发射波长的范围一致,c在230 nm/340 nm处的组分A3的荧光峰与表3中低激发光类色氨酸的激发/发射波长的范围一致,d在275 nm/295 nm处的组分A4荧光峰与表3中类酪氨酸的激发/发射波长范围一致,e在305 nm/395 nm处的组分A5荧光峰和表3中海洋类腐殖质的激发/发射波长的范围一致。
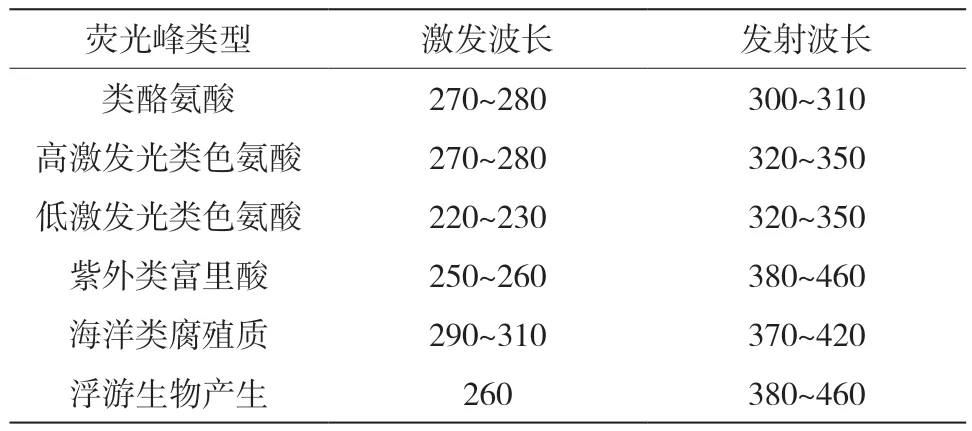
表1 水体中主要荧光集团[8~10] (nm)
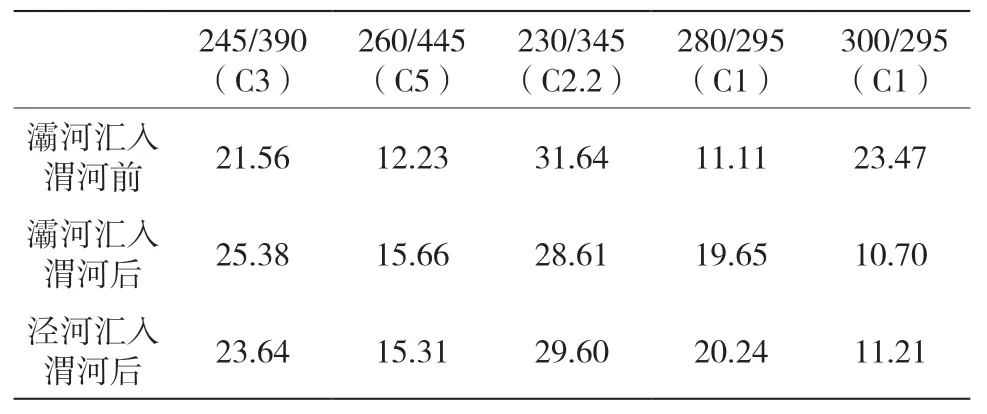
表3 渭河最大激发发射波长及所占百分比汇总(Ex/Em)(%)
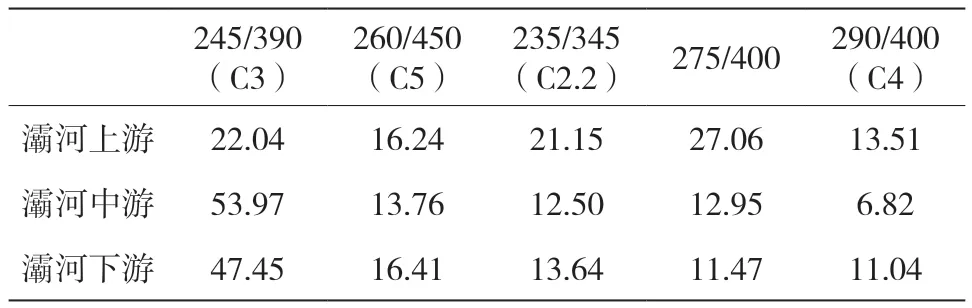
表4 灞河最大激发发射波长及所占百分比汇总(Ex/Em)(%)
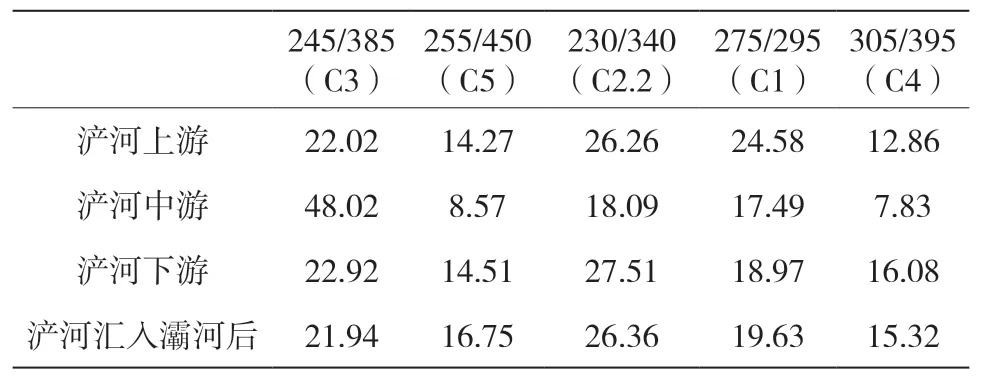
表5 浐河最大激发发射波长及所占百分比汇总(Ex/Em)(%)
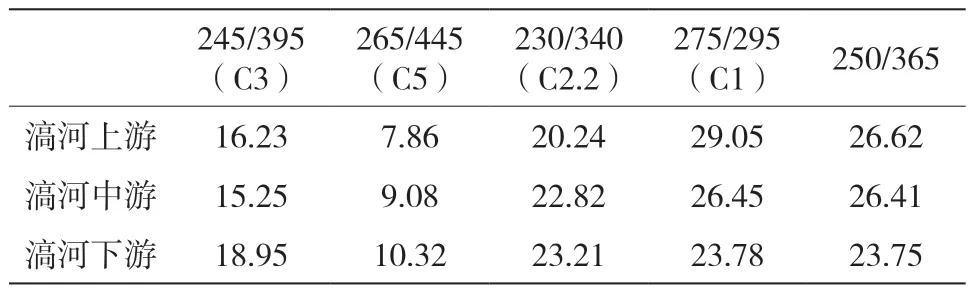
表6 滈河最大激发发射波长及所占百分比汇总(Ex/Em)(%)
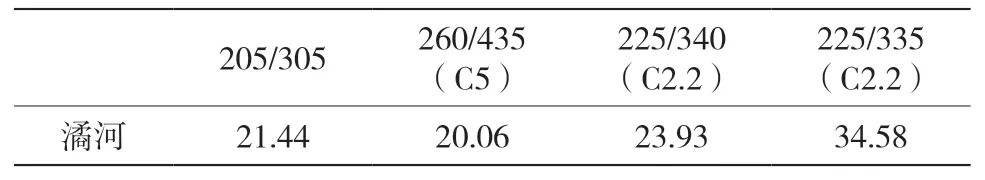
表7 潏河最大激发发射波长及所占百分比汇总(Ex/Em)(%)
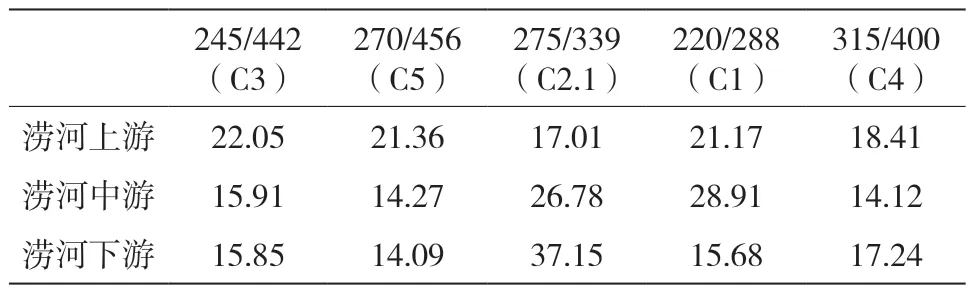
表9 涝河最大激发发射波长及所占百分比汇总(Ex/Em)(%)
以此类推,根据平行因子模型可以识别出浐河、灞河、泾河、滈河、涝河DOM主要为五种荧光组分以及各组分的最大激发和发射波长,渭河、潏河主要为四种荧光组分以及各组分的最大激发发射波长,沣河主要为三种荧光组分以及各组分的最大激发和发射波长,并根据长安八水平行因子荧光图谱的荧光峰找到对应的荧光峰类型。根据发射波长的范围由小至大,用C1组分表示类酪氨酸,用C2.1组分表示高激发光类色氨酸,用C2.2组分表示低激发光类色氨酸,C3组分表示紫外类富里酸,组分C4表示海洋类腐殖质,组分C5表示浮游生物产生,C6表示目前文献尚未报道的DOM类别,并在表中标出。

表2 泾河最大激发发射波长及所占百分比汇总(Ex/Em)(%)
3.2 长安八水水体DOM荧光强度的空间分布
图7为长安八水各采样点的总荧光强度和各组分最大荧光强度的比例在空间上的分布。长安八水水体DOM的荧光强度呈现出“上升-下降-上升-下降”不停起伏的变化规律,其中空间分布总荧光强度最高的点有两个,第一个最高点位于采样点5和6之间,第二个最高点在采样点13处。采样点5和6位于灞河中游和下游,采样点5处于灞河中游的湿地公园,灞河经过湿地公园流速较慢在公园中形成小型湖泊,故腐殖质等有机物含量较多,采样点6附近有施工场地,工业废水和生活污水对其影响较大。采样点13处于泾河下游,河岸两边水草树木较多,腐殖质和浮游植物的分解影响较大。采样点18处的荧光强度最低,采样点18位于沣河上游,因为沣河生态长期得到治理,河水清澈。根据图7中长安八水荧光强度在空间上的分布及变化趋势结合采样点周围环境不难看出其变化与人为影响不可分割,更有利于揭示长安八水DOM来源及影响。
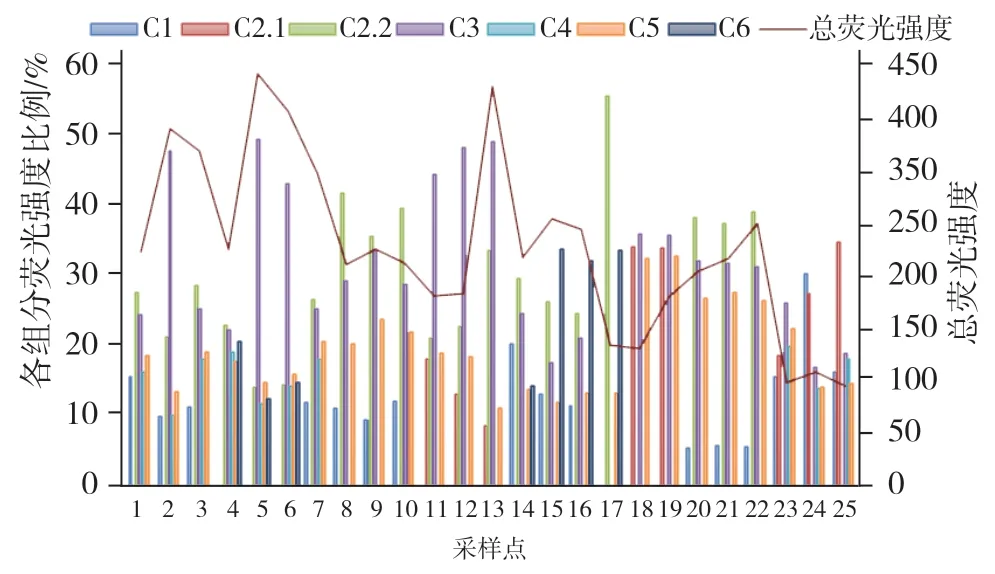
图7 各河流荧光组分贡献率及荧光强度空间分布
3.3 支流对干流水环境的影响
水体中有机物的来源可以分为内源和外源[11]。各河流最大激发/发射波长及所占百分比汇总见表2~表10,类富里酸和类腐殖酸都来自于陆源,类蛋白物质主要受工业废水和居民生活区污水的影响,也是从陆源输入的[12]。泾河总体陆源输入占75%~88%,渭河总体陆源输入占77%~87%,灞河总体陆源输入占83%~86%,浐河总体陆源输入占85%~91%,滈河总体陆源输入占89%~92%,潏河总体陆源输入占80%,沣河总体陆源输入占64%~69%,涝河总体陆源输入占79%~85%,长安八大水体的有机污染源主要是来自工业、生活废水和其他人为活动的陆源污染,辅以浮游生物代谢的污染。
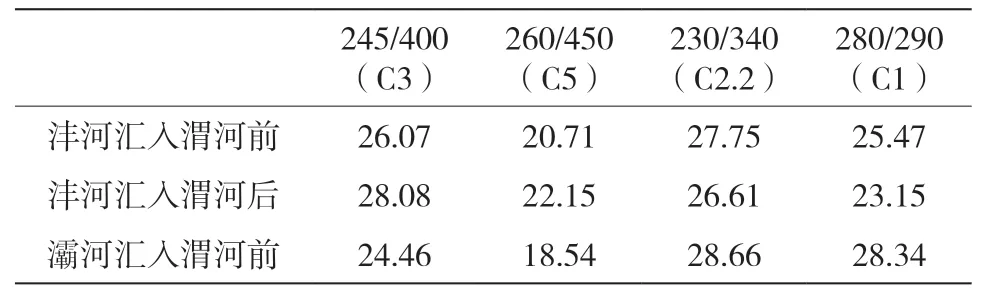
表10 渭河最大激发发射波长及所占百分比汇总(Ex/Em)(%)
3.3.1 三级支流对二级支流的影响
滈河,渭河二级支流潏河的支流,滈河上游紫外类富里酸百分比为16.23%,滈河中游紫外类富里酸百分比为15.25%,滈河下游紫外类富里酸百分比为18.95%,类色氨酸百分比为23.21%,滈河总荧光强度在八水中也是较低的。滈河上中下游整体采样点都位于郊区,河水清澈,环境优美,人为污染影响不大。
潏河中紫外类富里酸消失了,类色氨酸百分比高达58.51%,滈河对潏河没有显著影响,主要是潏河自身的生活污水和工业废水对其有机污染物含量影响较大。
3.3.2 二级支流对一级支流的影响
潏河,渭河的一级支流沣河的支流。沣河上游的陆源输入(紫外类富里酸、类色氨酸)百分比为63.9%,潏河汇入沣河后,沣河下游的陆源输入(紫外类富里酸、类色氨酸)百分比为68.24%,潏河对沣河有机污染物有所影响但影响不是很大,主要得益于沣河生态长期得到有效的治理[13]。
浐河是灞河的一级支流,是渭河的二级支流。浐河经过PARAFAC组分解析出五种组分,浐河上游的陆源输入(类腐殖质、类富里酸、类色氨酸和类酪氨酸)百分比为85.72%,浐河上游采样点位于施工场地,故主要为生活污水和工业废水的外源输入。浐河中游的陆源输入(类腐殖质、类富里酸、类色氨酸和类酪氨酸)百分比为91.43%,浐河中游采样点环境为市区内,周围是住宅区,河周岸有大量水草,主要外源输入为生活污水,浐河上游对浐河中游的影响不容忽视。浐河下游的陆源输入(类腐殖质、类富里酸、类色氨酸和类酪氨酸)百分比为85.48%,浐河下游采样点依旧为市区,经过中游的过渡浐河下游受上游工业废水的影响有所降低,浐河下游主要外源输入为生活污水。
灞河上游紫外类富里酸百分比为22.04%,类色氨酸百分比为21.05%,灞河上游采样点位于郊区,人为影响等陆源输入污染不严重。灞河中游的紫外类富里酸百分比突增为53.97%,灞河中游设置的采样点位于湿地公园中,灞河在公园中被人工降低流速形成小湖泊,因流速太低故河流中腐殖质等有机物含量较多,灞河上游对灞河中游影响不大。灞河下游紫外类富里酸百分比为47.45%,类色氨酸百分比为13.64%,灞河下游采样点周围有施工场地,受生活废水和工业废水影响并且受中游的影响。
浐河下游的紫外类富里酸百分比为22.92%,浐河汇入灞河后灞河紫外类富里酸百分比为21.94%,经过浐河的汇入和灞河流速及流量增大腐殖质类含量有所下降。浐河下游的类色氨酸百分比为27.51%,灞河下游的类色氨酸百分比为13.64%,浐河汇入灞河后灞河的类色氨酸百分比为26.36%,使灞河的类色氨酸百分比升高。类色氨酸是城市污水主要荧光组分,浐河总体处于市区并且上游采样点周围处于施工现场且灞河下游自身采样点周围处于施工现场,故浐河人为污染比较严重并对灞河有所影响。
3.3.3 一级支流对干流的影响
涝河,渭河的一级支流。涝河上游紫外类富里酸百分比为22.05%,类色氨酸百分比为17.01%,因采样点位于村庄,主要有机物来源于腐殖质和生活废水,但对其污染影响不大。涝河中游紫外类富里酸百分比为15.91%,类色氨酸百分比为26.78%,因采样点周围有垃圾场、学校、景区等,故类色氨酸百分比较之上游有所上升,生活污水对其影响较大。涝河下游紫外类富里酸百分比为15.85%,类色氨酸百分比为37.15%,因下游采样点周围有工厂,故工业废水等人为影响较大。涝河汇入渭河后渭河的类色氨酸百分比为27.75%,涝河对渭河的有机污染物有所贡献。
沣河是渭河的一级支流,沣河在涝河汇入渭河流经一段距离之后汇入渭河,沣河汇入后渭河的类色氨酸百分比为26.61%(表2),使渭河类色氨酸百分比降低,沣河汇入渭河后渭河的类色氨酸和类酪氨酸百分比较之沣河汇入前均有所下降。沣河汇入渭河前渭河的陆源输入(类腐殖质、类富里酸、类色氨酸和类酪氨酸)百分比为79.28%,沣河汇入渭河后渭河的陆源输入(类腐殖质、类富里酸、类色氨酸和类酪氨酸)百分比为77.84%,因为沣河环境优美,河水清澈[13],故沣河对渭河起到积极影响。
灞河是渭河的一级支流,灞河在沣河汇入渭河流经一段距离之后汇入渭河。灞河汇入渭河前渭河的紫外类富里酸百分比为21.56%,灞河汇入渭河后渭河的紫外类富里酸百分比变为25.38%,汇入前在渭河的采样点位于郊区,还有人在河边钓鱼,汇入后在渭河的采样点同样位于郊区,河岸周围是森林和农田,灞河对渭河的紫外类富里酸有所贡献,由于渭河自身的人为影响(生活污水和工业废水)不大,故其他有机污染物没有升高且灞河对渭河也没有显著影响。
泾河是渭河的一级支流。泾河上游紫外类富里酸百分比为26.12%,类色氨酸百分比为22.85%,类酪氨酸百分比为27.12%。泾河中游紫外类富里酸百分比为34.41%,类色氨酸百分比为15.81%,类酪氨酸百分比为25.79%。泾河下游紫外类富里酸百分比为59.54%,类色氨酸百分比为10.34%,类酪氨酸百分比为19.105。泾河上游采样点周围工厂较多,河流受工业废水影响较大,故类色氨酸和类酪氨酸含量较多。泾河中游受泾河上游类蛋白质轻微影响,泾河中游采样点河岸两侧有大量水草故受植物分解影响,紫外类富里酸含量增多。到泾河下游人为工业废水影响不大,主要由河岸两侧大量水草、树木以及浮游生物分解所影响。
泾河是在最后汇入渭河。泾河汇入渭河前渭河的紫外类富里酸百分比为25.38%,泾河汇入渭河后渭河的紫外类富里酸百分比为23.64%,类色氨酸百分比由28.61%变为29.60%,类酪氨酸百分比由30.35%变为31.45%,泾河汇入渭河前渭河的陆源输入(类腐殖质、类富里酸、类色氨酸和类酪氨酸)百分比为84.34%,泾河汇入渭河后渭河的陆源输入(类腐殖质、类富里酸、类色氨酸和类酪氨酸)百分比为84.69%,故泾河对渭河没有显著性的贡献。
4 结论
基于Matlab软件-平行因子算法及三维荧光光谱技术对河流有机物通过荧光数据 PARAFAC模型中核心一致性诊断、残差平方和以及拆半检验物理意义的分析,合理估计荧光物质成分数,实现了PARAFAC方法对其成分的分解。长安八大水体中DOM的荧光光谱被分离成五种荧光组分,即类酪氨酸、类色氨酸和紫外类富里酸、海洋类腐殖质以及浮游生物生成组分。在分析荧光成分的相对含量时,主要来源是外源性输入的类色氨酸和紫外类富里酸[14]。揭示了支流河流对干流河流的有机物的影响,其中涝河对渭河有机污染有所贡献,灞河和泾河对渭河有机污染物没显著性贡献,沣河对渭河是良性贡献。推动 EEMs-PARAFAC 法在更广泛的环境监测中的应用。
——美丽的家园

