冠心病痰瘀互结证小型猪血浆代谢组学研究
张国瑗,李磊,孟红旭,王奥奥,王紫艳,胡广,李瑛,马彦雷,史跃,孙明谦,刘建勋
中国中医科学院西苑医院基础医学研究所,中药药理北京市重点实验室,北京 100091
冠状动脉粥样硬化性心脏病(以下简称“冠心病”),是多种危险因素所致的心脏疾病,由冠状动脉血管发生粥样硬化而引起血管腔狭窄或阻塞,造成心肌缺血、缺氧或坏死。冠心病属中医学“胸痹”“真心痛”范畴,其病机为本虚标实,痰瘀互结证是冠心病的基本证型之一[1]。
疾病发展常伴随某些代谢障碍,代谢组学可以对疾病诱导产生的代谢产物变化进行分析,为中医证型诊断的现代化发展提供基础和方向。猪的心血管系统在解剖和病理机制等方面与人类相似,其实验结果有利于推用到人,被认为是制备心血管疾病动物模型的合适动物[2]。而小型猪冠状动脉系统与人类接近,本课题组在小型猪体内建立冠心病痰瘀互结证模型,该模型既符合该病临床发病特点,又满足中医学强调胸痹心痛的发病要求[3]。
人体血浆含有多种内源性小分子代谢物,不同类别代谢物性质复杂,增加了血浆样品分析难度。磷脂是细胞膜的主要成分,存在于血液等生物基质样品中,因磷脂会与目标分析物共洗脱并离子化,引起质谱信号的离子抑制,导致其他类成分检测效率较低,故样品前处理过程对实验结果会产生重要影响。本研究采用超高效液相色谱-四级杆飞行时间质谱(UPLCQTOF-MS)技术和非靶向代谢组学方法,通过有机试剂沉淀蛋白与固相萃取(SPE)去除磷脂相结合的方法对冠心病痰瘀互结证小型猪血浆除磷脂外的代谢物进行代谢组学特征分析,探究冠心病痰瘀互结证小型猪血浆内源性代谢物的变化。
1 材料与方法
1.1 动物
中国实验小型猪12只,雌雄各半,体质量15~20 kg,北京北七家美乐养殖场提供,动物生产许可证号SCXK(京)2018-0004。动物饲养、实验操作均在中国中医科学院西苑医院实验动物中心进行,动物使用许可证号SYXK(京)2018-0018。本研究经中国中医科学院西苑医院动物实验伦理委员会审查批准(2021XLC037)。高脂饲料[4](每100 kg含胆固醇2 kg、胆盐0.5 kg、猪油10 kg),北京科澳协力饲料有限公司提供。
1.2 仪器与试剂
Waters Acquity UPLC 液相色谱系统、Q-TOF SYNAPT G2 HDMS质谱仪、MassLynxV4.1色谱工作站(美国Waters公司),3-18K型高速冷冻离心机(德国Eppendorf公司),VORTEX GENIUS 3型涡旋振荡器(德国IKA公司),Milli-Q gradient A-10纯水仪(美国Millipore公司),96孔SPE装置(美国Waters公司),Ostro 96孔SPE板(美国Waters公司)。乙腈、甲酸为色谱纯,美国Fisher Scientific公司;苏木素染液(珠海贝索生物技术有限公司,货号C201207),伊红染液(珠海贝索生物技术有限公司,货号C200401)。
1.3 分组与造模
将小型猪随机分为对照组和模型组,每组6只。采用高脂饲料喂养结合冠状动脉血管内皮损伤法建立冠心病痰瘀互结证小型猪模型:模型组以高脂饲料喂养(每只900 g/d)2周后,参照文献[4]采用介入法行冠状动脉血管内皮损伤术,术后继续予高脂饲料(剂量同前)喂养8周。对照组仅冠状动脉造影,不进行介入损伤术,并予普通饲料喂养(每只900 g/d)。
1.4 取材
造模结束后,动物禁食14 h,锁骨下静脉采血 3 mL,置肝素钠抗凝管中,4 ℃、3 500 r/min离心10 min,取上层血浆,置于-80 ℃冰箱保存。
1.5 组织病理学观察
取心脏梗死区/非梗死区交界处心肌组织,置4%多聚甲醛溶液中固定,行HE和Masson染色后,显微镜下观察心肌组织病理形态变化。
1.6 样本处理
室温解冻血浆样本,充分混匀后取50 μL,加入96孔SPE板中,加入乙腈-甲醇(1∶1)混合液200 μL,剧烈振摇1 min,通过正压装置在板上施加约15 mm Hg(1 mm Hg=0.133 kPa)压力,使样品均匀流出至样品接受盘中,直至完全排干,所接样品溶液待测。
1.7 色谱及质谱条件
色谱条件:采用Waters BEH C18色谱柱(1.7 μm,2.1 mm×100 mm),柱温40 ℃,样品室温度4 ℃,流动相为0.1%甲酸水(A)-0.1%甲酸乙腈(B),梯度洗脱(0~1 min,30%B;1~10 min,30%~90%B;10~11 min,90%B;11~13 min,90%~30%B;13~15 min,30%B),流速0.3 mL/min,进样量5 μL。
质谱条件:采用电喷雾离子源(ESI),信号采集分别采用正、负离子扫描模式,碰撞气为高纯氩,离子源温度100 ℃,去溶剂气温度400 ℃,锥孔气流量50 L/h,溶剂气流量800 L/h。正离子模式下毛细管电压+3 kV,负离子模式下毛细管电压-2.5 kV。采用全信息串联质谱(MSE)模式进行centroid数据采集,一级扫描范围m/z 50~1 200 Da,采集所有碎片信息,扫描时间0.2 s。采用甲酸钠标准品建立质量轴标准曲线。数据采集过程中,每3 s用Lockspray校正系统进行亮氨酸-脑啡肽([M+H]+556.277 1、[M-H]+554.261 5)实时质量校正。
1.8 数据处理
对收集的MSE数据采用Progenesis QI软件处理,进行峰对齐、峰提取、峰鉴定等操作,使用HMDB(http://www.hmdb.ca/)对二级碎片特征进行比对并验证,获得代谢物信息,包括质荷比、保留时间和峰面积等。将信息导入MetaboAnalyst 5.0(https://www.metaboanalyst.ca/)进行偏最小二乘判别分析(PLS-DA)并初步识别组间差异,通过模型参数Q2(模型的可预测性)和R2(模型的拟合性)评估模型质量。将数据导入EZinfo 2.0,筛选第一主成分变量重要性投影(VIP)>1的代谢物。以VIP>1、差异倍数(FC)>2且t检验P<0.05 为条件筛选潜在差异代谢物。通过MetaboAnalyst 5.0结合KEGG(https://www.kegg.jp/)、HMDB数据库对筛选出的差异代谢物进行代谢通路分析,找出差异代谢物涉及的代谢通路。
2 结果
2.1 模型猪心肌组织病理变化
HE染色显示,对照组心肌组织、心肌细胞形态及结构正常,分布均匀且紧密,心肌纤维排列较整齐、横纹清晰,未见纤维断裂或变形;模型组心肌细胞肥大、排列紊乱,部分心肌细胞核增大、融合,心肌间质水肿,裂隙明显增宽且杂乱,心肌纤维排列无序,部分纤维断裂,肌纤维束增宽。见图1。
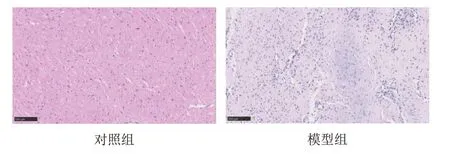
图1 2组小型猪心肌组织形态(HE染色,标尺=100 μm)
Masson染色显示,对照组心肌细胞呈红色,胶原呈蓝色,细胞间无明显胶原纤维沉积,心肌细胞排列整齐、结构清晰;模型组心肌细胞及间质大量胶原纤维增生,心肌细胞排列扭曲,细胞肿胀、结构模糊。见图2。

图2 2组小型猪心肌组织形态(Masson染色,标尺=100 μm)
2.2 血清代谢物分析
使用Progenesis QI软件对2组数据进行峰提取和匹配,正离子模式下共识别出8 585个化合物,负离子模式下共识别出3 417个化合物。正、负离子模式下所得总离子流图见本文OSID码。
2.3 模式识别分析
将处理后的代谢物信息导入MetaboAnalyst 5.0,通过PLS-DA进行有监督的数据分析,得到对照组与模型组PLS-DA得分见图3、图4。

图3 2组小型猪血浆代谢物PLS-DA得分

图4 2组小型猪血浆代谢物三维PLS-DA得分
PLS-DA结果显示,正离子模式下,2组有明显分离趋势,R2=0.998,Q2=0.681;负离子模式下,模型组与对照组有明显区别,R2=0.994,Q2=0.856。在PLS-DA得分图(见图3)中,横坐标表示组间差异,纵坐标表示组内差异,对照组与模型组分离趋势明显,表明模型动物血浆代谢物发生明显改变。在相同模式下,对照组组内差异较模型组组内差异大,而模型组组内差异不明显,原因可能是去除磷脂后对照组比模型组受到的影响更为明显。
2.4 差异代谢物筛选
通过HMDB数据库确定代谢物结构,以VIP>1、FC>2、P<0.05为条件筛选潜在差异代谢物,正离子模式下筛选出9个代谢物,负离子模式下筛选出18个代谢物,差异代谢物主要为胆酸类、脂肪酸类、氨基酸类、酰基肉碱类等(见表1)。胆酸类包括初级胆汁酸[7a,12a-二羟基-3-氧代-4-胆氨酸(7a,12a-dihydroxy-3-oxo-4-cholenoic acid)、3b,12a-二羟基-5a-胆酸(3b,12adihydroxy-5a-cholanoic acid)]和次级胆汁酸[(脱氧胆酸甘氨酸结合物(deoxycholic acid glycine conjugate)、别石胆酸(allolithocholic acid)];脂肪酸类包括十六烷二酸(hexadecanedioic acid)、3-氧代十八烷酸(3-oxooctadecanoic acid)、二十二碳六烯酸(docosahexaenoic acid)等;酰基肉碱类包括丁烯肉碱(butenylcarnitine)、3-羟基-9-十六碳烯酰肉碱(3-hydroxy-9-hexadecenoylcarnitine)、3-羟基十六烷基肉碱(3-hydroxyhex-adecanoylcarnitine)、(9E)-10-硝基十八烷-9- 烯酰肉碱((9E) -10-nitrooctadec-9-enoylcarnitine)等。

表1 2组小型猪血浆潜在差异代谢物
2.5 差异代谢物相关代谢通路分析
将26个潜在差异代谢物通过MetaboAnalyst 5.0结合KEGG和HMDB数据库进行代谢通路分析。结果显示,多条代谢通路受到影响,主要包括肉碱穿梭代谢、内源性大麻素代谢、花生四烯酸代谢、胆汁酸生物合成、亚油酸代谢、脂肪酸代谢、胆碱代谢、丙酮酸代谢、苯乙胺代谢等。
3 讨论
本研究采用高脂饲料喂养结合冠状动脉血管内皮损伤法建立冠心病痰瘀互结证小型猪模型,分析模型组与对照组血浆差异代谢物情况。
高分辨质谱精准度受基质效应的干扰,对血液样品而言,主要受磷脂类物质的干扰[5],因此,样本处理方法采用SPE去除磷脂。有机溶剂如乙腈、甲醇用于解离生物体液样品,去除蛋白质,该方法并不会去除磷脂[6]。前期研究表明,高脂饲料造模后,小型猪血浆中磷脂类成分含量较高,这类成分会对其他成分产生离子抑制,导致检测成分种类相对较少,无法对冠心病痰瘀互结证的代谢途径进行全面分析[7]。同时,磷脂类成分可以采用专门的脂质组学方法进行深入研究,代谢组学方法很难系统地对小型猪脂质组变化进行阐释[8]。本研究样品处理方法同时去除生物样品中的蛋白和磷脂,着重观察除磷脂以外的代谢物,可以降低小分子液相-质谱分析受到的干扰,从而较为全面地分析非磷脂类差异代谢物的变化。研究结果显示,模型组血浆内源性小分子代谢物发生了变化:在正离子模式下,模型组与对照组3-羟基-9-十六碳烯酰肉碱、3-羟基十六烷基肉碱、2-花生四烯基甘油醚、α-亚麻酰乙醇酰胺、白三烯A4、20-COOH-白三烯E4、7a,12a-二羟基-3-氧代-4-胆氨酸、N-肉豆蔻酰赖氨酸、吡啶啉含量有显著差异;在负离子模式下,7a,12a-二羟基-3-氧代-4-胆氨酸、丁烯肉碱、脱氧胆酸甘氨酸结合物、牛磺熊去氧胆酸、石胆酸甘氨酸结合物、甘胆酸、二十二碳六烯酸、L-乳酸、苯乙胺葡糖苷酸等含量有显著差异。
本研究发现,模型组血浆7a,12a-二羟基-3-氧代-4-胆氨酸、脱氧胆酸甘氨酸结合物、3b,12a-二羟基-5a-胆酸、12-酮脱氧胆酸、牛磺熊去氧胆酸、1β-羟基胆酸、石胆酸甘氨酸结合物、甘胆酸、别石胆酸含量升高,提示胆汁酸代谢增加。胆汁酸的生理作用是促进食物内脂类的消化和吸收[9],胆汁酸的生物合成是内源性胆固醇的主要代谢去路,其形成是一个复杂的过程。初级胆汁酸(胆酸和鹅去氧胆酸)由胆固醇在肝细胞内产生,并以牛磺酸和甘氨酸结合物的形式随胆汁排出,再通过胆进入肠道。这些初级胆汁酸被肠道微生物去共轭、去羧基、脱氢、差向异构,形成次级胆汁酸(脱氧胆酸和石胆酸)。本研究中模型组血浆胆酸含量整体上升,提示冠心病痰瘀互结证小型猪体内脂质代谢异常。7a,12a-二羟基-3-氧代-4-胆氨酸、3b,12a-二羟基-5a-胆酸这2种猪胆酸含量升高,有利于对体内代谢异常进行调节。脱氧胆酸甘氨酸结合物、12-酮脱氧胆酸、牛磺熊去氧胆酸、石胆酸甘氨酸结合物、别石胆酸5个次级胆酸含量升高,可能因为胆汁酸的重吸收障碍导致血浆中胆酸含量增加,从而引起继发性损害。Chen等[10]研究显示,12-酮脱氧胆酸、牛磺酸脱氧胆酸、二十二碳六烯酸可作为肾脏损伤的标志物。石胆酸的酸毒性强,可引起肝胆系统障碍,Yang等[11]研究显示,石胆酸能促使肝内胆汁淤积,引起肝损伤。
本研究发现,模型组血浆酰基肉碱类成分含量发生较明显变化,其中4个为长链酰基肉碱类成分。肉碱在线粒体脂肪代谢中起重要作用,酰基肉碱作为肉碱代谢的中间产物,是一类由肉碱与脂肪酸结合而成的结构相似的代谢物。在各种组织和体液中广泛分布,能反映早期脂肪酸氧化失衡和线粒体应激状况。其生物功能是将长链脂肪酸从细胞质转移到线粒体基质中进行β氧化。一些代谢性疾病也以产生和排出异常浓度的酰基肉碱为特征。有研究表明,因线粒体脂质过载、大量脂肪酸不完全氧化而导致线粒体应激,可能是造成体内糖脂代谢异常的原因之一[12-14]。本研究中模型组血浆长链酰基肉碱含量明显增加,可能由于小型猪经高脂饲料喂养后,体内脂质代谢紊乱,脂肪酸氧化代谢受到干扰,进一步加剧体内氧化应激损伤,从而导致疾病加重。
本研究还发现,十六烷二酸、3-氧代十八烷酸、二十二碳六烯酸3个成分含量出现异常,进一步提示该模型脂肪酸代谢异常。肉碱代谢紊乱导致体内脂肪酸代谢途径受阻,因此脂肪酸类成分含量也升高。20-COOH-白三烯E4为白三烯E4的脂质氧化代谢物,属于花生四烯酸类成分。白三烯E4是一种半胱氨酰白三烯,为强效炎症介质,可通过其受体与G蛋白和细胞内信号通路偶联,促进炎症反应。这类成分含量升高提示模型小型猪体内炎症反应增强,可能与其脂质代谢紊乱、氧化应激压力不断增加、冠状动脉内皮拉伤有关。
目前采用代谢组学进行冠心病痰瘀互结证生物信息学分析的报道相对较少,本研究基于液相色谱-质谱联用技术,采用有机溶剂沉淀蛋白和SPE相结合的样品处理方法,对冠心病痰瘀互结证小型猪血浆除磷脂外的代谢物进行代谢组学特征分析,筛选出7a,12a-二羟基-3-氧代-4-胆氨酸、3b,12a-二羟基-5a-胆酸、脱氧胆酸甘氨酸结合物、别石胆酸、十六烷二酸、3-氧代十八烷酸、二十二碳六烯酸、丁烯肉碱、3-羟基-9-十六碳烯酰肉碱、3-羟基十六烷基肉碱、(9E)-10-硝基十八烷-9-烯酰肉碱等26个差异代谢物,涉及肉碱穿梭代谢、花生四烯酸代谢、胆汁酸生物合成、胆碱代谢、丙酮酸代谢等途径。本研究对冠心病痰瘀互结证发病机制进行一定程度的阐释,今后将继续进行更深层次研究,为临床治疗提供更多依据。

