芪苈强心胶囊对心肌梗死大鼠心脏IP3Rs/GRP75/VDAC1 基因调控的机制研究
纪晓迪,杨 丁,崔喜元,娄利霞,聂 波,赵久丽,赵明镜,吴爱明
(北京中医药大学东直门医院/中医内科学教育部和北京市重点实验室,北京 100700)
心肌梗死(MI)是常见的心血管突发事件,可引起心脏广泛的病理改变,包括细胞凋亡,炎症反应,心肌纤维化,能量代谢紊乱等。其中Ca2+稳态失衡是MI 后多种病理变化的基础[1]。课题组前期研究发现,MI 大鼠存在过度的内质网应激,进而导致大量细胞凋亡[2,3]。然而具体的调控机制目前尚不明确。查阅文献发现心肌缺血伴随线粒体Ca2+超载现象[4],Ca2+凋亡信号会诱导线粒体途径凋亡。这严重损害了心脏的形态结构和功能,导致心脏收缩舒 张 功 能 解 耦 联,进 而 诱 发 心 律 失 常 和 心 衰[5,6]。因此,纠正线粒体Ca2+稳态失衡对于MI 的治疗至关重要[7,8]。
临床上,芪苈强心胶囊广泛用于MI 后心衰的治疗,能提高患者心功能,改善其生活质量[9,10]。研究表明芪苈强心胶囊可以直接调控心肌细胞Ca2+信号而发挥心肌保护作用[11,12]。但是其对于线粒体Ca2+转运复合体相关基因表达的调节作用尚未见报导。本研究旨在从基因层面初步探讨芪苈强心胶囊调控线粒体Ca2+转运复合体IP3Rs/GRP75/VDAC1基因表达治疗MI 的药效机制,为芪苈强心胶囊的临床应用提供新的实验证据。
1 材料与方法
1.1 材料
1.1.1 动物 Sprague-Dawley 大鼠,体质量(200±20)g,6 周龄,自维通利华实验技术有限公司(北京)购入,[许可证号:SCXK(京)2012-0001]。本研究所用动物已取得北京中医药大学东直门医院动物管理委员会批准。所涉及的研究方案均符合中国伦理委员会关于实验动物的指导原则。
1.1.2 药物及试剂 芪苈强心胶囊,由以岭药业股份有限公司(石家庄)提供(国药准字Z20040141);卡托普利,由中美上海施贵宝制药有限公司提供(批号:AAN9869);Trizol (美国Thermo Fisher Scientific 公司,批号:15596026);PCR 扩增试剂盒(美国Applied Biosystems 公司,批号:4472897);TUNEL 试剂盒(美国Promega 公司,批号:G3250);细胞固定液(上海Beyotime,批号:P0098),荧光封片剂(北京中杉金桥,批号:ZLI-9557),RIPA 裂解液(上海Beyotime,批号:P0013B),B 淋巴细胞瘤-2(Bcl-2)抗体(proteintech,26593-1-AP),Bcl-2 相关X 蛋白(Bax)抗体(proteintech,60267-1-Ig),GAPDH 抗体(proteintech,60004-1-Ig)。
1.1.3 主要仪器 FX-7202 心电图机(北京福田);ALC-V8S 小动物呼吸机(上海奥尔科特生物公司);Gene Amp PCR system 9700 基因扩增仪(美国Applied Biosystems 公司);包埋机、石蜡切片机(德国徕卡),DM300 光学显微镜(德国徕卡);JA1003N电子精密天平(上海精密科学仪器有限公司);4 ℃离心机(美国Thermo Fisher Scientific 公司);生物显微镜(蔡司Axio Scope.A1)。
1.2 方法
1.2.1 模型制备 通过结扎左冠状动脉前降支方法建立MI 模型[13]。首先,腹腔注射1%戊巴比妥钠(45 mg/kg)麻醉大鼠。随后,进行气管插管并连接呼吸机(吸呼比1∶2,潮气量7 mL,呼吸频率80 次/分)。于心前区胸骨左缘第3、4 肋间横向开胸,在肺动脉圆锥与左心耳之间的下缘2 mm 处进行结扎,术中可见结扎位点下心肌缺血变白,随即逐层缝合关胸。假手术组作为对照组,只开胸穿线不做接扎。手术后连续3 d 腹腔注射40 U 青霉素预防感染。
1.2.2 分组及给药 选择术后即刻心电图(ECG)出现ST 段抬高且术后24 h ECG 出现6~8 个病理性Q 波的大鼠入组,根据病理性Q 波个数将动物随机均匀地分到模型组、芪苈强心组和卡托普利组。另外设有假手术组,每组8 只。术后第2 天开始灌胃给药4 周,芪苈强心组给予芪苈强心药物混悬液0.32 g·kg-1·d-1),卡 托 普 利 组 给 予 卡 托 普 利 混 悬 液2.25 mg·kg-1·d-1),假 手 术 组 和 模 型 组 给 予 等 体 积10 mL·kg-1·d-1)去离子水。
1.2.3 硝基蓝四氮唑(NBT)染色 参照文献[14]进行NBT 染色观察大鼠心脏梗死面积。打开胸腔,迅速取出大鼠心脏,在提前预冷的生理盐水中浸泡以去除血渍。去除心房组织,沿心脏长轴连续横切约2 mm 厚切片,置于2%NBT 染液,避光,37 ℃恒温孵育1 h。
1.2.4 HE 染 色 取4 μm 厚 组 织 切 片 进 行HE 染色:60 ℃烤片1 h,随后二甲苯脱蜡、梯度乙醇水化,自来水冲洗5 min,苏木素染核10 min,水洗10 s,盐酸酒精分化30 s,水洗10 min。伊红染色10 min,水洗1 min。随后梯度乙醇脱水、二甲苯透明、中性树胶封片,晾干后于显微镜下观察心肌组织形态。
1.2.5 实时荧光PCR 心肌组织总RNA 通过Trizol 方法提取,其纯度确保在正常范围,OD(260/280)在1.8~2.0 之间。参照说明书将总RNA 逆转录为cDNA。采用Real-Time PCR 法检测各组目的基因相对表达量,扩增条件:预变性95 ℃ 10 min,变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 20 s,共计40个 循 环。以GAPDH 做 为 内 参,采 用2-△△CT法 计 算目的基因相对表达量。引物序列见表1。
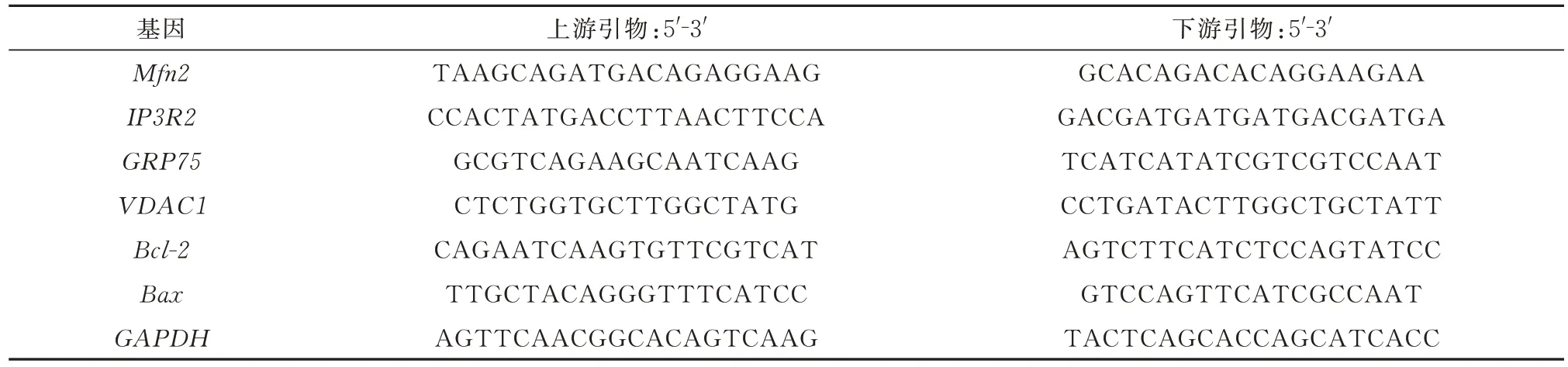
表1 PCR 引物序列Tab 1 PCR primer sequences
1.2.6 Western Blot 采用RIPA 裂解法提取心肌组织总蛋白。通过SDS-PAGE 凝胶进行电泳,随后湿转法将蛋白电转到NC 膜上,5%脱脂奶粉封闭1 h,孵育一抗Bcl-2,Bax 4 ℃过夜。次日,室温孵育二抗1 h 随后化学发光观察蛋白条带。
1.2.7 TUNEL 染色 将切好的心肌组织切片于二甲苯中充分脱蜡、梯度乙醇下行水化;随后在细胞固定液中浸泡5 min,加入20 μg/mL 蛋白酶K 溶液,室温孵育10 min,再次浸泡在细胞固定液中5 min,经PBS 漂洗后,加入平衡液孵育10 min。在避光环境下滴加rTdT 缓冲液,37 ℃孵育1 h。最后用2X SSC 终止反应。滴加含DAPI 的抗荧光淬灭封片剂,盖玻片封片。显微镜下可观察到表示凋亡细胞核的绿色荧光和表示正常细胞核的蓝色荧光。使用Image-Pro Plus 计数凋亡细胞核以及正常细胞核数目,计算各组细胞凋亡率。
1.2.8 统计学方法 使用SPSS 25.0 软件进行统计学分析。计量资料使用均值±标准差(±s)表示,组间比较采用单因素方差分析。符合正态分布的数据,组间方差齐则采用LSD 法,反之采用Dunnett's T3 法。以P<0.05 为差异具有统计学意义。
2 结果
2.1 动物模型评价
分别在将动物实施左冠状动脉结扎手术前,术后即刻,术后24 h 进行ECG 检测。结果显示,手术前大鼠ECG 均处于正常范围。假手术组大鼠的术后即刻和术后24 h ECG 均无明显异常变化;而模型组大鼠术后即刻ECG 可见ST 段抬高,术后24 h ECG 出现明显的病理性Q 波,提示出现心肌缺血损伤,心肌梗死模型造模成功。结果见图1A。此外,进一步通过NBT 染色评价心肌梗死模型造模情况,染色后非梗死区呈紫黑色,而梗死区不着色。结果可见,假手术组大鼠心脏表现为均匀一致的紫黑色,即无梗死区域;而模型组大鼠心脏存在大面积无着色的梗死区域,再次证明心肌梗死模型建立成功。结果见图1B。
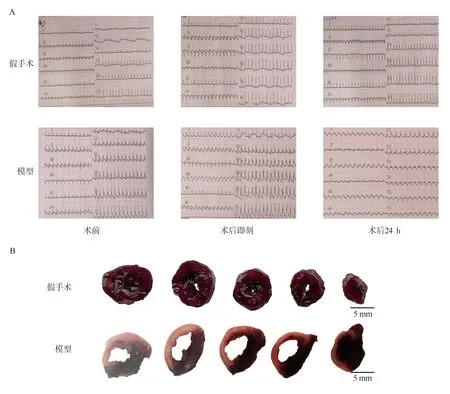
图1 心肌梗死模型评价Fig 1 Evaluation of myocardial infarction model
2.2 心脏大体结构观察
假手术组心脏大体结构未见异常;与假手术组相比,模型组大鼠心脏体积变大,出现明显缺血变白的梗死区,尤其左心室前壁变薄,梗死的心肌组织被结缔组织取代而出现大范围塌陷;与模型组相比,芪苈强心组和卡托普利组大鼠心脏大体结构有所改善,缺血变白的梗死区范围较小。结果见图2。

图2 各组大鼠心脏大体结构Fig 2 Gross structure of the heart of rats in each group
2.3 心肌组织HE 染色结果
HE 染色显示,假手术组心肌组织形态无异常变化,心肌纤维横纹清晰,排列致密整齐,细胞核大小基本一致,细胞质均匀红染。模型组心肌组织可见明显的细胞变性、坏死,心肌纤维断裂,残存的心肌细胞肥大,核固缩,细胞质染色不均一。与模型组相比,芪苈强心组和卡托普利组心肌细胞结构有所改善,组织病理损伤相对较轻。结果见图3。
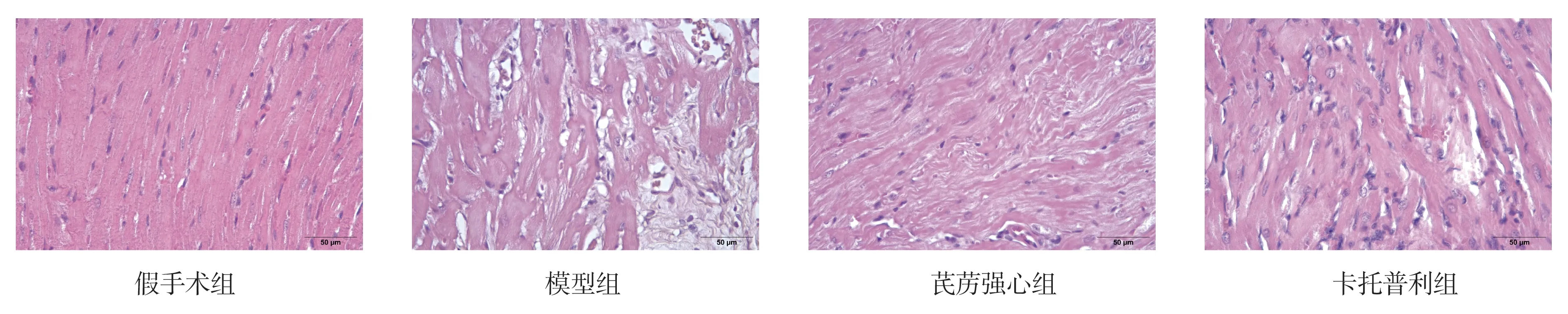
图3 各组大鼠心肌组织HE 染色结果(400 ×)Fig 3 HE staining results of myocardial tissues of rats in each group (400 ×)
2.4 线粒体Ca2+转运相关基因mRNA 表达情况
与假手术组相比,模型组大鼠三磷酸肌醇受体2(IP3R2)、葡萄糖调节蛋白75(GRP75)、电压依赖性阴离子通道1(VDAC1)、线粒体融合蛋白2(Mfn2)mRNA 表达水平显著升高(P<0.05,P<0.01);与模型组相比,芪苈强心组、卡托普利组IP3R2、GRP75、VDAC1、Mfn2mRNA 表达水平显著降低(P<0.01)。结果见表2,图4。
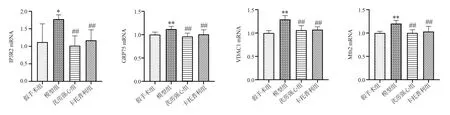
图4 各组大鼠心肌组织钙转运相关基因表达比较Fig 4 Comparison of the expression of Ca2+ transport-related genes in each group
表2 各组大鼠心肌组织钙转运相关基因表达情况(n=8,±s)Tab 2 Expression of Ca2+ transport-related genes in each group(n=8,±s)
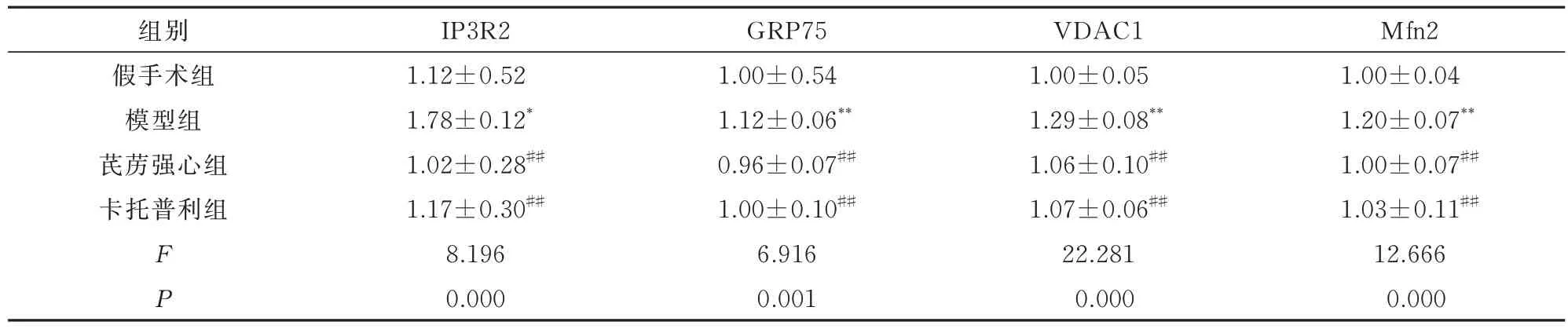
表2 各组大鼠心肌组织钙转运相关基因表达情况(n=8,±s)Tab 2 Expression of Ca2+ transport-related genes in each group(n=8,±s)
注:与假手术组相比,*P<0.05,**P<0.01;与模型组相比,##P<0.01。
Mfn2 1.00±0.04 1.20±0.07**1.00±0.07##1.03±0.11##12.666 0.000组别假手术组模型组芪苈强心组卡托普利组FP IP3R2 1.12±0.52 1.78±0.12*1.02±0.28##1.17±0.30##8.196 0.000 GRP75 1.00±0.54 1.12±0.06**0.96±0.07##1.00±0.10##6.916 0.001 VDAC1 1.00±0.05 1.29±0.08**1.06±0.10##1.07±0.06##22.281 0.000
2.5 线粒体凋亡相关基因mRNA 表达情况
与假手术组相比,模型组大鼠B 淋巴细胞瘤-2(Bcl-2)mRNA 表达水平明显降低,Bcl-2 相关X 蛋白(Bax)mRNA表达水平显著升高(P<0.01);与模型组相比,芪苈强心组、卡托普利组Bcl-2mRNA表达水平显著升高,BaxmRNA表达水平显著下调(P<0.01)。结果见表3,图5。
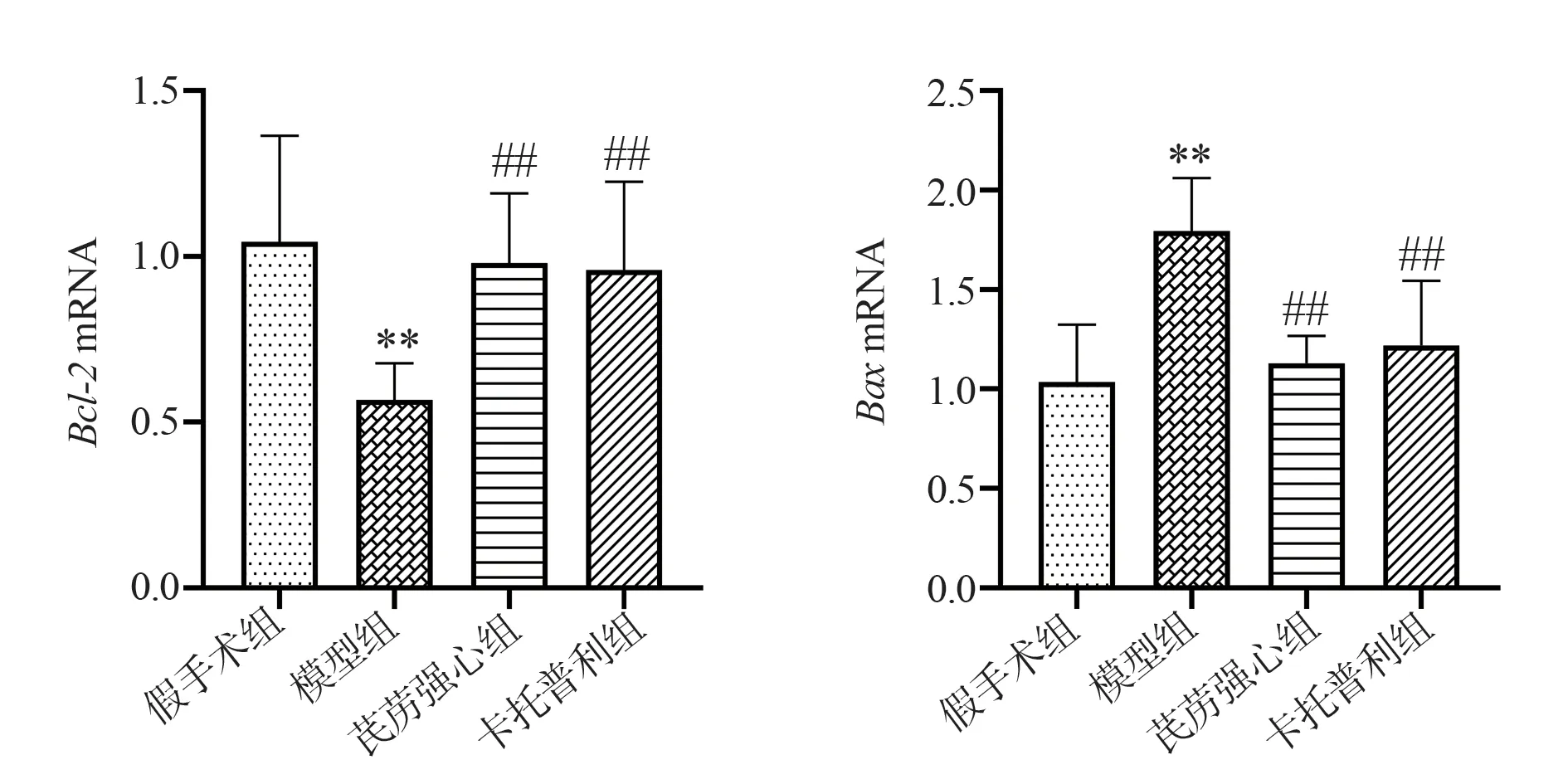
图5 各组大鼠心肌组织凋亡相关基因表达比较Fig 5 Comparison of the expression of apoptosis-related genes in each group
表3 各组大鼠心肌组织凋亡相关基因表达情况(n=8,±s)Tab 3 Expression of apoptosis-related genes in each group(n=8,±s)
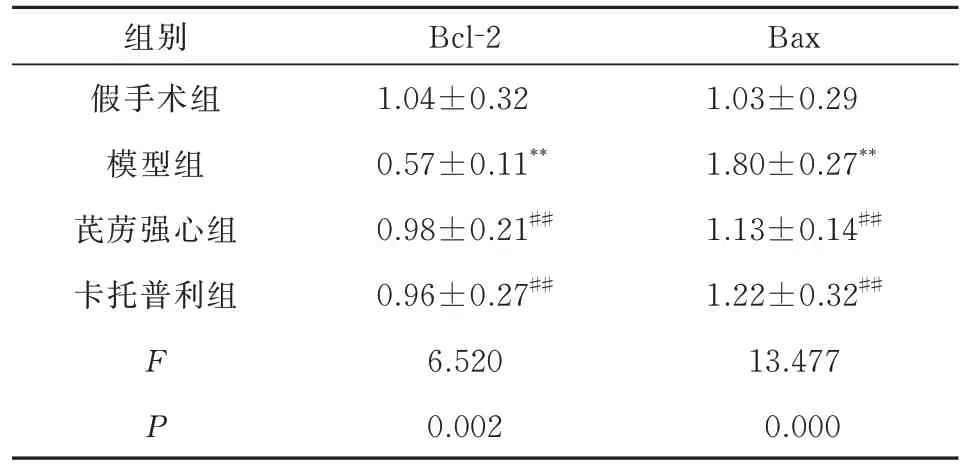
表3 各组大鼠心肌组织凋亡相关基因表达情况(n=8,±s)Tab 3 Expression of apoptosis-related genes in each group(n=8,±s)
注:与假手术组相比,**P<0.01;与模型组相比,##P<0.01。
Bax 1.03±0.29 1.80±0.27**1.13±0.14##1.22±0.32##13.477 0.000组别假手术组模型组芪苈强心组卡托普利组F P Bcl-2 1.04±0.32 0.57±0.11**0.98±0.21##0.96±0.27##6.520 0.002
2.6 线粒体凋亡相关蛋白表达情况
与假手术组相比,模型组大鼠Bcl-2 蛋白表达水平明显降低,Bax 蛋白表达水平显著升高(P<0.01);与模型组相比,芪苈强心组、卡托普利组Bcl-2 蛋白表达水平显著升高,Bax 蛋白表达水平显著下调(P<0.05,P<0.01)。结果见表4,图6。
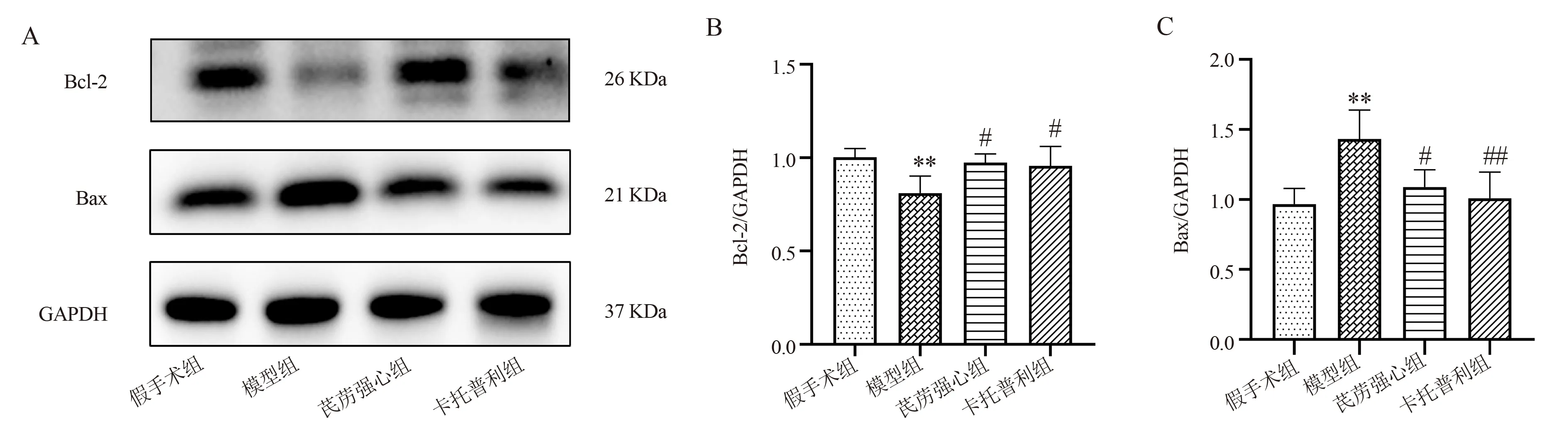
图6 各组大鼠心肌组织凋亡相关蛋白表达比较Fig 6 Comparison of the expression of apoptosis-related proteins in each group
表4 各组大鼠心肌组织凋亡相关蛋白表达情况(n=4,±s)Tab 4 Expression of apoptosis-related proteins in each group(n=4,±s)
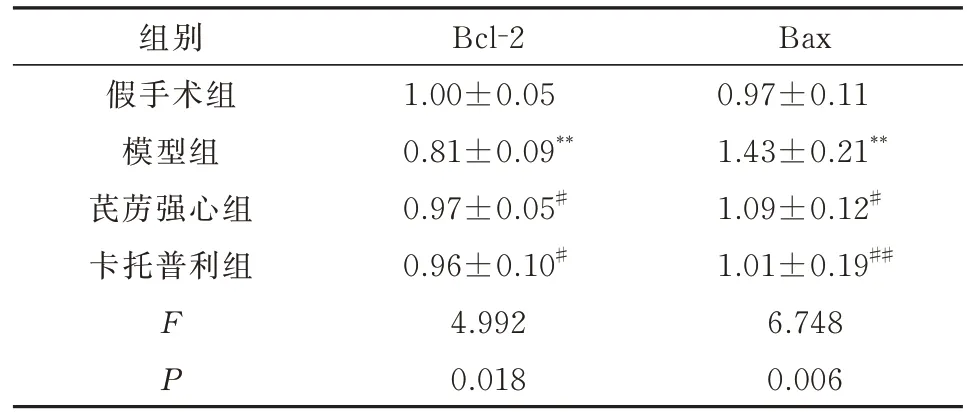
表4 各组大鼠心肌组织凋亡相关蛋白表达情况(n=4,±s)Tab 4 Expression of apoptosis-related proteins in each group(n=4,±s)
注:与假手术组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
Bax 0.97±0.11 1.43±0.21**1.09±0.12#1.01±0.19##6.748 0.006组别假手术组模型组芪苈强心组卡托普利组FP Bcl-2 1.00±0.05 0.81±0.09**0.97±0.05#0.96±0.10#4.992 0.018
2.7 心肌组织细胞凋亡率结果
与假手术组相比,模型组大鼠心肌组织细胞凋亡率显著升高(P<0.01);与模型组相比,芪苈强心组、卡托普利组心肌组织细胞凋亡率 显著降低(P<0.01)。结果见表5,图7~9。
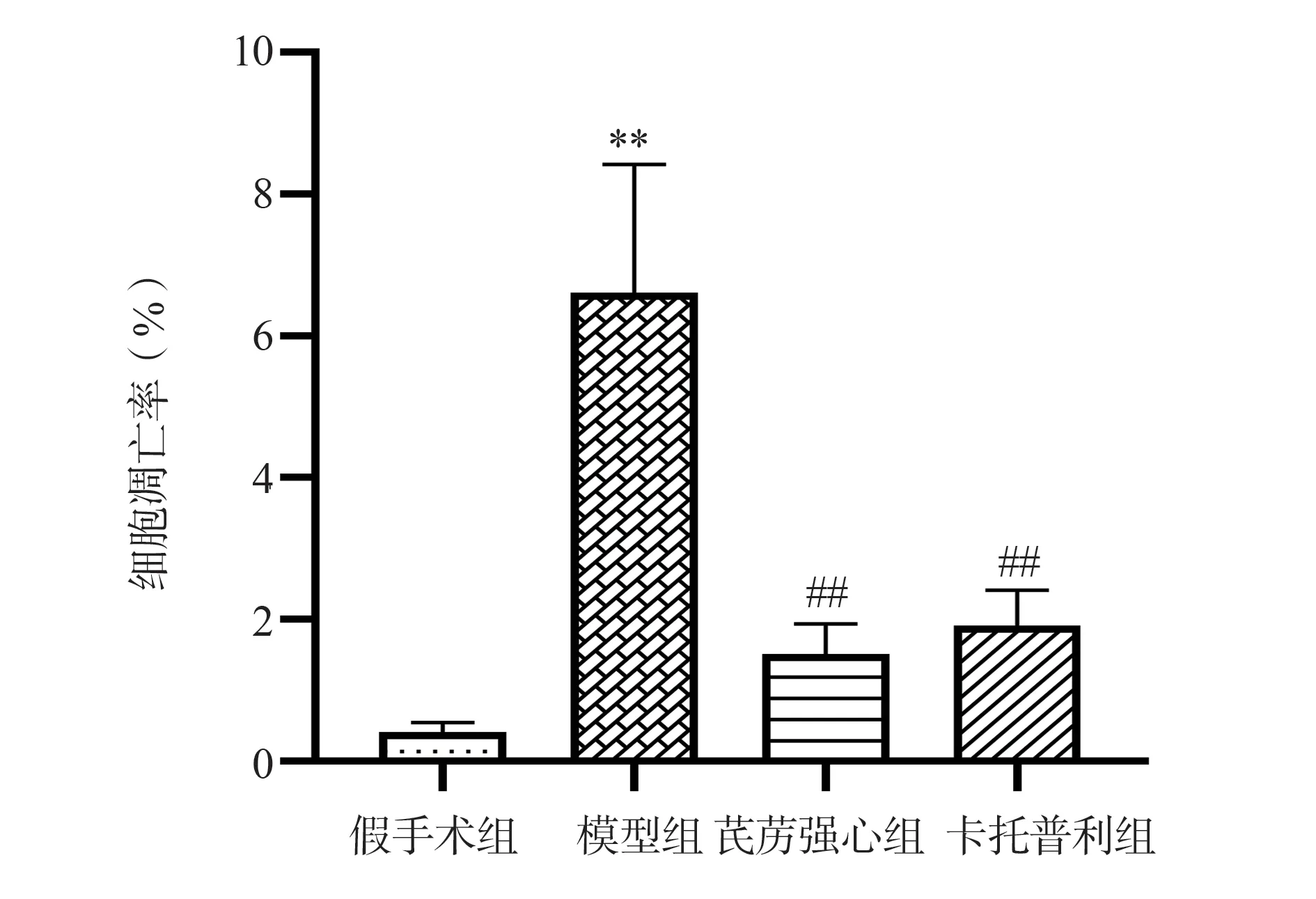
图8 各组大鼠心肌细胞凋亡率比较Fig 8 Comparison of apoptosis rates in cardiac myocytes of each group of rats
表5 各组大鼠心肌细胞凋亡率结果(n=8,±s)Tab 5 Results of apoptosis rate of cardiac myocytes in each group of rats(n=8,±s)
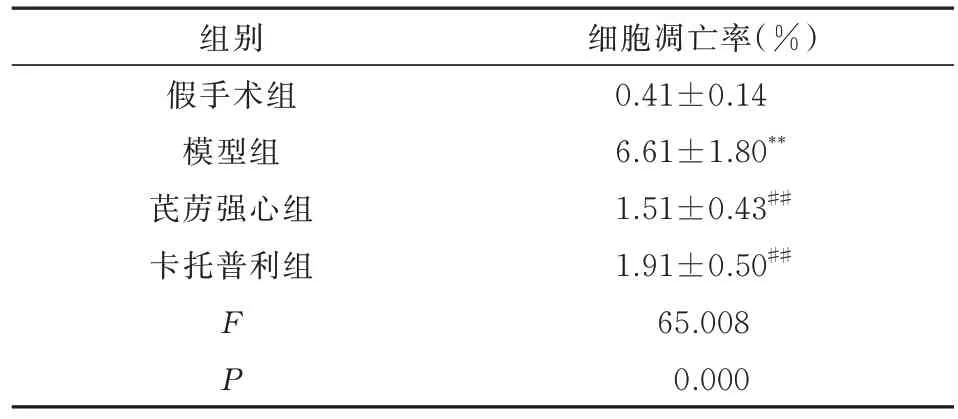
表5 各组大鼠心肌细胞凋亡率结果(n=8,±s)Tab 5 Results of apoptosis rate of cardiac myocytes in each group of rats(n=8,±s)
注:与假手术组相比,**P<0.01;与模型组相比,##P<0.01。
细胞凋亡率(%)0.41±0.14 6.61±1.80**1.51±0.43##1.91±0.50##65.008 0.000组别假手术组模型组芪苈强心组卡托普利组FP
3 讨论
MI 是持续缺血导致心肌损伤的病理事件,伴随着细胞稳态的失衡以及心脏结构和功能的损害[15]。而MI 所伴随的细胞内质网Ca2+释放失衡和线粒体Ca2+超载[16],是造成细胞器损害进而触发细胞凋亡的重要机制。因此,MI 后线粒体Ca2+摄入异常的分子变化以及中医药的调控作用值得深入研究。
中医认为,MI 属于脉络病变范畴,气虚血瘀是其基本病机,而络塞积成是疾病进展的另一关键病机[17]。芪苈强心胶囊是在中医脉络学说指导下研发的中成药,具有益气温阳、活血通络、利水消肿之功效,对于防治MI 后心衰疗效显著[18,19]。然而,这种心脏保护作用背后的分子机制目前尚未完全阐明。线粒体作为细胞的动力源,其对Ca2+摄取的动态控制是心肌细胞实现生理功能或病理应激的基础[20]。本研究观察了芪苈强心胶囊在调节线粒体Ca2+摄取通道相关基因表达方面的干预作用,希望为阐明其药理机制提供新的实验室证据。
近年来研究发现,线粒体相关内质网膜(MAMs)通道蛋白包括IP3Rs,GRP75,VDAC1 是维持线粒体Ca2+稳态的基础[21]。其中,IP3Rs 主要表达在内质网膜,介导内质网Ca2+释放;VDAC1 位于线粒体外膜上的Ca2+摄取通道,有研究发现VDAC1 在MI 后 的患者中显著过表达[22]。此 外,VDAC1 可增加线粒体外膜通透性而被认为是诱导凋 亡 所 必 需 的 分 子[23,24]。Zhao 等[25]研 究 发 现,MAMs 通道蛋白VDAC1,GRP75 上调与心肌肥厚进展相关。GRP75 通过胞质部分将IP3Rs 和VDAC1 相 互 连 接,形 成IP3Rs/GRP75/VDAC1 通道复合体介导线粒体Ca2+摄取[26,27]。本研究发现,模型组大鼠心肌组织IP3R2,GRP75,VDAC1mRNA 表达水平显著升高,这从基因水平解释了MI 后线粒体Ca2+摄取通道过度开放,继而导致线粒体Ca2+超载的成因。而经芪苈强心胶囊治疗后,相关基因过表达的情况得到了改善,说明药物可以通过调节IP3Rs/GRP75/VDAC1 通道复合体基因表达而发挥心肌保护作用。
Mfn2 是细胞不可或缺的多功能蛋白,在生理和病理条件下促进线粒体融合、MAMs 的形成、细胞凋亡等生物过程[28]。目前研究表明Mfn2 与心衰的发病机制密切相关。然而这种生物作用是保护性的还是损害性的,似乎与损伤的程度,以及其保护效应与损害效应之间的平衡相关[29]。作为线粒体Ca2+摄取通道的承载者,MAMs 是一个动态结构,主要受Mfn2 调控,在生理状态下为线粒体Ca2+转运提供一个稳定的平台。然而,MAMs 通道蛋白似乎不总是有利的。Riba 等[30]发现,在异丙肾诱导的心衰中,Mfn2 表达升高 ,Zhao 等[25]研究表明MAMs通路下调可能对心脏有保护作用。此外,Mfn2 基因敲除的心肌组织对Ca2+超载的耐受性更高[31]。在本研究中,模型组大鼠心脏Mfn2 mRNA 表达显著升高,这似乎成为了内质网和线粒体间过度Ca2+交流,并最终导致线粒体Ca2+超载的一个诱因。而与模型组相比,芪苈强心胶囊能够明显抑制Mfn2 mRNA 的过表达,这将有助于缓解MI 后线粒体Ca2+摄入过量的情况。
线粒体中Ca2+稳态对于呼吸链复合体和Krebs循环中酶活性发挥关键作用。线粒体摄入Ca2+过量则导致其生物功能紊乱,进而激活细胞线粒体凋亡通路[32]。抗凋亡基因Bcl-2是线粒体凋亡通路的关键调控因子。它不仅作用于线粒体,还作用于内质网,通过靶向抑制IP3Rs 而影响Ca2+动态进而对抗细胞凋亡[33,34]。Ca2+介导的凋亡信号可引起Bax激活并转移至线粒体外膜诱导线粒体释放促凋亡因 子 如 细 胞 色 素c[35]。VDAC1 不 仅 是 激 活Bax 的一个重要上游分子,同时还寡聚化,为细胞色素c 释放 提供通道[23,36,37]。此外,Mfn2参与招募Bax 至线粒体膜诱导凋亡[38]。Bcl-2和Bax相互调控维持着线粒体膜稳定。在本研究中,模型组大鼠Bcl-2 mRNA 和蛋白表达均下降,Bax mRNA 和蛋白表达均增加;同时,TUNEL 染色显示,与假手术组相比,模型组心肌细胞凋亡率显著增加。提示MI 发生时,IP3Rs 的高表达摆脱了Bcl-2 的抑制作用并释放Ca2+凋亡信号。Ca2+凋亡信号通过VDAC1 激活Bax 膜易位,最终导致线粒体凋亡通路的激活。而芪苈强心胶囊治疗4 周可以提高Bcl-2 mRNA 和蛋白表达,降低Bax mRNA 和蛋白表达,恢复Bcl-2 和Bax 的动态平衡并且显著降低细胞凋亡率。
MAMs 通道蛋白IP3R2,GRP75,VDAC1 已被证明是应激信号从内质网转移到线粒体的枢纽,最显著的是在内质网蛋白质稳态丧失的情况下参与未折叠蛋白反应[39]。前期实验发现,MI 伴随过度内质网应激现象[3]。本研究结果则进一步提示,内质网应激信号传递到线粒体进而激活线粒体凋亡途径的过程与线粒体Ca2+转运复合体IP3R2/GRP75/VDAC1基因过表达有关。而芪苈强心胶囊能够调节MI 后IP3R2/GRP75/VDAC1通道复合体基因的过表达,从而抑制线粒体凋亡通路的激活,发挥心脏保护作用。
综上所述,本研究从基因水平揭示了芪苈强心胶囊靶向IP3R2/GRP75/VDAC1通道复合体基因表达从而抑制细胞凋亡的新机制。但mRNA 水平调控尚不足以完全证明抑制Ca2+通路与凋亡之间的内在关联。这是本研究的局限性,也是课题组今后的研究方向,后续将在蛋白水平进一步补充实验证据,希望能够更深入全面的阐释芪苈强心胶囊对IP3R2/GRP75/VDAC1 通道复合体的调控机制。
作者贡献度说明:
吴爱明:实验进行总体设计以及文章审核;赵明镜:文章思路以及文笔进行指导;娄利霞、聂波、赵久丽:实验技术指导;纪晓迪、杨丁、崔喜元:动物饲养以及指标检测;纪晓迪:Figdraw 平台绘制图9 并撰写文章。
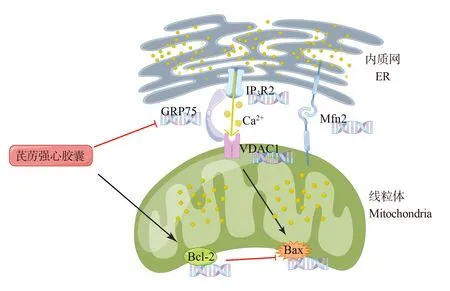
图9 芪苈强心胶囊对心肌梗死大鼠Ca2+转运的调控作用Fig 9 Regulation of Qiliqiangxin Capsule on Ca2+ transport in rats with myocardial infarction
所有作者声明不存在利益冲突关系。

