高甲基化相关的CCL5低表达促进肝癌细胞增殖及免疫抑制
杨小凤,林若琳,王小鹏,朱丽,侯隽,王良海
(石河子大学医学院/新疆地方与民族高发病教育部重点实验室,新疆 石河子 832000)
肝细胞癌(hepatocellular carcinoma, HCC)是世界性的重大公共卫生问题[1]。我国肝癌的发病率居世界首位,对全球肝病的负担有着重大影响[2]。越来越多的证据表明肝癌微环境中免疫细胞失调,包括巨噬细胞浸润增加和T细胞浸润减少等[3-4]。肝细胞癌的发病机制和预后标志物仍有待于进一步研究[5]。
研究表明,肿瘤浸润性CD8+T细胞与许多类型癌症患者的良好预后相关[6]。趋化因子是8-14 KDa的小分子蛋白,存在于淋巴系统和各种组织中,在招募免疫细胞进入肿瘤组织的过程中发挥重要作用[7]。CCL5(C-C motif chemokine ligand 5),也被称为RANTES,是大小为7.5 kDa的趋化因子[3]。CCL5已被发现在癌症和炎症性疾病中起重要作用[8-9]。Dangaj等[10]通过对人卵巢癌的研究发现,肿瘤细胞表达的CCL5和由巨噬细胞及树突状细胞表达的CXCL9对T细胞浸润到肿瘤组织中至关重要 。Tang等发现CCL5可作为非小细胞肺癌的疾病预后指标和免疫检查点治疗靶点[11]。Zhang等[12]研究发现CCL5缺乏可增强结直肠癌中CD8+T细胞的瘤内浸润。然而,目前CCL5在肝细胞癌中的表达水平和作用机制还没有明确的定论[3,7,13]。
本研究通过分析GEO数据库发现肝癌组织中CCL5表达较低并与患者预后不良相关。我们还对人肝癌组织标本中CCL5的表达进行了检测,验证了上述生物信息学结果。我们分析TCGA数据库发现CCL5与肝癌的免疫微环境有关,高表达组浸润更多的CD8+T细胞。此外,过表达CCL5能够抑制肝癌细胞的增殖。本研究还发现肿瘤中CCL5的低表达是由启动子DNA高甲基化引起的。
1 材料与方法
1.1 生物信息学分析
1.1.1 Gene Expression Omnibus(GEO)数据库
GEO(http://www.ncbi.nlm.nih.gov/geo/)是存储并免费分发微阵列、下一代测序(NGS)和其他形式高通量功能基因组数据的国际公共存储库[14]。本研究通过GEO数据库分析了CCL5在肝癌组织中的表达高低及与患者的生存预后情况的关系。
1.1.2 The Cancer Genome Atlas Program(TCGA)数据库
TCGA(https://portal.gdc.cancer.gov)数据库的研究人员对来自33种癌症类型的11 160名患者的肿瘤分子结构进行了描述,并确定了它们的分子亚型[15]。本研究通过TCGA数据集分析了CCL5与免疫浸润及甲基化的关系。
1.2 临床样本
收集石河子大学医学院第一附属医院2011—2019年期间的肝癌石蜡组织标本,其中肿瘤组织103个,癌旁组织90个。这些患者在手术切除前均未接受放疗或化疗。所有患者均由至少两位经验丰富的病理医师进行病理诊断。本研究经石河子大学医学院第一附属医院人体研究伦理委员会批准。
1.3 免疫组织化学染色
将石蜡包埋组织切成4 μm厚的切片,经二甲苯脱蜡、酒精脱水后进行抗原修复。然后用3% H2O2抑制内源性过氧化物酶,磷酸盐缓冲盐溶液洗涤3次,每次5 min。洗涤后,将样品与抗CCL5一抗混合(稀释比1∶500;Abcam),在4 ℃的冰箱中孵育过夜。加二抗后将石蜡切片置于37 ℃恒温箱中孵育30 min。采用DAB试剂盒(ZSGB-Bio #ZLI-9018)对样品进行显色。将组织切片冲洗后用苏木素快速染色,中性树胶封片。根据着色强度(0分:未着色;1分:弱着色;2分:中等着色;3分:强着色)和着色细胞比例(0分:<5%;1分:5%~25%;2分:26%~75%;3分:75%~100%)对CCL5表达的免疫组织化学染色程度进行评分,每个样本的最终免疫反应性评分为着色强度评分和着色细胞比例评分的乘积[16-17]。
1.4 细胞培养与主要试剂
人肝癌细胞株HuH-7购自中国科学院细胞库,MHCC97 H购自碧云天生物技术有限公司,小鼠肝癌细胞由中国科学技术大学赠送。HuH-7、MHCC97 H和小鼠肝癌细胞常规培养在含10%胎牛血清和1%青霉素-链霉素的DMEM培养液中,置于5% CO2、37 ℃培养箱中孵育。主要试剂见表1。

表1 主要试剂及公司
1.5 细胞转染
小鼠肝癌细胞接种于六孔板中,细胞密度达到70%~80%时用Lipofectamine 3000转染过表达CCL5及其相应对照的质粒。转染48 h后,用嘌呤霉素处理细胞14 d,进行单克隆筛选,构建稳定过表达的CCL5细胞系。
1.6 CCK-8增殖实验
CCK-8法检测转染后的小鼠肝癌细胞的细胞增殖。将约2 500个细胞接种在96孔板中,细胞贴壁后,在不同时间点每孔加入10 μL CCK-8溶液,37 ℃孵育2 h。测定450 nm处吸光度,绘制细胞增殖曲线。
1.7 RNA提取和实时荧光定量PCR
使用 E.N.Z.A. Total RNA Kit I从细胞中分离出总RNA,NanoDrop 2000分光光度计测定提取的RNA浓度。将1 μg RNA逆转录成cDNA,然后进行实时荧光定量PCR扩增。本实验采用β-actin作为内参,应用2-△△CT法分析实验组和对照组的表达差异倍数。引物序列见表2。

表2 引物序列
1.8 统计学分析
采用GraphPad Prism 8.0软件进行统计分析。所有数据均以均数±标准差表示。两组间比较采用Student’st检验,多组间比较采用单因素或双因素方差分析估计。生存分析采用Kaplan-Meier法和log-rank检验。P<0.05被认为差异显著。*P<0.05,**P<0.01,***P<0.000 1。
2 结果
2.1 CCL5在肝癌组织中显著低表达
肝癌数据集GSE14520用来分析CCL5在肝癌中的表达分布。火山图显示CCL5为肝癌组织中差异表达基因的下调基因之一(P<0.05,图1A)。在配对(P<0.001,图1B)和非配对(P<0.001,图1C)的肝癌样本中,CCL5的表达都显著降低。
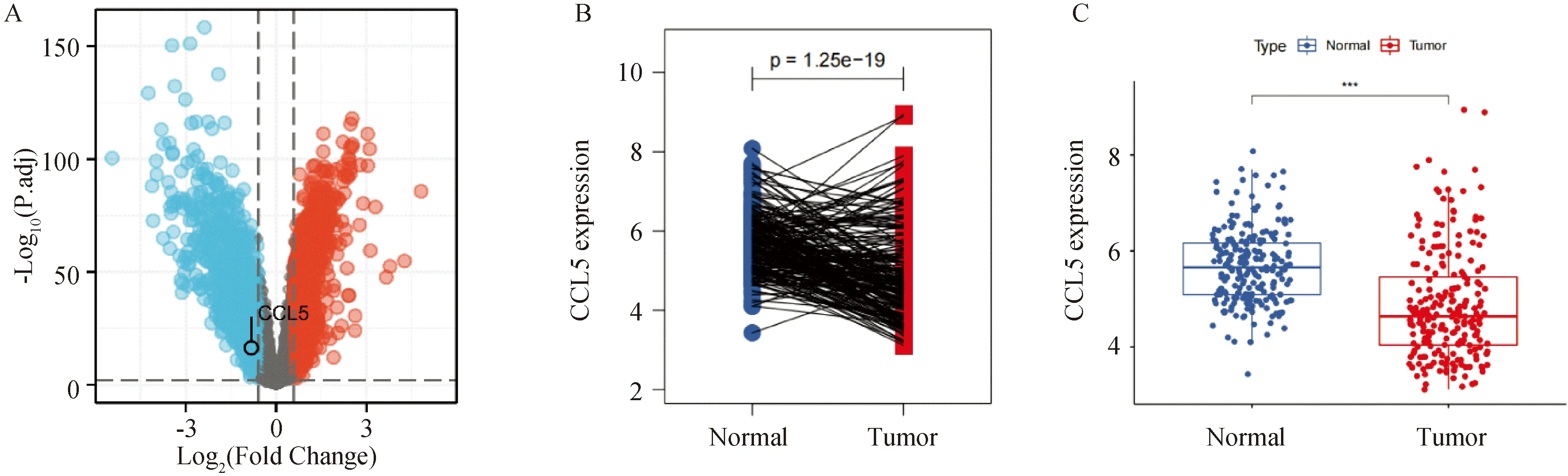
A:对GSE14520数据集进行差异基因分析,火山图显示CCL5是肝癌中的一个下调基因;蓝色:下调基因;红色:上调基因;B-C:CCL5在配对的(B)和非配对的(C)肝癌样本中均低表达。图1 GEO数据库分析CCL5在肝癌组织中的表达水平
为了进一步明确CCL5在肝癌中的表达情况,我们采用免疫组织化学染色检测人肝癌组织及癌旁组织中CCL5的蛋白表达。CCL5信号主要定位在细胞质中(图2A)。免疫组织化学染色评分的统计结果表明肝癌组织中CCL5的表达水平显著下调(P<0.05,图2B)。综上所述,CCL5在肝癌组织中表达降低。

图2 CCL5在临床样本中的表达水平分析
2.2 CCL5低表达与肝癌患者的不良预后有关
我们在GSE14520数据集中分析了CCL5表达与肝癌患者预后的相关性。结果显示,当CCL5表达较低时,患者的总生存率(P<0.05,图3A)和无复发生存率(P<0.05,图3B)较差;CCL5表达高时,有利于患者的预后。
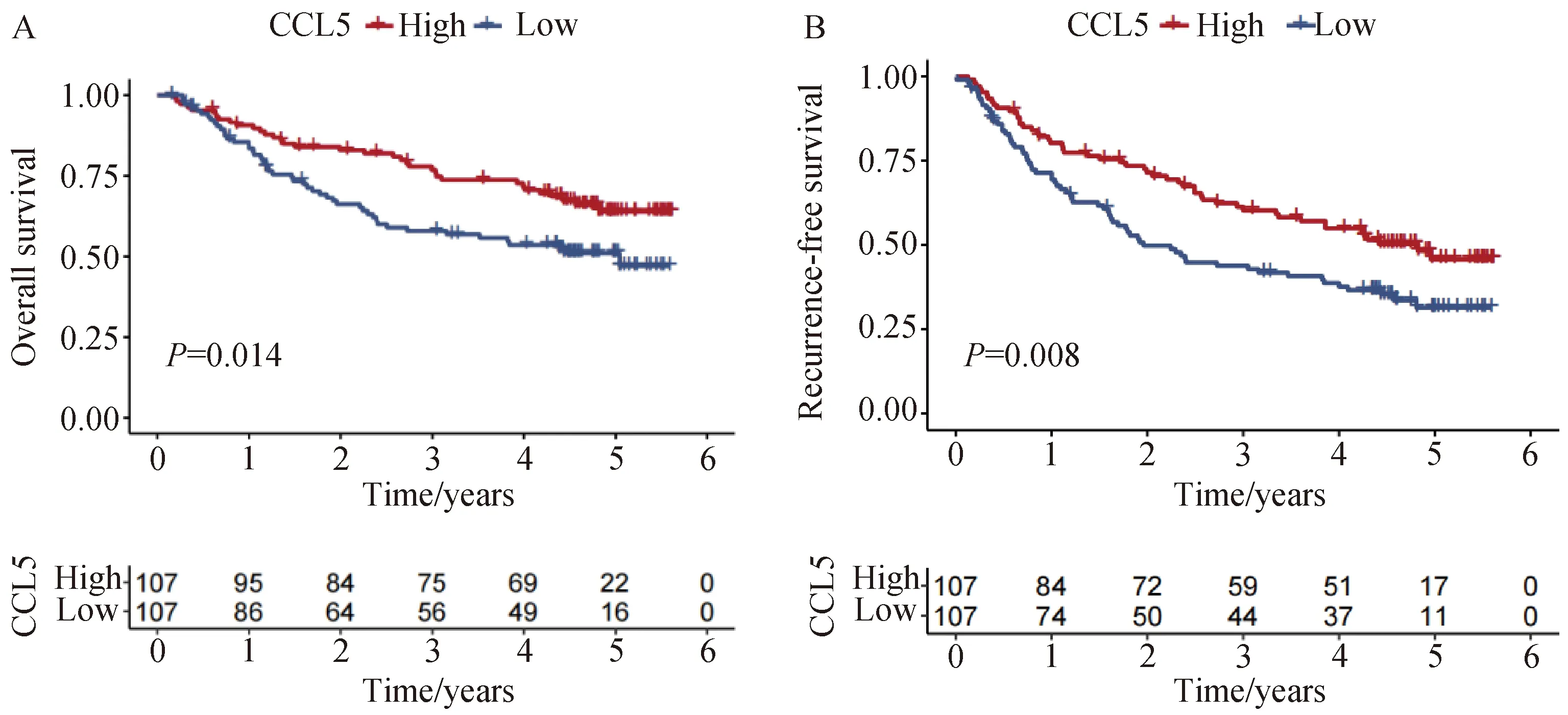
A-B:CCL5表达情况对肝癌患者的总生存期(A)或无复发生存期(B)的影响。图3 GSE14520数据集中分析CCL5表达与肝癌患者预后的关联
2.3 CCL5低表达与免疫抑制有关
Thorsson Vesteinn等人[18]的研究将免疫表型分为C1-C6型,依次由免疫浸润型向免疫荒漠型转变,不同亚型提示患者的免疫应答类型及不同预后结局。
我们分析TCGA数据库中的肝癌免疫表型发现CCL5低表达组富集到更多的C4(淋巴细胞减少)亚型,该亚型与免疫抑制及预后差相关;而C2型(干扰素-γ为主)和C3型(炎性因子)在CCL5高表达组中富集(P<0.001),图4A和4B,提示CCL5高表达有利于患者预后且表现为免疫浸润性微环境。

A:CCL5在6种免疫亚型(C1-C6)肝癌组织中的表达水平分布;B:CCL5在C2-C4免疫亚型中的表达水平比较。图4 CCL5低表达与免疫抑制表型相关
对TCGA数据库中高表达CCL5组和低表达CCL5组的免疫评分进行比较发现(图5A),低表达CCL5组的免疫评分较低(P<0.001),这意味着低表达CCL5组的免疫微环境较差。我们进一步在肝癌数据集GSE14520中分析CCL5表达水平与免疫细胞的浸润情况,发现CD8+T细胞在CCL5高表达组浸润较多(图5B)。综上所述,CCL5低表达与肝癌的免疫抑制微环境有关。
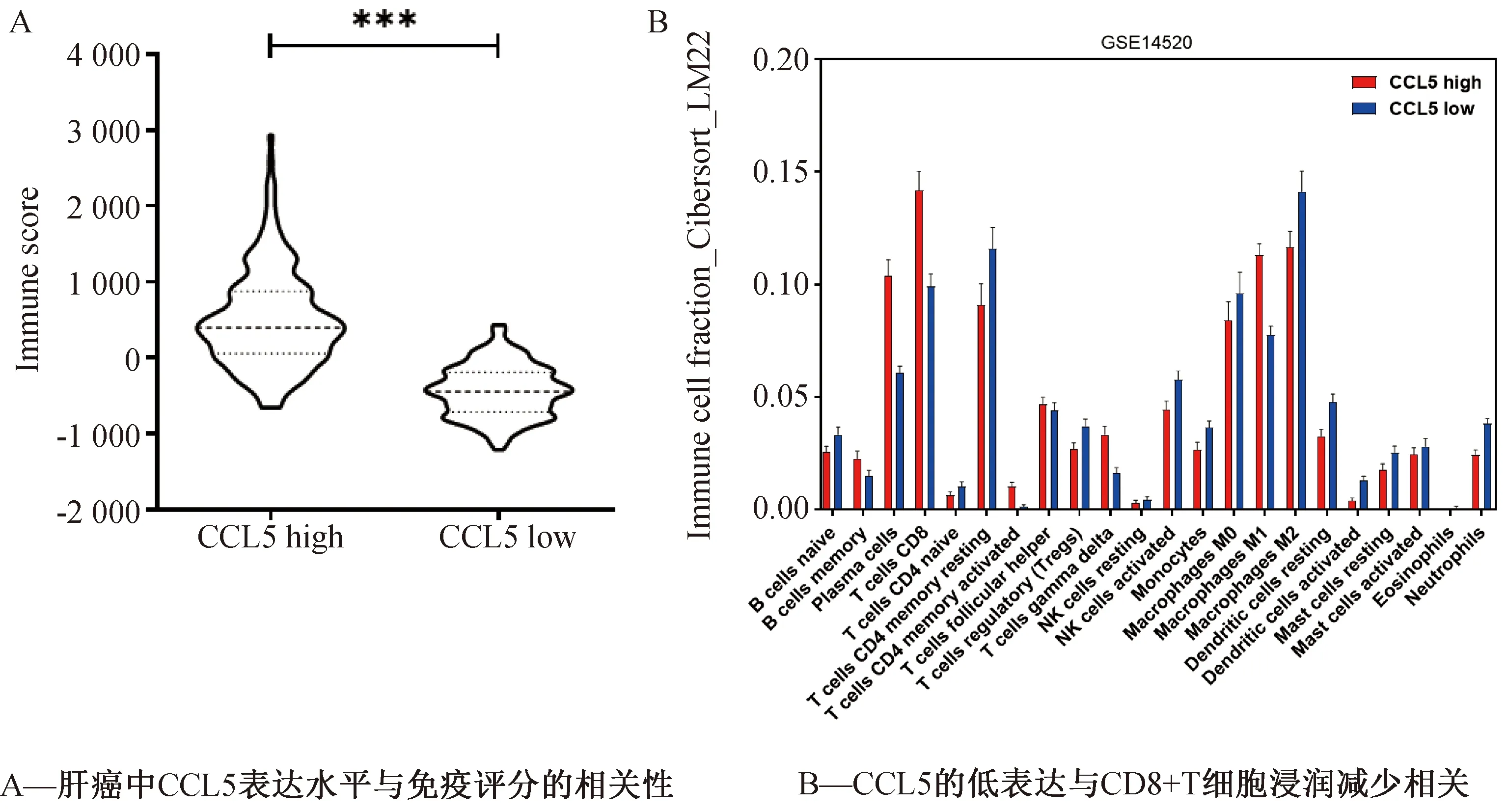
图5 CCL5低表达的肝癌组织显示较低的免疫评分
2.4 CCL5过表达能够抑制肝癌细胞增殖
细胞过度增殖是癌变的重要特征之一[19]。我们通过实时荧光定量PCR验证了CCL5过表达细胞系的成功构建(P<0.01,图6A)。CCK-8增殖实验结果显示CCL5过表达组的细胞增殖速度低于CCL5对照组(P<0.001,图6B),表明CCL5过表达能抑制肝癌细胞的增殖。

图6 CCL5过表达能够抑制肝癌细胞增殖
2.5 CCL5表达低与DNA高甲基化有关
我们通过MEXPRESS网站分析了CCL5在TCGA数据集肝癌组织中低表达的可能原因。结果表明,CCL5表达与拷贝数无显著关联,与启动子DNA的甲基化呈显著负相关(P<0.05,图7A)。CCL5低表达组具有显著升高的启动子DNA甲基化水平(图7B)。

A:Mexpress(https://www.mexpress.be/index.html/)显示肝癌组织中CCL5表达与甲基化负相关。B:小提琴图显示了肝癌中CCL5表达与甲基化水平的关系。C:5’-Aza-2’-deoxycytidine和 DZNeP(均为1 μmol·L-1)处理肝癌细胞48小时后的CCL5的表达水平。图7 CCL5表达水平与甲基化呈负相关
为了验证CCL5与甲基化的关系,我们在体外对HuH-7和MHCC97H两株肝癌细胞系进行了甲基化抑制剂处理。5’-aza-2’-deoxycytidine是DNA甲基转移酶抑制剂,DZNeP是组蛋白甲基化抑制剂。结果发现抑制剂组的CCL5表达较未处理组显著增加,提示CCL5在肝癌细胞中的低表达是由高甲基化引起的。
3 讨论
肝细胞癌发生在慢性肝脏炎症的环境中,与肝炎病毒慢性感染和酒精或黄曲霉毒素暴露等密切相关。深入地了解肝癌的病因和发病机制,有助于为肝癌患者的治疗提供更多可能性[20]。
趋化因子的异常表达可以影响肿瘤组织中免疫细胞的迁移,形成肿瘤微环境,导致肿瘤进展[3,21]。CCL5是CC型趋化因子家族成员之一,与肿瘤和炎症性疾病密切相关[22]。
本文就CCL5对肝癌免疫微环境及肿瘤细胞的影响为切入点,初步探讨了CCL5在肝癌进展中的作用。我们首先通过生物信息学手段,在肝癌数据集GSE14520中发现CCL5的表达降低。为了验证数据集结果的准确性,我们收集了103例肝细胞癌组织和90例邻近组织作为对照,通过免疫组织化学染色证实了CCL5在肿瘤中低表达。预后分析发现CCL5低表达的患者总体生存期较差,更容易复发,提示CCL5低表达可能促进肝癌的发生发展。然而,CCL5在乳腺癌等肿瘤组织中的表达升高,沉默CCL5表达能够抑制乳腺癌干细胞的增殖和侵袭能力[23-24],表明CCL5可能在不同肿瘤的发生发展中存在特异性的作用,值得广大研究者进一步研究。
CCL5/CCR5信号通过NF-κB通路加速肝脏炎症反应[25]。在风湿病患者滑膜积液和组织中检测到CCL5表达水平的升高,伴随着滑膜积液中CCR5+T细胞、单核细胞和NK细胞明显增加和积累[9]。文献还提示CCL5/CCR5与慢性炎症性肠病有关[26]。本文分析CCL5表达与肿瘤组织中的6种免疫分子亚型(C1:伤口愈合;C2:干扰素-γ为主;C3:炎性因子;C4:淋巴细胞减少;C5:免疫静止;C6: TGF-β为主)的相关性发现,CCL5低表达与C4淋巴细胞减少型密切相关,而CCL5高表达组表达更多的C2、C3炎性细胞浸润亚型,说明CCL5在肝癌中与免疫抑制性微环境有关。不仅如此,我们还发现CCL5低表达组的免疫评分也较低,高表达组则CD8+T细胞浸润较多。
本文进一步探索了肝癌中CCL5降低的原因。Mexpress网页分析显示,CCL5表达与甲基化水平呈负相关。肝癌细胞系用甲基化抑制剂处理后能够使CCL5的表达升高,提示CCL5在肝癌中表达降低与高甲基化状态有关。此外,肿瘤的发生发展总伴随着肿瘤细胞的异常增殖。我们体外构建了CCL5过表达小鼠细胞系,结果发现过表达CCL5使细胞的增殖能力较对照组下降,说明CCL5过表达能够抑制细胞增殖。
总的来说,本研究发现CCL5在肝细胞癌中表达下降并与患者预后不良相关。CCL5低表达诱导了肝癌免疫抑制性微环境及肿瘤细胞增殖。CCL5低表达是由细胞内的一种内源性因素(高甲基化)引起的。CCL5可作为肝癌的一种抑癌因子和预后指标。

