巨大芽孢杆菌应用于改善茄芯香气品质的研究
毛亚浩 丁静怡 余君 陈雄 王志 杨春雷 姚兰
摘要 为降低茄芯烟叶中木质素含量、改善烟叶品质,从烟叶提取液中筛选出一株具有木质素降解能力的菌株,鉴定为巨大芽孢杆菌(Bacillus megaterium)。其中木质素过氧化物酶活性达到19.03 U/L,锰过氧化物酶活性达到4.35 U/L。使用该菌株进行茄芯烟叶发酵,通过单因素试验及中心组合响应面法优化,得到最佳工艺条件:接种量7%、发酵温度37 ℃、起始含水量25%、发酵时间6 d。在此最佳条件下,茄芯烟叶木质素降解率达到23.02%,且发酵后中性香气总量较发酵前提高了30.22%。
关键词 巨大芽孢杆菌;茄芯烟叶;木质素降解酶;响应面试验;中性香气
中图分类号 Q815 文献标识码 A 文章编号 0517-6611(2023)10-0010-06
doi:10.3969/j.issn.0517-6611.2023.10.003
Abstract In order to reduce the lignin content in filler tobacco leaves and improve the quality of tobacco leaves, a strain with lignindegrading ability was screened from tobacco leaf extract and identified as Bacillus megaterium. Among them, the enzymatic activity of lignin peroxidase reached 19.03 U/L, and the enzymatic activity of manganese peroxidase reached 4.35 U/L. The strain was used to ferment cigar tobacco leaves, and the optimal process conditions were obtained through single factor experiment and central combined response surface methodology optimization: the inoculum size was 7%, the fermentation temperature was 37 ℃, the initial water content was 25%, and the fermentation time was 6 d. Under this optimal condition, the degradation rate of lignin in cigar tobacco leaves reached 23.02%, and the total amount of neutral aroma after fermentation was increased by 30.22% compared with that before fermentation.
Key words Bacillus megaterium;Cigar filler leaves;Lignin degrading enzyme;Response surface experiment;Neutral aroma
木質素是烟草细胞壁的重要组成部分[1-2],在烟叶中的含量为7%~9%。木质素也是一种苯基丙烷类生物大分子,它通过氢键和共价键与纤维素和半纤维素紧密结合,共同形成了细胞壁致密的网状结构[3]。木质素结构复杂,具有一定的机械强度,难以降解[2]。细胞壁物质对雪茄烟的抽吸口感以及品质影响相当大,在雪茄点燃抽吸过程中木质素由于热解会产生儿茶酚、烷基儿茶酚等产物,这些产物会引起涩口,并且有致癌风险[3]。因此,降低烟叶中木质素含量,对改善雪茄品质至关重要。
研究表明木质素降解常用的方法包括微生物降解、外源添加酶制剂降解[4]。但由于木质素致密的网状结构导致外源酶制剂在处理烟叶时很难通过细胞壁,这就给酶法降解烟叶中的木质素带来了一定的难度[3]。相对于酶法降解木质素,改善烟叶品质,微生物处理更高效[5]。截至目前,发现的能降解木质素的菌株主要是真菌、细菌、放线菌等。相对于真菌,细菌更容易培养,且来源广泛。因此,细菌更适应烟叶发酵的环境[6-7]。另外,烟叶中低糖、高尼古丁的环境也决定了真菌在烟叶中很难存活,近年来对于木质素降解的研究也大多是细菌[2]。如李灵灵等[8]从土壤中筛选出一株变色栓菌,该菌可降解水稻秸秆中35%的木质素;Xu等[9]研究了细菌对木质素的解聚和利用,发现巨大芽孢杆菌可降解堆肥土壤中的木质素。但是,目前木质素降解菌在雪茄烟叶发酵中的应用鲜见报道。
该研究从烟叶提取液中筛选得到一株不仅可以产木质素降解酶的巨大芽孢杆菌,还可产淀粉酶、蛋白酶。将该菌应用于雪茄烟叶的发酵,探究该菌株对雪茄烟叶发酵后的木质素降解率、香气成分含量的影响,为工业生产中提高雪茄烟叶发酵品质奠定基础。
1 材料与方法
1.1 试验材料
供试烟叶来自湖北恩施州晾制结束的CX-014雪茄茄芯烟叶。
烟叶提取液来自湖北省烟草科学研究院。
初筛培养基:碱性木质素2 g/L、硫酸铵1.33 g/L、硫酸镁0.5 g/L、磷酸二氢钾1 g/L、磷酸氢二钠0.2 g/L、琼脂20 g/L,pH 7.0,121 ℃灭菌20 min。
LB-苯胺蓝培养基:胰蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L、苯胺蓝0.1 g/L、琼脂20 g/L,pH 7.2~7.4,121 ℃灭菌20 min。
亮蓝-BM培养基:酵母膏10 g/L、葡萄糖20 g/L、亮蓝0.1 g/L、琼脂20 g/L,pH 7.0,115 ℃灭菌30 min。
碱性木质素培养基:碱性木质素2 g/L、硫酸铵1.33 g/L、硫酸镁0.5 g/L、磷酸二氢钾1 g/L、磷酸氢二钠0.2 g/L,pH 7.0,121 ℃灭菌20 min。
产酶培养基:葡萄糖4 g/L、碱性木质素2 g/L、硫酸铵1.33 g/L、硫酸镁0.5 g/L、磷酸二氢钾1 g/L、磷酸氢二钠0.2 g/L,pH 7.0,115 ℃灭菌30 min。
LB培养基:胰蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L,pH 7.2~7.4,121 ℃灭菌20 min。
1.2 试验方法
1.2.1 木质素降解菌株的筛选。
1.2.1.1
初筛。取烟叶提取液5 mL,在无菌条件下,用无菌生理盐水进行梯度稀释,取10-3、10-4、10-5的稀释液各100 μL涂布到初筛培养基中,37 ℃培养24 h,挑选生长良好、形态差异明显的菌落反复划线进行分离纯化,挑取纯化后的单菌落经液体培养富集,然后使用终浓度为25%的甘油保藏于-80 ℃冰箱。
1.2.1.2
復筛。将初筛得到的单菌落接种于LB-苯胺蓝培养基和亮蓝-BM培养基中,37 ℃培养,观察菌落周围颜色变化,以平板中菌落周围是否有脱色圈来定性检测与木质素降解有关的木质素过氧化物酶(lignin peroxidase,Lip)、锰过氧化物酶(manganese peroxidase,Mnp)、漆酶(laccase,Lac)。其中苯胺蓝的脱色与木质素过氧化物酶、锰过氧化物酶有关[10],漆酶与亮蓝的脱色有关[10]。
1.2.2 菌株的鉴定。
将待测菌株在LB培养基中培养至对数期,收集菌体,使用细菌DNA提取试剂盒(TIANGEN DP302)提取细菌DNA。以该DNA为模板,使用引物27F/1492R 进行PCR扩增,琼脂糖凝胶电泳验证后将PCR产物送至武汉昆泰锐生物技术有限公司测序,将得到的序列在NCBI数据库中比对,且用Mega 11.0.8软件绘制系统发育树,判断该菌株的属别。
1.2.3 木质素降解酶活性的测定。
根据Niladevi等[11-12]的方法测定漆酶活性。
根据Tien等[13]的方法测定木质素过氧化物酶活性。
根据Kapich等[14-15]的方法测定锰过氧化物酶活性。
1.2.4 雪茄烟叶发酵。
1.2.4.1 雪茄烟叶固态发酵。
参照覃明娟等[16]的方法并进行适当的调整。将供试烟叶进行切丝,宽度为2 mm左右,称取30 g于250 mL三角瓶中,将筛选得到的木质素降解菌经LB培养基活化后接种于产酶培养基中,培养至对数生长期(按烟丝重量确定接种量),离心取菌体,加入等体积的无菌水进行重悬,得到重悬液,将重悬液与营养液(按烟丝重量添加1%谷氨酸、2%葡萄糖)混合后,均匀地喷洒在烟丝上,平衡水分,放入恒温恒湿培养箱中发酵6 d,保持恒温恒湿箱温度一定,湿度为80%,发酵结束后75 ℃烘干烟丝,过40目孔径筛。
1.2.4.2 响应面优化。
以接种量、发酵温度、起始含水量为考察因素,设计3因素3水平的中心组合试验,以木质素降解率为响应值,得到降解烟叶中木质素的最佳试验方案。
1.2.4.3 烟丝中木质素含量的测定。
采用克拉森木素法[17],将发酵后的烟丝75 ℃烘干,粉碎后过40目孔径筛,称取2 g粉末于索氏抽提装置中,用苯醇抽提至液体为无色,将抽提好的样品于105 ℃烘至绝干,取0.3 g于小烧杯中,准确加入浓度为72%的硫酸3 mL,充分润湿混匀,30 ℃水浴2 h,15 min 搅拌一次,将反应后的样品用84 mL蒸馏水洗涤转移到100 mL无菌瓶中,123 ℃蒸煮1 h后,冷却至室温,抽滤并将固体木质素pH洗至中性,105 ℃烘至恒重,称量烘干后的样品重量。
1.2.4.4 蒸馏萃取(SDE)-气质联用(GC-MS)测定烟草致香物质成分。
参考Yao等[18]的方法测定烟草中致香物质成分。
1.3 数据处理
所有试验均设置3个平行,采用Origin 2019作图、Mega 11.0.8构建系统发育树、Design expert 10进行响应面分析、TBtools软件进行热图绘制。
2 结果与分析
2.1 木质素降解菌株的筛选和鉴定
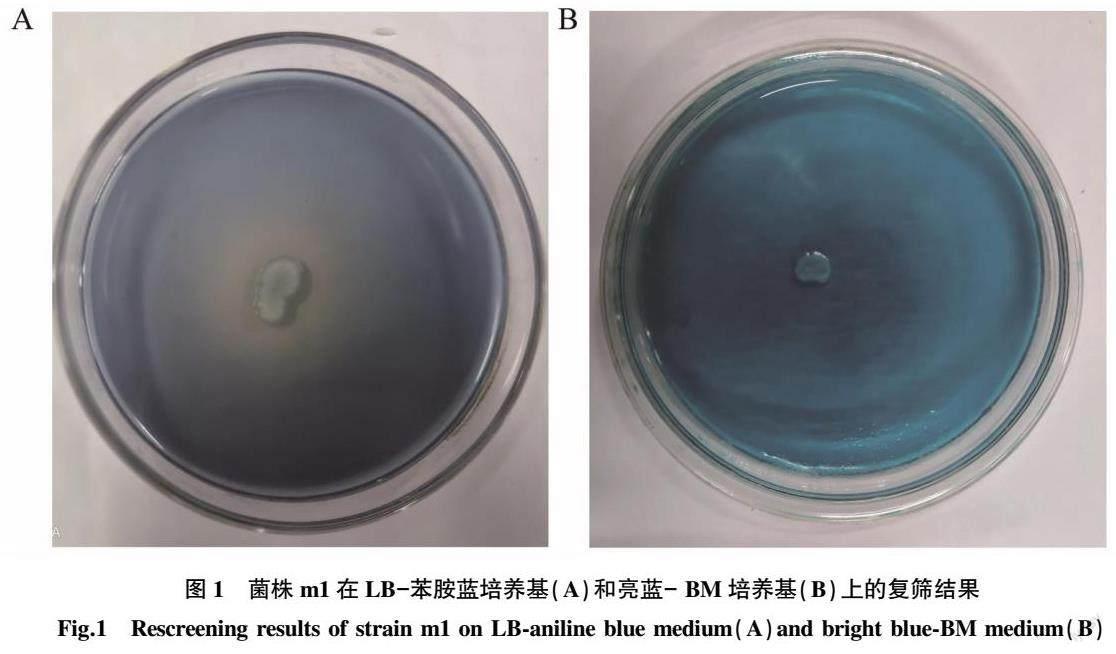
从烟叶提取液中筛选得到一株具有木质素降解能力的菌株,将得到菌株命名为m1。随后,经LB-苯胺蓝培养基和亮蓝-BM培养基复筛,如图1所示,发现该菌在LB-苯胺蓝培养基中能够产生明显的脱色圈,而在亮蓝-BM培养基中无脱色圈。说明该菌株具有产木质素过氧化物酶和锰过氧化物酶的能力,而无产漆酶能力。
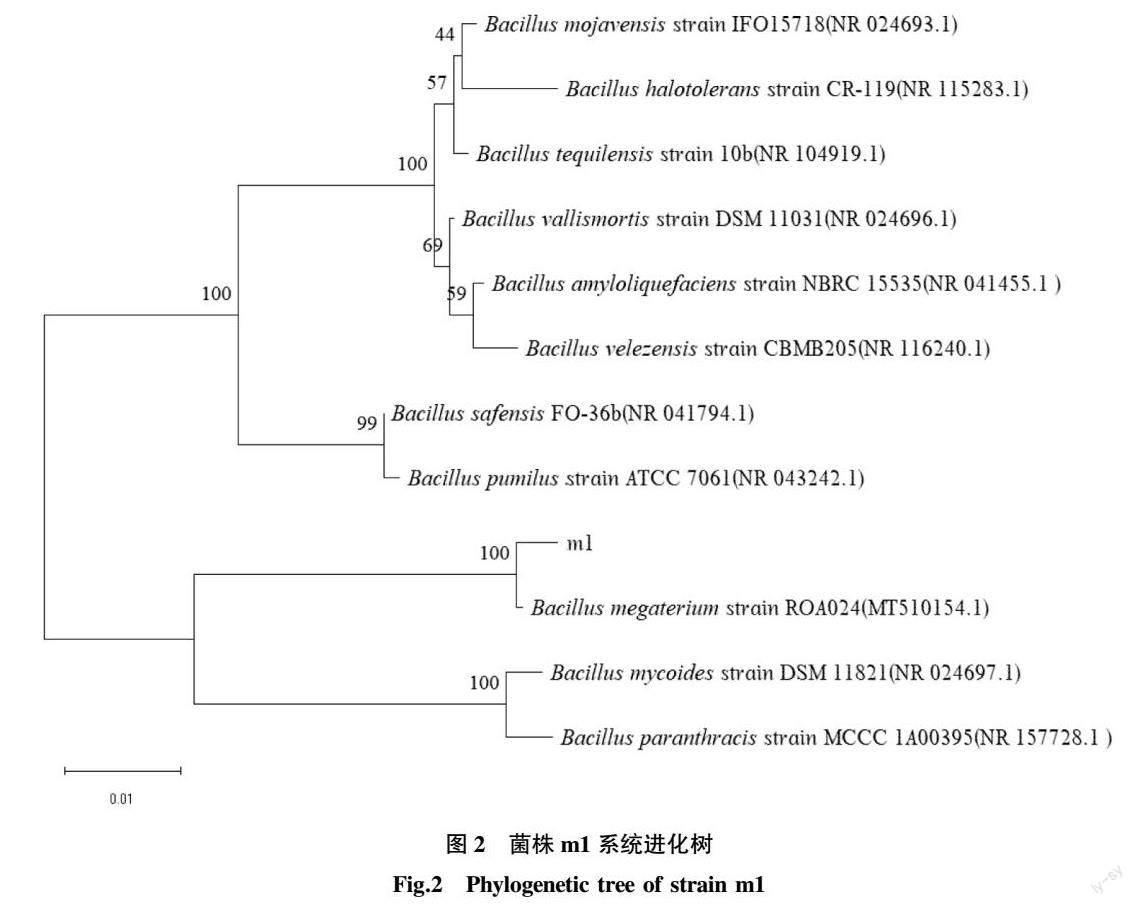
为进一步确定该菌株的属别对该菌株进行16S rDNA测序,将测序得到的序列在NCBI上进行比对,选取结果中相似度较高的菌株作为参考菌株绘制系统发育树(图2)。由图2可知,菌株m1的16S rDNA的基因序列与芽孢杆菌属中的巨大芽孢杆菌相似度最高,为100%,初步确定为巨大芽孢杆菌(Bacillus megaterium),命名为Bacillus megaterium m1。
2.2 木质素降解酶活性的检测
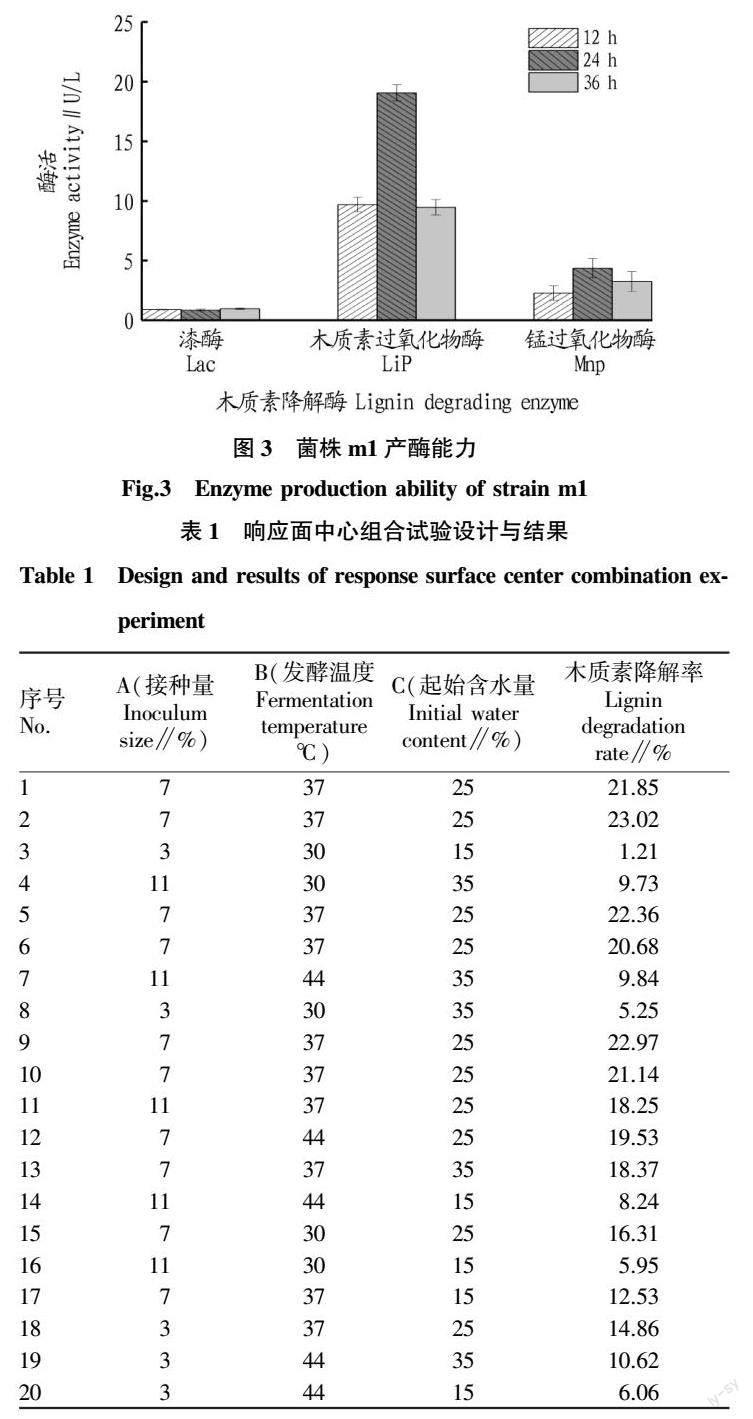
为进一步验证Bacillus megaterium m1产酶能力,该研究使用产酶培养基对其进行培养,检测木质素降解酶的活性。Bacillus megaterium m1分泌3种酶的活性见图3,结果表明B.megaterium m1具有较强的产木质素过氧化物酶(Lip)的能力,24 h时该酶的活性达到19.03 U/L。但该菌株分泌锰过氧化物酶(Mnp)的能力较弱,培养24 h时该酶的活性仅有4.35 U/L。整个过程中基本没有检测到漆酶(Lac)活性。
木质素降解是一个复杂的过程,能够降解木质素的微生物并不都能产与木质素降解有关的3种酶[19]。该研究结果与前人的研究结果一致,如鲍文英等[20]研究发现木质素降解酶中的漆酶大多数都是在霉菌中被发现,细菌产漆酶的报道相对较少;Wang等[21]研究巨大芽孢杆菌降解木质素发现该菌不具备产漆酶的能力;于少藤等[22]从烟叶中筛选得到一株降解木质素的盖氏假单胞菌,未优化前的Lip活性可以达到20 U/L,Mnp活性达到10 U/L,没有检测到Lac活性。
2.3 优化巨大芽孢杆菌发酵工艺
以烟叶中木质素的降解率为响应值,以接种量、发酵温度、起始含水量为考察因素,设计3因素3水平试验,试验设计以及结果见表1。从表1可以看出,方案2是所有方案中木质素降解率最高的,其木质素降解率达到了23.02%,发酵条件为接种量7%、发酵温度37 ℃、起始含水量25%。
从响应面拟合回归方程的方差分析(表2)可以看出,3个主效应对木质素降解率的影响从大到小依次为C>B>A,即起始含水量>发酵温度>接种量,该模型的决定系数(R2)为0.990 6,失拟项不显著(P>0.05),说明该模型中因变量与考察的自变量之间线性关系显著。接种量、发酵温度、起始含水量3个主因素均显著(P<0.05)。在3个主因素之间的交互作用中,接种量与发酵温度的交互作用对烟叶中木质素降解率具有显著影响(P<0.05),起始含水量与发酵温度的交互作用、接种量与起始含水量的交互作用均对烟叶中木质素降解率影响不显著(P>0.05)。不同因素间交互作用对烟叶木质素降解率影响见图4,曲面弯曲程度越大,表明影响越显著。
2.4 Bacillus megaterium m1对雪茄烟叶中性香气物质的影响
香气是评价发酵后雪茄烟叶质量的重要标准之一。烟叶香气成分包括中性香气成分、酸性香气成分和碱性香气成分,其中中性香气成分种类最多,对烟叶的香气质和香气量、香味类型影响最大[23]。烟叶中主要的中性致香物质成分是由前体物转化或反应得来的,根据前体物的来源可以把雪茄烟叶中的致香成分划分为叶绿素转化产物、苯丙氨酸转化产物、美拉德反应产物、类胡萝卜素转化产物、西伯烷类转化产物[24]。
由于烟叶中还原糖可与氨基化合物发生美拉德反应,从而影响烟草的香气品质[25]。研究表明葡萄糖与谷氨酸反应可产生木香[26]。张鹏等[27]研究添加不同的外源氨基酸与糖类对烟草薄片的影响发现,美拉德反应可以有效改善烟草薄片的质量。Yao等[18] 在雪茄烟叶中添加纤维素降解菌和营养液(谷氨酸、葡萄糖)发酵后,发现中性香气物质总量有显著提高。因此,为了确定发酵后增加的香气物质主要是来源于营养液还是B.megaterium m1的代谢,或者是两者共同作用的结果,在响应面最佳因素水平下分别做了3组对照试验:无菌水处理、营养液处理、B.megaterium m1加无菌水处理,与试验组(B.megaterium m1加营养液)进行比较。
对不同处理下的烟叶进行GC-MS香气分析,共检测出24种中性致香成分,其中叶绿素转化产物1种(新植二烯),类胡萝卜素转化产物8种(BETA-环柠檬醛、β-紫罗兰酮、4-氧代异佛尔酮、香叶基丙酮、巨豆三烯酮、6-甲基-5-庚烯-2-酮、6-甲基-5-庚烯-2-醇、法尼基丙酮),苯丙氨酸转化产物3种(苯甲醇、苯甲醛、苯乙醇),美拉德反应产物3种(糠醇、糖醛、3-乙酰基吡啶),西伯烷類转化产物1种(茄酮),其他类别的香气物质8种。从表4可以看出,相比于发酵前的烟叶(处理①),其他4个处理下烟叶香气总量均提高。在响应面最佳工艺条件(处理⑤)下,雪茄烟叶中性香气物质总量相比发酵前提高了30.22%。
菌落在其自身的生长发育过程中会利用烟叶中的某些物质作为营养成分,同时在这个过程中会分泌多种胞外酶,来降解烟叶中的木质素、蛋白质、淀粉、纤维素等大分子物质,从而引起烟叶中性致香成分的变化[28-29]。从表4可以看出,处理③(添加营养液)中糠醇、苯乙醇含量最高,分别达3.11、6.51 μg/g,相比于处理②(无菌水)分别提高了11.07%、14.81%。其中糠醇为美拉德反应产物,具有焦糖香;苯乙醇为苯丙氨酸代谢产物,具有花香[18,30]。这可能是由于在添加营养液的条件下,营养液中葡萄糖和氨基酸在一定条件下会发生美拉德反应,从而导致美拉德反应产物含量增加,而且添加营养液也有助于烟叶中原有微生物的生长代谢,也会在一定程度上促进烟叶的发酵,导致烟叶中部分中性香气物质含量增加[18,31]。
在处理④(B.megaterium m1加无菌水)中,4-氧代异佛尔酮、香叶基丙酮含量最高,分别达3.20、3.96 μg/g,其中4-氧代异佛尔酮约是处理②(无菌水)的2.7倍,香叶基丙酮含量相比于处理②提高了65.69%。4-氧代异佛尔酮、香叶基丙酮是烟叶中类胡萝卜素转化产物,具有木香和花香[18,30]。这说明加入B.megaterium m1可能会促进烟叶的发酵过程,而烟叶经发酵彻底后,95%的类胡萝卜素都能降解,因此类胡萝卜素转化产物含量增加[32]。
在处理⑤(B.megaterium m1加营养液)中,新植二烯、巨豆三烯酮、3-乙酰基吡啶含量最高,分别达536.16、30.54、2.81 μg/g。新植二烯、巨豆三烯酮相比于处理②(无菌水)分别提高了10.22%、65.89%,3-乙酰基吡啶约是处理②的2.3倍。新植二烯是烟叶中叶绿素转化产物,也是烟叶中性香气中最为丰富的成分,其本身具有清香气,而且具有降低烟的刺激性和增加香气的作用[18,30];巨豆三烯酮是烟叶中类胡萝卜素转化产物,具有清香和烟草香[18,30];3-乙酰基吡啶是烟叶中美拉德反应产物,具有坚果香[18,30]。这说明在添加营养液的条件下,可能更有助于B.megaterium m1的生长和代谢,促进了B.megaterium m1对烟叶中叶绿素、类胡萝卜素、淀粉、蛋白质等大分子前体物质的利用,从而导致这些重要中性香气物质含量的增加[29]。
图5为雪茄烟叶中性香气物质热图,从图5可以看出,处理⑤(B.megaterium m1加营养液)中3-乙酰基吡啶、植酮、苯甲醇、法尼基丙酮、巨豆三烯酮等含量相比于其他处理较高,而处理④(B.megaterium m1加无菌水)中4-氧代异佛尔酮、Α,2,6,6-四甲基-1-环己烯-1-巴豆醛含量相比于其他处理较高。说明加入B.megaterium m1发酵后对于烟叶中性香气的改善发挥着重要的作用。
3 结论与讨论
该研究利用从烟叶提取液中筛选到一株具有降解木质素能力的菌株Bacillus megaterium m1,将其与营养液协同添加到雪茄烟叶发酵中,主要考察了发酵温度、接种量、起始含水量对烟叶木质素降解的影响。通过响应面优化得到了最佳的发酵工艺条件:接种量7%、发酵温度37 ℃、起始含水量25%,发酵过程中影响木质素降解率因素顺序为起始含水量>发酵温度>接种量,其中烟叶起始含水量是影响烟叶木质素降解的最主要因素,随着烟叶含水量的变化,烟叶中木质素的降解也存在差异。这可能是由于烟叶中的微生物需要一定的水分来满足自身生长,在合适的水分和营养物质下,微生物才会生长并产生一些酶来降解烟叶中的木质素、蛋白质、淀粉等大分子物质[29]。
香气是评价烟叶发酵的重要指标之一[23]。与发酵后的烟叶相比,发酵前的烟叶具有刺激性、杂气大、香气不突出的特点[33]。该研究利用响应面来优化烟叶中大分子物质木质素的降解,在得到的最佳工艺条件下进行烟叶发酵,通过香气分析发现,中性香气总量与发酵前相比明显提高,烟叶中重要香气物质3-乙酰基吡啶、植酮、苯甲醇、法尼基丙酮、巨豆三烯酮等含量增加,香气更加突出。说明在此工艺条件下加入B.megaterium m1能够改善雪茄烟的香气品质。但该研究的发酵机制还需进一步探索,优化发酵的条件也有待于进一步完善,以期为雪茄烟的工业发酵应用提供参考。
参考文献
[1] ESPINOZASNCHEZ E A,LVAREZHERNNDEZ M H,TORRESCASTILLO J A,et al.Stable expression and characterization of a fungal pectinase and bacterial peroxidase genes in tobacco chloroplast[J].Electronic journal of biotechnology,2015,18(3):161-168.
[2] 郑秀成,陈泽裕,陈国庆,等.烟草废弃物中的难降解有机物的微生物降解研究进展[J].微生物学报,2020,60(12):2650-2663.
[3] 王娜,李仙,王定伟.烟草木质素降解菌的筛选及在烟草中的应用[J].云南农业大学学报,2008,23(1):64-67.
[4] 乔悦,甘洪宇,李响,等.木质素降解技术研究进展[J].化工科技,2019,27(4):84-88.
[5] 张鹏飞,李素艳,余克非,等.木质素降解细菌的筛选及园林废弃物降解研究[J].安徽农业大学学报,2018,45(4):676-681.
[6] CHAI L Y,CHEN Y H,TANG C J,et al.Depolymerization and decolorization of kraft lignin by bacterium Comamonas sp. B9[J].Applied microbiology and biotechnology,2014,98(4):1907-1912.
[7] 梁叢颖,林璐.环境微生物介导的木质素代谢及其资源化利用研究进展[J].微生物学通报,2020,47(10):3380-3392.
[8] 李灵灵,王敬红,赵铎,等.木质素降解菌BYL-7的筛选及降解条件优化[J].微生物学通报,2020,47(12):4059-4071.
[9] XU R,ZHANG K,LIU P,et al.Lignin depolymerization and utilization by bacteria[J].Bioresource technology,2018,269:557-566.
[10] 张庆芳,于宗莲.一株高效木质素降解细菌的筛选及产酶条件的优化[J].中国农业科技导报,2014,16(2):143-148.
[11]NILADEVI K N,JACOB N,PREMA P.Evidence for a halotolerantalkaline laccase in Streptomyces psammoticus:Purification and characterization[J].Process biochemistry,2008,43(6):654-660.
[12] FUKUSHIMA Y,KIRK T K.Laccase component of the Ceriporiopsis subvemispora lignindegrading system[J].Applied and environmental microbiology,1995,61(3):872-876.
[13] TIEN M,KIRK T K.Lignin peroxidase of Phanerochaete chrysosporium[J].Methods enzymology,1988,161:238-249.
[14] KAPICH A N,PRIOR B A,BOTHA A,et al.Effect of lignocellulosecontaining substrates on production of ligninolytic peroxidases in submerged cultures of Phanerochaete chrysosporium ME446[J].Enzyme and microbial technology,2004,34(2):187-195.
[15] WARIISHI H,VALLI K,GOLD M.Manganese(II)oxidation by manganese peroxidase from the basidiomycete Phanerochaete chrysosporium.Kinetic mechanism and role of chelators[J].The journal of biological chemistry,1992,267(33):23688-23695.
[16] 覃明娟,陈森林,赵强忠,等.植物乳杆菌在改善各产区烟叶品质中的应用[J].食品与机械,2020,36(5):199-204,226.
[17] 臧亚楠,孔宁川,李地艳,等.烟草木质素的研究概况[J].云南农业大学学报(自然科学),2015,30(5):822-828.
[18] YAO L,LI D Y,HUANG C Y,et al.Screening of cellulaseproducing bacteria and their effect on the chemical composition and aroma quality improvement of cigar wrapper leaves[J].BioResources,2022,17(1):1566-1590.
[19] BROWN M E,CHANG M C Y.Exploring bacterial lignin degradation[J].Current opinion in chemical biology,2014,19:1-7.
[20] 鮑文英,江经纬,周云,等.一株木质纤维素降解菌的筛选及其全基因组分析[J].微生物学报,2016,56(5):765-777.
[21] WANG Y X,LIU Q,YAN L,et al.A novel lignin degradation bacterial consortium for efficient pulping[J].Bioresource technology,2013,139:113-119.
[22] 于少藤,毛淑蕊,胡安妥,等.改善烟叶品质微生物的筛选及其作用效果研究[J].南京农业大学学报,2021,44(4):766-777.
[23] 潘玲.湖北烤烟中性香气成分与烟叶其他理化特性及生态因素相关性研究[D].武汉:湖北大学,2016.
[24] 时向东,王旭锋,林开创,等.雪茄外包皮烟堆积发酵中主要中性香气物质的变化[J].西北农业学报,2013,22(7):114-119.
[25] 王林,周平,贺佩,等.糖类物质对烟草香气品质的影响研究进展[J].中国烟草科学,2021,42(6):92-98.
[26] 文冬梅.美拉德反应制备烟用香精关键配料及工艺优化的研究[D].广州:华南理工大学,2013.
[27] 张鹏,于静洋,龙章德,等.美拉德反应改善烟草薄片质量的应用研究[J].食品与机械,2016,32(3):39-44.
[28] 全铭沁,董惠忠,沙云菲,等.黑曲霉发酵液改善上部烟叶风味品质的研究[J].中国酿造,2019,38(3):170-176.
[29] 许春平,孙懿岩,姜宇,等.芽孢杆菌生物制剂对复烤后烟叶化学成分的影响[J].轻工学报,2019,34(3):34-41.
[30] 于航,刘砚婷,尚梦琦,等.基于致香成分分析的雪茄烟产地间差异[J].烟草科技,2021,54(9):58-71.
[31] 帅瑶,陶菡,田运霞,等.复合菌种发酵烟叶产酶及挥发性风味物质变化[J].河南农业科学,2020,49(10):162-175.
[32] 吴彦辉,白静科,李建华,等.河南浓香型烟叶致香物质及风格成因研究进展[J].现代农业科技,2019(24):207-211.
[33] 陈栋,李猛,王荣浩,等.国产雪茄茄芯烟叶研究进展[J].扬州大学学报(农业与生命科学版),2019,40(1):83-90.

